灵杞黄斑颗粒含药血清预处理对人视网膜色素上皮细胞衰老的保护作用
刘晓娟 姜海涛 尹莉莉 吴星伟 顾 青
年龄相关性黄斑变性(age-related macular de generation,AMD)是发达国家50岁以上人群致盲的首要原因。目前认为视网膜色素上皮(retinal pigment epithelium,RPE)细胞的氧化应激与干性AMD发病密切相关,而氧化应激能够诱导或加速细胞衰老的发生。因此,氧化应激诱导的RPE细胞衰老模型是研究此类疾病发病机制和治疗方法的一个切入点。目前干性AMD病因并未完全明了,迄今为止未有明确有效的治疗方法来提高视力或防止视力恶化,也无有效的预防措施。本实验中灵杞黄斑颗粒(Lingqi Huangban Granula,LQHB)是我们自制的复方中药颗粒冲剂〔1〕,已应用于临床十多年,主要用于年龄相关性黄斑变性以及其他各类视网膜变性类疾病。本实验采用血清药理学方法〔2〕,通过探讨中药LQHB含药血清预处理对氧化应激诱导的人RPE细胞衰老损伤的保护作用,为临床应用提供客观实验依据。
1 材料与方法
1.1 材料
人视网膜色素上皮细胞株(ARPE l9,美国),将冻存的RPE细胞株,通过复苏、接种、培养、消化后,获得单细胞悬液备用。30%H2O2(上海虹光化工厂),DMEM培养基、F12培养基、10%胎牛血清、胰蛋白酶、青霉素、链霉素(上述均购自美国GIBCO公司)、MTS(Promega 公司)、DMSO(分析纯)、细胞周期检测试剂盒和细胞衰老检测试剂盒(碧云天公司)。高速冷冻离心机(Zentmifugen Hettich 公司)、Eppendorf管(Eppendorf公司)、4 ℃冰箱(青岛海尔公司)、CO2细胞培养箱(Sanyo公司)、细胞培养板(Nunc公司)、DK-8A型电热恒温水槽(上海森信实验仪器有限公司)、超洁净工作台(上海博讯实业有限公司医疗设备厂)、流式细胞仪(Pharmacia Biotech公司)、分光光度仪(HACH,USA)。实验动物雄性SD大鼠24只,清洁级,体重220~230 g,购于中国科学院上海实验动物中心。动物合格证号:SCXK(沪)2008-0016。LQHB(沪药制字Z05050795,上海市药监局医院制剂认证。生产批号:20100101,上海练塘中药厂生产,规格15 g/包,含生药53 g/包。主要组成(质量比例):当归10份、川芎10份、菟丝子10份、灵芝10份、苍术10份、丹参10份、党参10份、海藻10份、肉苁蓉15份、枸杞子l0份。
实验动物购回后于实验动物房适应性饲养,自由摄水饮食,笼养。24只SD大鼠随机分成中药血清组(16只)和空白血清组(8只),中药血清组又分为低剂量组和高剂量组,每组8只。采用灌胃方式给药,依据动物与人体的每千克体质量剂量折算系数表,每次低剂量组和高剂量组的给药剂量分别为3.125 g/kg 和 6.25g/kg,分 2 次给药(8 时,20 时),连续 3d〔3〕。空白血清组予以同等量生理盐水灌胃。末次喂药前禁食12 h,灌药后1~2 h内无菌条件下腹主动脉取血。空白血清组同一时间点取血。取血后4℃冰箱中静置过夜,3000 r/min,25 min离心,取上清液并将同组别的不同大鼠血清混合。经56℃,30 min灭活分装,并于超净台内0.22 μm针式滤过器过滤分装,-20℃冰箱贮存备用。
1.2 MTS法检测细胞活力
1.2.1 细胞制备:将RPE细胞以2.5×104个/ml的密度接种于96孔板,每孔100 μl,加入含10%FBS的DMEM/F12培养液置于37℃、5%CO2细胞培养箱中培养,细胞达80%~90%后取出。
1.2.2 分组培养:(1)弃上清液,PBS冲洗2次后分5组:分别为正常对照组(normal control,NC)、模型组(model,M)、空白血清组(model+Blank serum group,MB)以及低剂量含药血清组(model+low-dose LQHB group,ML)、高剂量含药血清组(model+high-dose LQHB group,MH),各组均加入无血清 DMEM/F12培养液,血清组分别加入含10%的制备空白血清,低、高剂量含药血清,置于37℃、5%CO2细胞培养箱中培养24 h后取出。(2)弃上清液,PBS冲洗2次后分别于模型组,空白血清组,低、高剂量含药血清组4组每孔加入 H2O2,使 H2O2终浓度为 150 μmol/L,继续置于37℃、5%CO2细胞培养箱中培养2 h。(3)弃上清液,PBS冲洗2次后加入无血清DMEM/F12培养液,置于37℃、5%CO2细胞培养箱中培养24 h。
1.2.3 MTS法检测:将20μl MTS直接加入培养板孔的培养基中,继续培养2 h。摇床上放置5 min,490 nm分光光度仪上机检测。每组6个复孔,实验重复3次。
1.3 流式细胞仪检测细胞周期
1.3.1 细胞制备:将RPE细胞以1×106个/ml密度接种于培养皿,加入含10%FBS的DMEM/F12培养液置于37℃、5%CO2细胞培养箱中培养,细胞达80%~90%后取出。
1.3.2 分组培养:弃上清液,PBS冲洗2次后分组,步骤方法同1.2.2。
1.3.3 流式细胞仪检测:用0.25%胰蛋白酶消化收集细胞,按照细胞周期检测试剂盒说明操作。上流式细胞仪检测。应用Cell Quest软件包中的Modifit LT 2.0软件处理,进行细胞周期分析。
1.4 细胞衰老的检测
1.4.1 细胞制备:将RPE细胞以8×104个/ml密度接种于置有小玻片的24孔板,加入含10%FBS的DMEM/F12 培养液 500 μl置于 37℃、5%CO2细胞培养箱中培养,细胞达70%~80%后取出。
1.4.2 分组培养:弃上清液,PBS冲洗2次后分组,步骤方法同1.2.2。
1.4.3 细胞衰老检测:(1)弃上清液,PBS洗涤3 min×3遍,按照碧云天细胞衰老检测试剂盒说明书操作。(2)37℃湿盒内孵育过夜后用伊红套染未着色细胞胞浆,普通光学显微镜下观察并拍照,在显微镜(×400倍)下进行细胞计数,随机选取阳性细胞分布均匀的区域,每组检查10个视野,每个视野数出总细胞数和阳性细胞数,计算出阳性细胞的百分比,即为衰老细胞百分率。
1.5 统计学处理
2 结果
2.1 LQHB含药血清对RPE细胞活力的影响
高、低剂量LQHB含药血清组的光密度值低于正常对照组,高于模型组,差异有统计学意义(P<0.05),而空白血清组与模型组之间差异无统计学意义(P>0.05)(表 1)。
表1 MTS法测定各组RPE细胞的光密度值[D(492nm),±s]

表1 MTS法测定各组RPE细胞的光密度值[D(492nm),±s]
注:与正常对照组比较,①P<0.05;与模型组比较,②P>0.05,③P<0.05;与低剂量组比较,④P>0.05。以P<0.05为差异有统计学意义(方差分析并做SNK-q检验)
?
2.2 LQHB含药血清对RPE细胞周期的影响
高、低剂量LQHB含药血清组处于G1期的RPE细胞比例低于模型组,差异有统计学意义(P<0.05),而空白血清组与模型组之间无显著性差异(P>0.05)(表 2)。
表2 流式细胞仪检测各组RPE细胞G1期构成比例(±s,%)
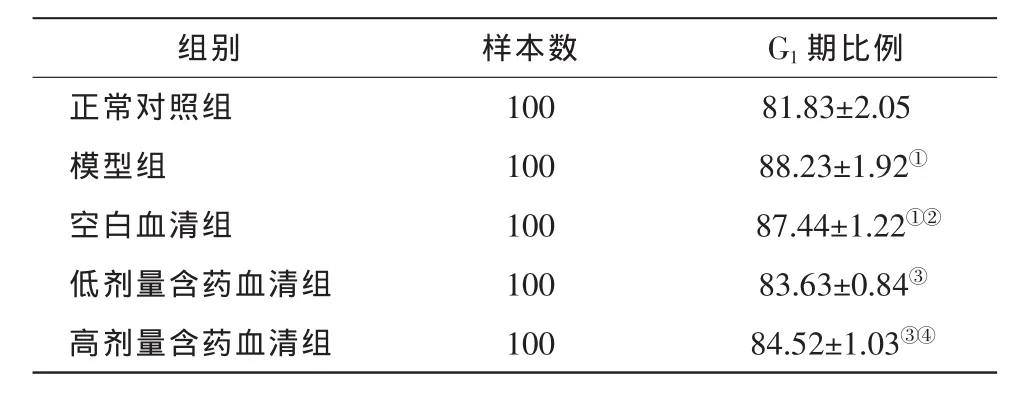
表2 流式细胞仪检测各组RPE细胞G1期构成比例(±s,%)
注:与正常对照组比较,①P<0.05;与模型组比较,②P>0.05,③P<0.05;与低剂量组比较,④P>0.05。以P<0.05为差异有统计学意义(方差分析并做SNK-q检验)
组别 样本数 G1期比例正常对照组 100 81.83±2.05模型组 100 88.23±1.92①空白血清组 100 87.44±1.22①②低剂量含药血清组 100 83.63±0.84③高剂量含药血清组 100 84.52±1.03③④
2.3 细胞衰老的检测[衰老相关-β-半乳糖苷酶(SA-β-Gal)染色]
高、低剂量LQHB含药血清组衰老细胞所占比例均较模型组低,差异有统计学意义(P<0.05),而空白血清组与模型组之间差异无统计学意义(P>0.05)(表 3)。
表3 SA-β-Gal染色法检测各组衰老RPE细胞的比例(±s,%)
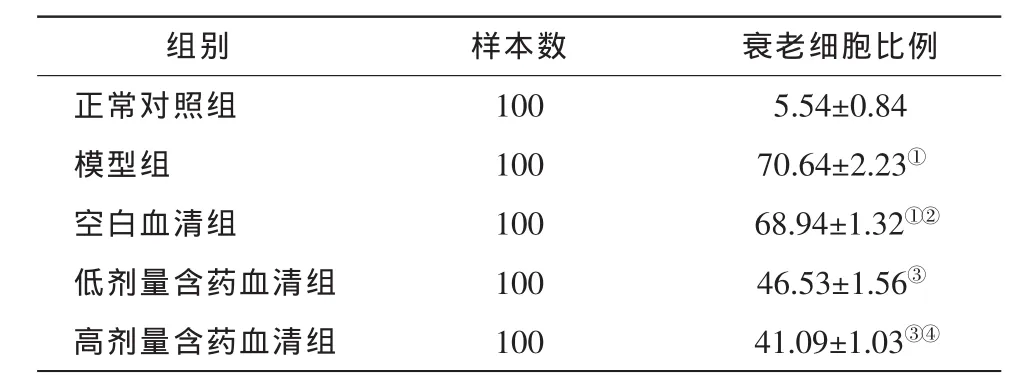
表3 SA-β-Gal染色法检测各组衰老RPE细胞的比例(±s,%)
注:与正常对照组比较,①P<0.05;与模型组比较,②P>0.05,③P<0.05;与低剂量组比较,④P>0.05。以P<0.05为差异有统计学意义(方差分析并做SNK-q检验)。SA-β-Gal:衰老相关-β-半乳糖苷酶
组别 样本数 衰老细胞比例正常对照组 100 5.54±0.84模型组 100 70.64±2.23①空白血清组 100 68.94±1.32①②低剂量含药血清组 100 46.53±1.56③高剂量含药血清组 100 41.09±1.03③④
3 讨论
AMD是以RPE细胞外基质(extracellularmatrix,ECM)堆积引起的以Bruch’s膜增厚为特征的一类疾病。虽然其视力损害的原因在于光感受器功能失调,但发病却始于RPE细胞的衰老。通过外源性加入H2O2诱导是目前较公认和成熟的研究细胞衰老的一种方法〔4-6〕。尽管干性AMD的发病率高,对视力影响严重,但可以得到治疗的患者却很有限。祖国医学在治疗干性AMD方面进行了积极的探索,研究证实一些中药单体和复方治疗干性AMD取得了一定的疗效,显示了中医药治疗的独特优势。LQHB已在我院眼科15年临床应用中取得较好疗效,前期实验研究发现:LQHB能够明显减轻光损伤引起的大鼠视网膜氧化应激损伤〔7〕;对缺氧引起的RPE细胞损伤具有一定的保护作用〔8〕;能够抑制光损伤引起的感光细胞凋亡和神经胶质细胞增生;改善ERG的b波与振荡电位(OPs)振幅及潜伏期,提示LQHB具有抗氧化作用,能够通过改善视网膜神经组织细胞的生物循环与代谢而缓解病情,展现了对干性AMD良好的治疗前景〔9〕。
研究认为衰老的RPE细胞具有如下特征:包括细胞肥大,衰老相关-β-半乳糖苷酶活性增高,细胞生长停止以及细胞周期停滞在G1期〔10-11〕。细胞衰老最显著的特征是细胞在很长一段时间内仍然维持代谢活性,但因阻滞于G1期,失去了对有丝分裂原的反应能力和合成DNA的能力,不能进入S期,本实验验证了这一点,并发现LQHB含药血清预处理能够减缓其衰老。SA-β-Gal染色活性检测以X-Gal为底物,在衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物,从而在光学显微镜下很容易观察到变成蓝色的表达β-半乳糖苷酶的细胞或组织。在本实验中LQHB含药血清组着色呈蓝色的衰老RPE细胞比例远少于模型组(70%)。空白血清组的各项检测结果与模型组无明显差异,而高、低剂量组间各结果比较亦无统计学意义的差异,其原因有待进一步研究。
本文初步阐明了灵杞黄斑颗粒含药血清预处理对人RPE细胞衰老损伤的保护作用,其具体作用机制仍需进一步研究。
[1] 陈瑞芬,朱兰,归成等.黄斑I号颗粒的定性鉴别[J].中成药,2001,11(23):851-853.
[2] 詹红生.含药血清实验方法及其在中药新药研制中的应用展望[J].浙江中医学院学报,2000,24(2):79.
[3] 李仪奎.中药血清药理学实验方法的若干问题[J].中药新药与临床药理,1999,10(2):95.
[4] Kook D, Wolf AH, Yu AL,et al.The Antioxidative Effect of QuercetinontheHumanRPEInVitro[J].IOVS,April2008,49(4):1712-1720.
[5] Yu AL,Fuchshofer R,Kook D,et al.Subtoxic Oxidative Stress Induces Senescence in Retinal Pigment Epithelial Cells via TGF-β Release[J].Investigative Ophthalmology&Visual Science, 2009,50(2): 926-935.
[6] Zdanovs S,Remacle J, Toussaint O.Establishment of H2O2-Induced Premature Senescence in Human Fibroblasts Concomitant with Increased Cellular Production of H2O2[J].Ann.N.Y.Acad.Sci., 2006,1067:210-216.
[7] 宫媛媛,宋毅,解正高,等.中药黄斑颗粒对大鼠视网膜光损伤的防护作用[J].中西医结合学报,2008,6(11):1159-1163.
[8] 刘晓娟,宫媛媛,吴星伟,等.黄斑颗粒含药血清预处理对人RPE细胞缺氧损伤的保护作用[J].上海中医药大学学报,2010,24(5):74-76.
[9] 宫媛媛,吴星伟.黄斑I号方对兔眼视网膜电流图的实验研究[J].临床眼科杂志,2000,2(8):145-147.
[10] Glotin AL, Debacq-Chainiaux F, Brossas, et al.Prematurely senescent ARPE-19 cells display features of age-related macular degeneration[J].Free Radic.Biol.Med.,2008,44:1348-1361.
[11] Matsunaga H,Handa JT,Aotaki-Keen A,et al.Beta-galactosidase histochemistry and telomere loss in senescent retinal pigment epithelial cells[J].Invest.Ophthalmol.Vis.Sci., 1999, 40: 197-202.

