绒毛状烟草钙依赖蛋白激酶基因家族分析
张 丽,张 磊,康 乐,王军伟,王 鲁,龚达平,刘贯山*
(1.中国农业科学院烟草研究所,中国农业科学院烟草遗传改良与生物技术重点开放实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.云南烟草集团(有限)责任公司,云南 玉溪 653100)
钙依赖蛋白激酶(calcium-dependent protein kinase/calmodulin-like domain protein kinase,CDPK)普遍存在于植物、藻类及部分原生动物中,广泛分布于植物的各种组织且在空间表达存在明显差异。CDPK基因的同系物众多,它们在结构上相对保守,均含有N端可变区、ATP结合的激酶区、自我抑制区和类钙调蛋白结合区[1-4]。CDPK的 N端可变区可能通过识别不同的底物来影响不同的CDPK亚型参与植物的碳氮代谢、离子和水分跨膜运输、细胞骨架、气孔运动、生长发育等生理过程[5-6]。CDPK还参与植物的生物和非生物胁迫过程,例如小麦中有9个CDPK基因与小麦白粉病有关,TaCPK4对盐害、冷害、ABA和GA处理均有反应[7];拟南芥AtCPK12对种子萌发及生长过程的ABA信号起负调控作用[8],AtCPK6参与保卫细胞的甲基茉莉酸信号的正调控过程[9];普通烟草 NtCDPK12可能参与烟草干旱和盐害有关的生理过程[10]。综上所述,CDPK基因与植物的逆境反应存在一定的联系。普通烟草(Nicotiana tabacum)可能是林烟草(Nicotiana sylvestris)和绒毛状烟草(Nicotiana tomentosiformis)天然杂交的F1染色体自然加倍而形成的[11]。研究绒毛状烟草和林烟草的 CDPK基因,不仅有利于研究普通烟草CDPK基因及绒毛状烟草、林烟草与普通烟草的进化关系,还可以为不同的CDPK亚型与生物和非生物胁迫之间的联系提供条件。本研究通过检索绒毛状烟草基因组框架图数据库,分离得到绒毛状烟草的CDPK基因,分析该基因家族成员的序列特征、进化关系和表达特性,为在基因组范围内研究绒毛状烟草CDPK基因家族功能奠定基础。
1 材料与方法
1.1 植物材料
试验材料为温室内培养的绒毛状烟草。采集4~5片真叶期的绒毛状烟草的根、茎、叶以及生殖生长期的花,经液氮速冻后于-70 ℃保存备用。
1.2 数据来源
用拟南芥、普通烟草和烟草属其他种的CDPK基因序列检索绒毛状烟草基因组框架图数据库。将分离得到CDPK基因进行准确性验证,并手工进行校正。BLAST搜寻时使用默认参数,并随时在NCBI网站进行核酸水平和蛋白质水平的同源性比对,以验证候选序列的准确性。应用NCBI的ORF finder软件对全长cDNA序列进行可读框架分析。
1.3 基因结构分析
利用Gene Structure Display Server(http://gsds.cbi.pku.edu.cn/chinese.php)在线软件对绒毛状烟草CDPK的 CDS序列和对应的全基因组序列进行分析,从而绘出基因结构图[12]。
1.4 蛋白结构域分析
应用在线分析软 SMART(http://smart.emblheidelberg.de/)和 Plantsp Feature Scan(http://plantsp.genomics.purdue.edu/)预测绒毛状烟草CDPK基因家族的蛋白质结构[13]。参数设置为默认。
1.5 基因GC含量计算
用geecee(http://weblab.cbi.pku.edu.cn/program)软件计算绒毛状烟草CDPK基因的GC含量,并用cpgplot(http://weblab.cbi.pku.edu.cn/program)软件对绒毛状烟草、普通烟草及拟南芥的CDPK直系同源基因的GC含量进行比较。
1.6 序列比对和系统进化树分析
以普通烟草的 NtCDPK1编码的蛋白质序列为标准序列,利用ClustalW2软件对绒毛状烟草CDPK家族的氨基酸序列进行多序列比对。以多序列比对的结果为基础,用Mega软件(版本4.1)进行进化树校验生成无根进化树。进化树生成采用neighbor-joining方法,由 1000次自举值重复抽样组成[14]。
1.7 主坐标分析
用主坐标分析(Principal Coordinates Analysis, PCO)在线分析软件(http://pbil.univ-lyon1.fr/ mva/ pco.php)对多序列比对结果进行分析,参数设置为默认。
1.8 基因表达分析
使用TIANGEN TRNzol-A+总RNA提取试剂盒分别提取绒毛状烟草根、茎、叶和花的总RNA,用 DNaseⅠ(TIANGENG,北京)处理,采用PrimeScriptTM RT-PCR Kit(TaKaRa)合成 cDNA第一链。以烟草核糖体蛋白基因(NtL25,GenBank accession no.L18908)为内参基因[15],定量PCR反应的模板的浓度,反应程序为94 ℃ 5 min,94℃ 30 s、58 ℃ 30 s、72 ℃ 40 s共 35 循环,最后 72 ℃ 10 min。针对绒毛状烟草CDPK基因特异的区域设计引物(表1)。PCR反应程序为:94 ℃ 5 min,94 ℃30 s、56 ℃ 30 s、72 ℃ 40 s共 35 循环,最后 72 ℃10 min。

表1 引物及序列Table1 Primers used in this study
2 结 果
2.1 绒毛状烟草CDPK基因的结构特征
对绒毛状烟草基因组框架图数据库(中国农业科学院烟草研究所,数据未公开)进行检索,共获得 25个 CDPK基因,并将它们命名为 NtoCPKX(Nicotiana tomentosiformis calcium-dependent protein kinase X, X代表1, 2, 3, … , 25)。通过对绒毛状烟草25个CDPK基因的结构进行分析,发现亚家族Ⅳ中的内含子个数与其它3个家族存在着明显差异:亚家族Ⅰ-Ⅲ中的内含子个数大多为 6~9个,而亚家族Ⅳ中的NtoCPK19和NtoCPK6的内含子个数分别为14和11(图1、表2)。这些内含子可分为3种类型[3]:相位数为0的内含子(插入到2个密码子之间的内含子),相位数为1的内含子(插入到1个密码子的第1个碱基的内含子)和相位数为2的内含子(插入到1个密码子的第2个碱基的内含子)。研究表明其内含子的插入位置相对是保守的,大部分内含子的插入位置位于蛋白激酶区。同一家族基因的内含子个数和插入位置保守性较高,这说明它们的同源性高,进化关系近。
2.2 绒毛状烟草CDPK的序列特征和蛋白结构域
绒毛状烟草CDPK家族成员具有典型CDPK的特征,从N端到C端的结构域依次为N端可变区、ATP结合的激酶区、自我抑制区和类钙调蛋白结合区(图形未列出)。大多数绒毛状烟草CDPK的类钙调蛋白结合区含有4个保守的EF手性钙结合结构域,但NtoCPK10和NtoCPK24仅有3个EF手性结构域(表2)。由SMART软件分析结果可知,绒毛状烟草 CDPK家族成员都有明显的 Ca2+/钙调素依赖蛋白激酶及丝氨酸/苏氨酸蛋白激酶的激酶区以及类似于钙调素的钙结合区。可见,这 25个NtoCPKs具有典型的CDPK基因编码产物的特征,即我们分离得到了25个完整的CDPK基因。
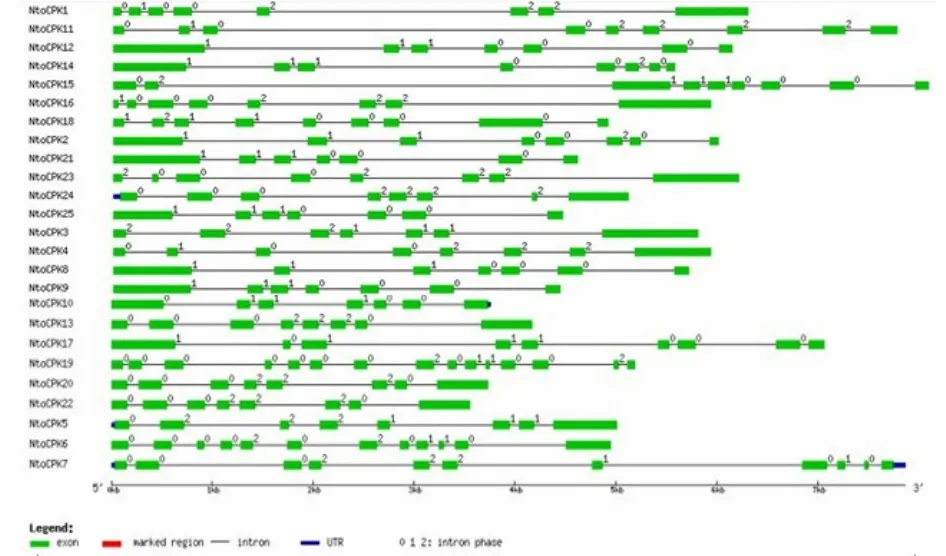
图1 绒毛状烟草CDPK基因家族的基因结构Fig.1 Gene structure of CDPK gene family in N.tomentosiformis
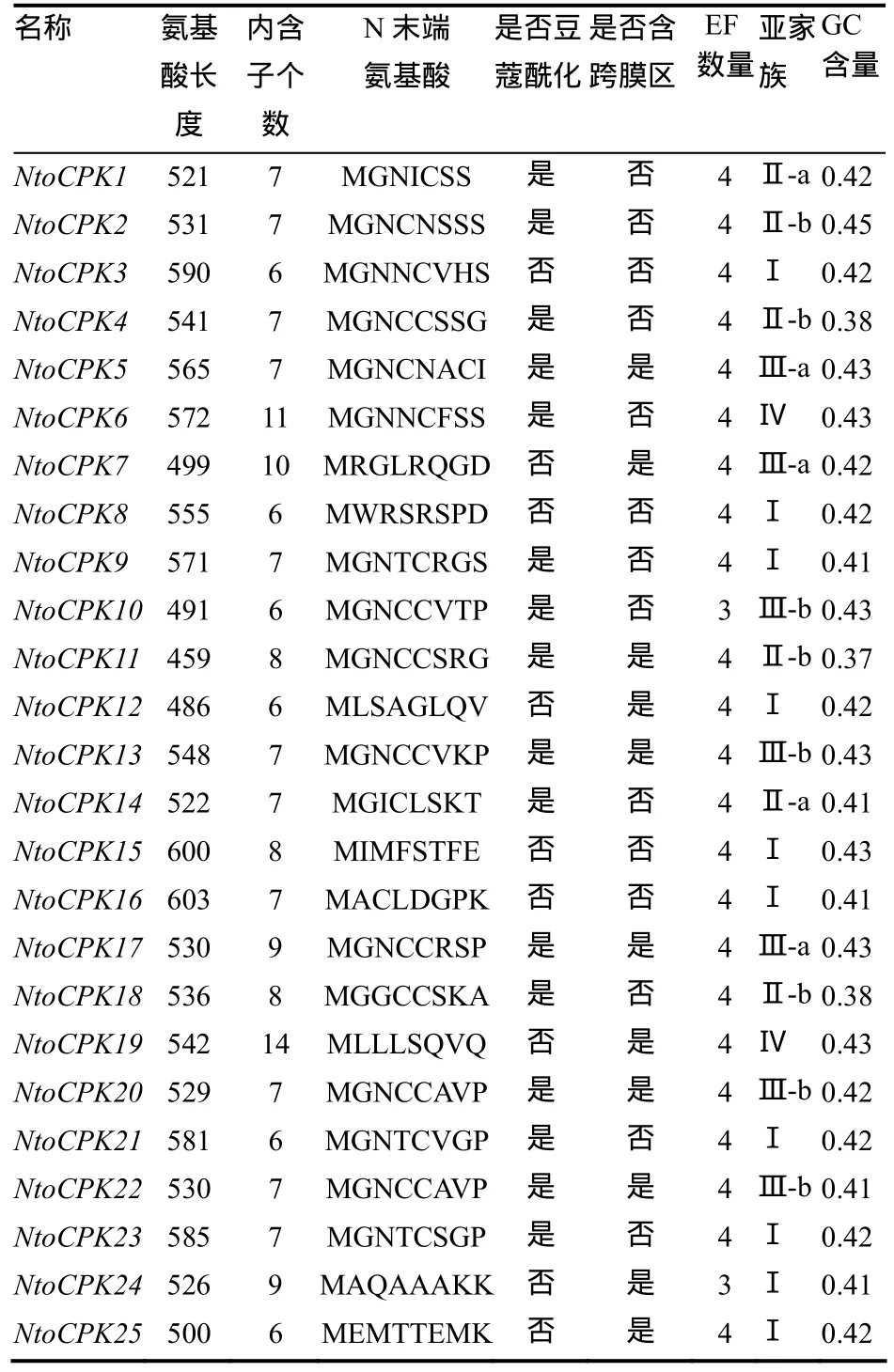
表2 绒毛状烟草CDPK的特征Table2 Characteristics of CDPKs in N.tomentosiformis
CDPK的N末端在氨基酸序列和氨基酸长度上差异较大,如拟南芥CDPK的N末端的氨基酸长度从25(AtCPK11) 到约200(AtCPK2)不等。但在一定条件下,其N末端的甘氨酸残基能被豆蔻酸共价修饰从而促进其与膜结合。由表2可知,绒毛状烟草中有16个CDPK的N末端均含有豆蔻酰化基序,11个CDPK含有潜在的跨膜区。
2.3 绒毛状烟草CDPK基因的GC含量
大多数绒毛状烟草CDPK基因GC的含量位于41%~43%(表2),平均值为41.64%,它与拟南芥的GC含量均值42.1%很接近。此外,通过cpgplot软件对NtoCPK2、11和12与普通烟草及拟南芥中的直系同源基因进行比较后发现,直系同源基因的GC含量随序列长度的变化趋势整体上是一致的(图2)。
2.4 系统进化树分析

图2 绒毛状烟草、普通烟草和拟南芥部分CDPK直系同源基因的GC含量Fig.2 GC contents of orthologous CDPK genes from N.tomentosiformis, N.tabacum and Arabidopsis
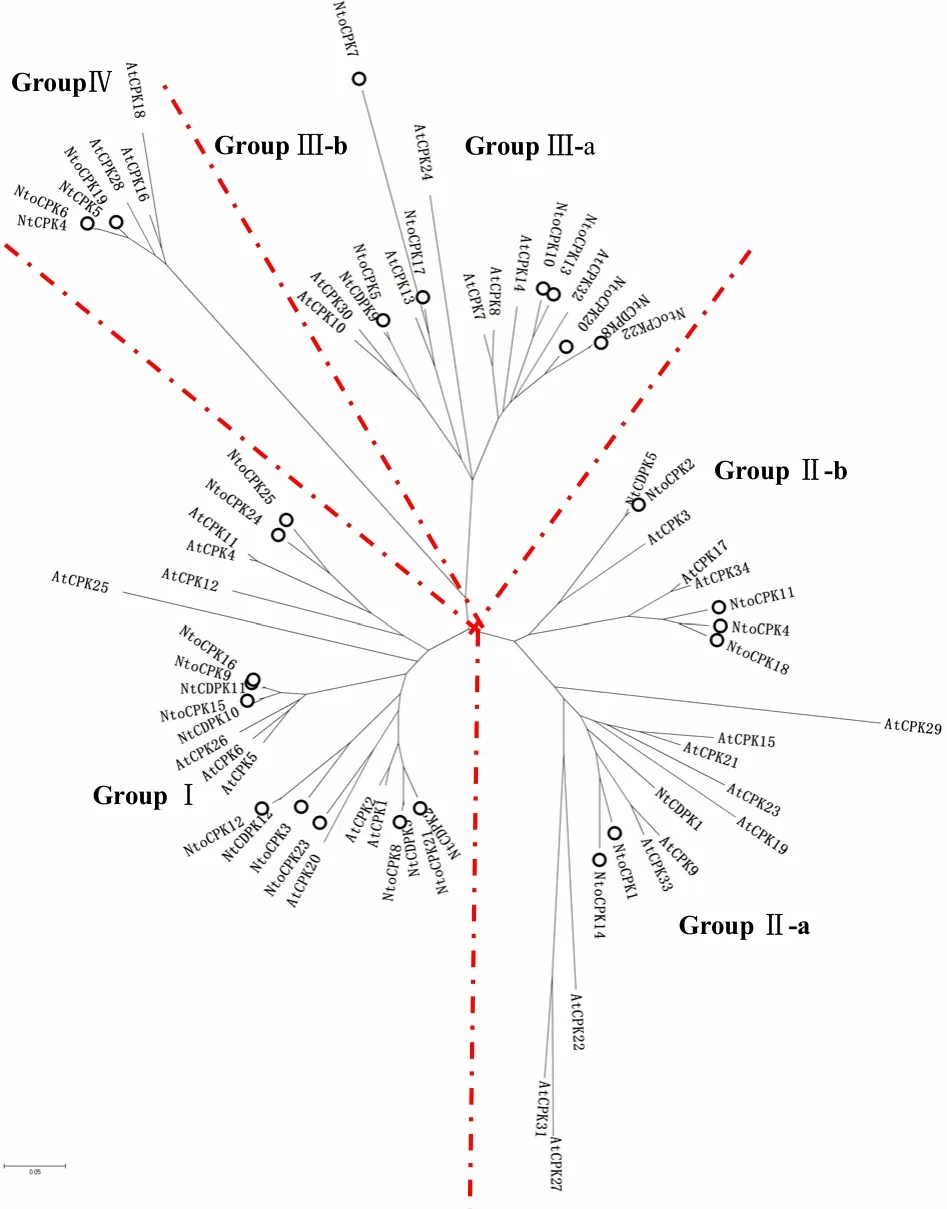
图3 绒毛状烟草、普通烟草和拟南芥CDPK构建的邻接树Fig.3 Neighbor-joining tree of N.tabacum, N.tomentosiformis and Arabidopsis CDPKs
对25个绒毛状烟草、13个普通烟草和34个拟南芥CDPK构建了系统进化树(图3)。可以看出,与拟南芥和普通烟草一样,绒毛状烟草的全部CDPK分布于4个组(亚家族)中,组Ⅱ和Ⅲ又可以进一步分为2个亚组。进化树分析显示,绒毛状烟草CDPK多数位于亚家族Ⅰ(10个)中、Ⅱ(6个)和Ⅲ(7个)中次之,亚家族Ⅳ(2个)中最少。普通烟草是异源四倍体,可能起源于林烟草和绒毛状烟草2个二倍体种[11]。在绒毛状烟草和普通烟草中,2对 CDPK即 NtoCPK1/NtCDPK7和NtoCPK22/NtCDPK8的一致性达到 99.0%以上;8对 CDPK即 NtoCPK2/NtCDPK5、NtoCPK5/NtCDPK9、NtoCPK6/NtCPK4、NtoCPK8/NtCDPK3、NtoCPK9/NtCDPK11、NtoCPK12/NtCDPK12、NtoCPK17/NtCDPK6以及NtoCPK21/NtCDPK2的一致性均达到90%以上。这说明普通烟草的这10个CDPK基因可能与绒毛状烟草对应的10个CDPK基因是直系同源基因,特别是与绒毛状烟草蛋白序列同源性达到 99%以上的2个普通烟草的CDPK基因可能来源于绒毛状烟草。
2.5 主坐标分析
主坐标分析(PCO)可用于多个序列的分类[16]。如果分析的序列很多时,可将主坐标分析与系统进化树相结合,从而更好地推断各亚家族之间的进化关系[17]。由主坐标分析可知,绒毛状烟草、普通烟草和拟南芥的CDPK可分为4类群,与系统发育树的4个亚家族相吻合(图4)。可以看出,亚家族Ⅳ中的NtoCPK6和19位于一个类群,且与其它的绒毛状烟草CDPK距离很远,说明这两个基因的进化速度最快。亚家族Ⅰ和亚家族Ⅱ的距离很近,说明这两个家族的CDPK基因可能来源于共同的祖先。亚家族Ⅲ与其他亚家族的距离都较远,说明其进化速度比亚家族Ⅰ和亚家族Ⅱ快,但比亚家族Ⅳ慢。亚家族Ⅲ中的 CDPK可分为 2个小类群,其中NtoCPK7和AtCDPK24属于同一小类群,与亚家族Ⅲ的其它成员具有一定的距离,表明这2个基因的进化速度与同家族的其它基因相差较大。

图4 普通烟草、绒毛状烟草和拟南芥CDPK基因家族的PCO分析Fig.4 The principal coordinates analysis of N.tabacum,N.tomentosiformis and Arabidopsis proteins
2.6 绒毛状烟草CDPK基因的表达分析

图5 绒毛状烟草CDPK基因家族表达谱Fig.5 Expression patterns of CDPK gene family in N.tomentosiformis
采用RT-PCR分析25个CDPK基因在根、茎、叶和花4个部位(组织)中表达情况。结果表明,25个绒毛状烟草CDPK基因呈现出4种不同的组织特异性表达模式(图5)。第一,在所有4个组织中都有表达且没有明显的差异,属于泛表达基因(NtoCPK2、7、8、9、10、14 和 21)。第二,主要在3个组织中表达,而在其余1个组织中表达量很低或几乎检测不到,其中NtoCPK4、20和24主要在根、茎和叶中表达;NtoCPK5和22主要在根、叶和花中表达;NtoCPK19主要在根、茎和花中表达。第三,主要在2个组织中表达,而在其余2个组织中表达量很低或几乎检测不到,其中NtoCPK17主要在根和茎中表达;NtoCPK6和25主要在根和叶中表达;NtoCPK1主要在茎和花中表达;NtoCPK12、13、15和23主要在叶和花中表达。第四,主要在1个组织中表达,而在其余3个组织中表达量很低或几乎检测不到,NtoCPK3主要在根中表达;NtoCPK16主要在叶中表达;NtoCPK11和18主要在花中表达。CDPK基因的这种不同组织特异性表达模式说明,不同CDPK发挥功能作用的组织是不同的。
3 讨 论
到目前为止,在普通烟草中已报道了 15个CDPK基因,其中13个具有全长序列。由于CDPK是个多基因家族,从目前已知拟南芥 34个、水稻31个、小麦至少26个以及本研究所得25个绒毛状烟草CDPK来看,推测普通烟草中的CDPK至少有25 个以上[1,7,15,18]。
调控区即钙结合区,具有Ca2+结合的EF手性结构。研究表明拟南芥和水稻中均存在少于4个EF手性结构域的 CDPK亚型[1,18-19]。例如,在拟南芥中共有9个CDPK的EF手性结构少于4个,其中AtCPK7、8、10、14、19、23 和 32 具有 3个,AtCPK13和25分别含有2和1个[1];水稻OsCPK5和25含有 3个,而 OsCPK6只有 1个[18]。绒毛状烟草NtoCPK10和24仅有3个。小麦和普通烟草中尚未发现少于4个的亚型。对AtCPK6进行人为突变减少其 EF手性结构,其激酶活性仅为野生型的11.6%~21.4%[20];而水稻中有关于 EF手性结构的突变对其激酶活性无明显影响的报道[21]。因而 EF手性钙结合结构域的突变对激酶活性的影响仍需进一步深入研究。
CDPK的N末端可变区含有亚细胞定位信息,且大部分 CDPK与各种膜系统均有关联[13]。据预测,拟南芥、水稻、小麦中具有N豆蔻酰化基序的CDPK分别有24、15和2个[1,7,18]。16个绒毛状烟草CDPK基因含有该基序,且11含有潜在的跨膜区(表2)。试验表明,AtCPK2的N末端甘氨酸残基能豆蔻酰化,且头 10个氨基酸对于定位到内质网膜上很重要[22]。因此,我们推测绒毛状烟草CDPK与膜系统存在一定的联系。
绒毛状烟草的CDPK基因的GC含量与拟南芥相近,而低于小麦和水稻CDPK基因的GC含量。这可能是因为拟南芥和绒毛状烟草是双子叶植物,而小麦和水稻是单子叶植物。
通过进化树的构建,可用于分析分子之间的起源关系,并预测其功能[23],位于同一亚家族或小分枝上的CDPK可能具有相似的功能。在已克隆的13个普通烟草全长CDPK基因中除NtCDPK1和5外均在绒毛状烟草 CDPK基因中找到了直系同源基因,其中NtCDPK7和8可能来源于绒毛状烟草。直系同源基因可能具有相似的表达特性及功能,例如 NtoCPK2与 NtCDPK5均在不同组织中泛表达[15];NtCDPK12受干旱和高盐胁迫[10],因此可以推测 NtoCPK12也具有类似的胁迫反应。通过计算KA/KS值,NtCDPK5/AtCPK3和NtCDPK6/AtCPK13是2对直系同源基因[15],所以NtoCPK2/AtCPK3与NtoCPK17/AtCPK13也可能是2对直系同源基因。AtCPK3与气孔中 ABA的信号转导有关[24],推测NtoCPK2在绒毛状烟草中也有类似的功能。另外,由图3还可以看出,NtoCPK4/18、NtoCPK10/13、NtoCPK16/23和NtoCPK24/25可能是4对旁系同源基因,每对旁系同源基因在绒毛状烟草中可能具有相似的功能。
植物中CDPK基因的空间表达模式可以分为3类[25]。第1类存在明显的组织特异性,在某一组织中特异表达;第2类在不同的组织中均有表达,但没有明显的差异;第3类在所有的组织中都能检测到,但表达量有着明显的差异,主要在某一组织中表达。通过绒毛状烟草及小麦[7]基因组范围的CDPK基因的空间表达分析可知,还存在第4类空间表达模式,即主要在2个或2个以上组织中表达,而在其他组织中的表达量很低或几乎检测不到。
4 结 论
本研究利用生物信息学方法从绒毛状烟草基因组框架图数据库中共分离得到25个CDPK基因,其氨基酸序列与拟南芥和普通烟草的CDPK基因家族具有很高的同源性。通过系统进化树和主坐标分析可知,这25个CDPK位于4个亚家族。RT-PCR分析表明,绒毛状烟草CDPK基因家族呈现出4种不同的组织特异性表达模式。
[1]Cheng S H, Willmann M R, Chen H C, et al.Calcium signaling through protein kinases.The Arabidopsis calcium-dependent protein kinase gene family[J].Plant Physiol, 2002, 129: 469-485.
[2]Harper J F, Sussman M R, Schaller G E, et al.A calcium-dependent protein kinase with a regulatory domain similar to calmodulin[J].Science, 1991, 252:951-954.
[3]Harmon A C, Gribskov M, Gubrium E, et al.The CDPK superfamily of protein kinases[J].New Phytol, 2001, 151:175-183.
[4]Hrabak E M, Chan C W, Gribskov M, et al.The Arabidopsis CDPK-SnRK superfamily of protein kinases[J].Plant Physiol, 2003, 132: 666-680.
[5]Ito T, Nakata M, Ishida S, et al.The mechanism of substrate recognition of Ca2+-dependent protein kinases[J].Plant Signal Behav, 2011, 6: 924-926.
[6]Klimecka M, Muszynska G.Structure and functions of plant calcium-dependent protein kinases[J].Acta Biochim Pol, 2007, 54: 219-233.
[7]Li A L, Zhu Y F, Tan X M, et al.Evolutionary and functional study of the CDPK gene family in wheat(Triticum aestivum L.) [J].Plant Mol Biol, 2008, 66:429-443.
[8]Zhao R, Sun H L, Mei C, et al.The Arabidopsis Ca2+-dependent protein kinase CPK12 negatively regulates abscisic acid signaling in seed germination and post-germination growth[J].New Phytol, 2011, 192:61-73.
[9]Munemasa S, Hossain M A, Nakamura Y, et al.The Arabidopsis calcium-dependent protein kinase, CPK6,functions as a positive regulator of methyl jasmonate signaling in guard cells[J].Plant Physiol, 2011, 115:553-561.
[10]Chen S, Liu G S, Wang Y Y, et al.Cloning of a calcium-dependent protein kinase gene NtCDPK12, and its induced expression by high-salt and drought in Nicotiana tabacum[J].Agricultural Sciences in China,2011, 10(12): 1851-1860.
[11]Lee K Y, Townsend J, Tepperman J, et al.The molecular basis of sulfonylurea herbicide resistance in tobacco[J].EMBO J, 1988, 7: 1241-1248.
[12]何佳,杨仲南.调控拟南芥雄性不育基因MA的定位及拟南芥 MtN3/saliva基因家族分析[D].上海:上海师范大学,2010.
[13]Li L B, Zhang Y R, Liu K C, et al.Identification and bioinformatics analysis of SnRK2 and CIPK family genes in sorghum[J].Agricultural Sciences in China, 2010, 9(1):19-30.
[14]Lin Y X, Jiang H Y, Chu Z X, et al.Genome-wide identification, classification and analysis of heat shock transcription factor family in maize[J].BMC Genomics,2011, 12: 76.
[15]太帅帅,刘贯山,孙玉合,等.普通烟草CDPK基因家族的克隆及表达分析[J].中国农业科学,2009,42(10):3600-3608.
[16]Charif D, Thioulouse J, Lobry J R, et al.Online synonymous codon usage analyses with the ade4 and seqinR packages[J].Bioinformatics, 2005, 21: 4545-547.
[17]Niranjan Reddy B P, Prasad G B, Raghavendra K.In silico characterization and comparative genomic analysis of the Culex quinquefasciatus glutathione S-transferase (GST)supergene family[J].Parasitol Res, 2011, 109:1165-1177.
[18]Asano T, Tanaka N, Yang G X, et al.Genome-wide identification of the rice calcium-dependent protein kinase and its closely related kinase gene families:comprehensive analysis of the CDPKs gene family in rice[J].Plant Cell Physiol, 2005, 46: 356-366.
[19]陈硕,陈珈.植物中钙依赖蛋白激酶(CDPKs)的结构与功能[J].植物学通报,2001,18(2):143-148.
[20]Hong Y, Takano M, Liu C M, et al.Expression of three members of the calcium-dependent protein kinase gene family in Arabidopsis thaliana[J].Plant Mol Biol, 1996,30: 1259-1275.
[21]Breviario D, Morello L, Giani S.Molecular cloning of two novel rice cDNA sequences encoding putative calcium-dependent protein kinases[J].Plant Mol Biol,1995, 27: 953-967.
[22]Lu S X, Hrabak E M.An Arabidopsis calcium-dependent protein kinase is associated with the endoplasmic reticulum[J].Plant Physiol, 2002, 128: 1008-1021.
[23]陈帅,刘贯山,杨爱国,等.受PVY诱导的烟草NtERD1的基因分离与表达分析[J].中国烟草科学,2010,31(5):62-67.
[24]Mori I C, Murata Y, Yang Y, et al.CDPKs CPK6 and CPK3 function in ABA regulation of guard cell S-type anion- and Ca2+-permeable channels and stomatal closure[J].PLoS Biol, 2006, 4: 1749-1762.
[25]Liu G S, Chen J, Wang X C.VfCPK1, a gene encoding calcium-dependent protein kinase from Vicia faba, is induced by drought and abscisic acid[J].Plant Cell Environ, 2006, 29: 2091-2099.

