甜瓜果肉β-胡萝卜素含量的遗传分析
吕丽华 王怀松 付秋实 朱慧芹 张延国
(中国农业科学院蔬菜花卉研究所,北京 100081)
甜瓜(Cucumis melo L.)营养丰富,红色果肉者富含β-胡萝卜素。β-胡萝卜素在人体内可以转化为VA,它是一种抗氧化剂,具有解毒作用,是维护人体健康不可缺少的营养素,在抗癌、预防心血管疾病、白内障及抗氧化上有显著的功能,进而能够防止老化和衰老引起的多种退化性疾病。β-胡萝卜素的存在令水果和蔬菜拥有了饱满的黄色或橘色。β-胡萝卜素也被用作食物(例如人造奶油)的着色剂。另外,β-胡萝卜素在饲料、化妆品等方面也有重要用途。
β-胡萝卜素含量是影响甜瓜品质的重要因素之一。品质及品质有关的某种成分含量的性状一般为数量性状。植物数量性状受少数主基因或(和)大量微效多基因控制。盖钧镒等(2003)发展的多世代联合的主基因与多基因的数量性状遗传分析方法已在番茄(李纪锁 等,2006)、茄子(庞文龙 等,2008)、普通白菜(韩建明 等,2008)、甘蓝(刘二艳 等,2009)、西葫芦(陈凤真 等,2010;陈凤真,2011)等园艺作物上广泛应用。
本试验以两种果肉颜色差异较大的甜瓜品系200930与200932为亲本杂交,采用六世代联合分析法,研究β-胡萝卜素含量的遗传特点,为提高甜瓜果实品质育种效率和充分利用富含β-胡萝卜素含量种质资源提供理论依据。
1 材料与方法
1.1 材料
试验材料由中国农业科学院蔬菜花卉研究所甜瓜课题组提供。父本200932(P1):厚皮甜瓜,果皮深绿色,细网纹,果皮有沟,抗白粉病,果肉橙红色,β-胡萝卜素含量约为54.96 mg·kg-1;母本200930(P2):厚皮甜瓜,果皮深绿色,细网纹,果皮无沟,易感染白粉病,果肉绿色,β-胡萝卜素含量约为 0.41 mg·kg-1; P1(30 株)、P2(30 株)、F1(50 株)、F2(137 株)、BC1P1(43株)、BC2P2(22株)六个世代于2011年春季种植在本所大棚内。
1.2 方法
1.2.1 β-胡萝卜素含量的测定分析 β-胡萝卜素的提取采用有机溶剂提取法:以1丙酮∶1石油醚为提取液,加入0.1%BHT(2,6-二叔丁基-4-甲基苯酚)防止色素氧化。取5 g果实匀浆置于研钵中加入少许提取液及石英砂,快速研磨后全量转移至抽滤漏斗进行抽滤,收集提取液,重复进行,少量多次抽滤,直至残渣无色。合并提取液,转移至分液漏斗,静置片刻后,收集下层水相于烧杯中,上层有机相直接收集于圆底烧瓶中。用加入0.1% BHT的石油醚为萃取液对收集的下层水相进行萃取,反复多次直至下层水相无色,与有机相合并,用旋转蒸发仪蒸干,最后用5 mL的1丙酮∶1乙腈溶解,经0.45 mm的微孔滤膜过滤后待测。
β-胡萝卜素含量分析采用高效液相色谱法(HPLC)。液相色谱分析条件:超高效液相色谱仪ACQUITY UPLC;分离柱:2.1 mm×100 mm;流动相:1丙酮∶1乙腈;流速:0.25 mL·min-1;紫外检测波长:450 nm;进样量:2 μL。
1.2.2 遗传模型统计分析 试验数据采用盖钧镒等(2003)的植物数量性状主基因 + 多基因混合遗传模型进行多世代遗传联合分析,通过极大似然法和IECM(Iterated Expectation and Conditional Maximization)估计各世代、各成分分布的参数,然后通过AIC(Akaike’s information criterion)值选择供选的相对最佳模型,同时进行一组适合性检验〔包括均匀性检验,Smirnov检验(nW2),Kolmogorov检验(Dn)〕,进而选择最优模型。最优模型采用最小二乘法估计出主基因与多基因效应值、方差及遗传参数。主基因遗传率×100%,多基因遗传率×100%。数据显著性采用DPS V6.55(Duncan法)进行。
2 结果与分析
2.1 P1、P2、F1的β-胡萝卜素含量
经测定,200932(P1)、200930(P2)及其 F1的β-胡萝卜素含量的平均值分别为(54.96 ± 9.04)、(0.41 ± 0.10)、(37.36 ± 8.81) mg·kg-1(FW),差异达到显著水平。其中 F1群体β-胡萝卜素含量的平均值接近高值亲本,即高β-胡萝卜素含量对低β-胡萝卜素含量为部分显性。
2.2 BC1P1、BC2P2、F2群体β-胡萝卜素含量的次数分布
图1为BC1P1世代β-胡萝卜素含量的分离范围:0.08~30.67 mg·kg-1(FW),平均值为 7.21 mg·kg-1(FW)。β-胡萝卜素含量范围在0~1 mg·kg-1(FW)的株系最多。图2为BC2P2世代β-胡萝卜素含量的分离范围:11.18~130.0 mg·kg-1(FW),平均值为63.41 mg·kg-1(FW)。β-胡萝卜素含量范围在30~60 mg·kg-1(FW)的株系最多,含量在0~30 mg·kg-1(FW)及120~150 mg·kg-1(FW)的株系相对较少,整体上BC2P2群体果肉β-胡萝卜素含量较高,超过高值亲本的植株较多。

图1 BC1P1群体果肉β-胡萝卜素含量的分布图

图2 BC2P2群体果肉β-胡萝卜素含量的分布图
图 3为 F2群体β-胡萝卜素含量的分离范围:0.12~92.2 mg·kg-1(FW),平均值为28.66 mg·kg-1(FW)。F2群体 β-胡萝卜素含量在 25~35 mg·kg-1(FW)范围内的株系最多,其次为15~25 mg·kg-1(FW)范围内,F2群体β-胡萝卜素含量偏向高值亲本。
2.3 最优遗传模型的选择及适合性检验
根据联合分析原则,最优遗传模型从AIC值较小的模型中选出。同时有几个模型AIC值较小且差异不大时,通过适合性检验,选择参数达到显著差异数量最少的模型为最优模型。
由表 1各遗传模型的 AIC值可以看出,E-1模型、D-0模型、E-0模型、E-3模型的AIC值较低,对这4个模型进行适合性检验。
由表2可知:E-1模型有12个统计量达到显著差异,D-0模型有13个统计量达到显著差异,E-0模型有13个统计量达到显著差异,E-3模型有20个统计量达到显著差异。所以,E-1模型(两对加性-显性-上位性主基因+加性-显性多基因模型)为最优模型。

图3 F2群体果肉β-胡萝卜素含量的分布图
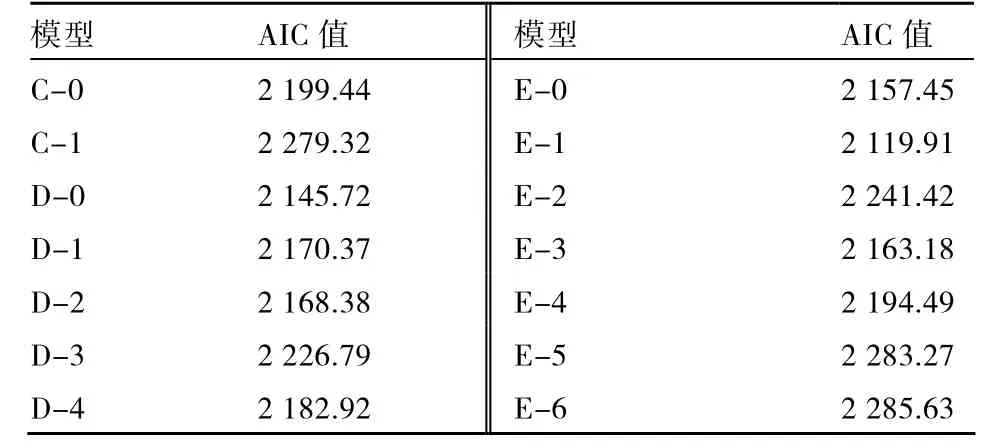
表1 β-胡萝卜素含量各遗传模型的AIC值
2.4 β-胡萝卜素含量的最优遗传模型的参数估计
利用软件分析结果得到β-胡萝卜素含量遗传模型(E-1)的分布参数估计1阶参数,并利用提供的和的公式进一步估计2阶参数。
由表3中的1阶参数可知,两对主基因的加性效应分别为13.37和-4.47,第1对主基因加性效应为正值,第2对主基因加性效应为负值,且|da|>|db|,说明以第1对主基因加性效应为主。第1对主基因的显性度|ha/da|=2.56并且大于1,说明第1对主基因的遗传以显性效应为主,第2对主基因的显性度|hb/db|=0.78小于1,说明第2对主基因的遗传以加性效应为主。此外,两对主基因存在明显的交互作用和上位性效应,加性效应×加性互作(i)值为-22.44,说明两对主基因间的加性互作存在抑制作用。显性×显性互作效应(l)值为-25.76,说明两对主基因间的显性互作存在抑制作用。两对主基因间的加性×显性互作(jab)为-38.00,说明第1对主基因的加性效应抑制了第2对主基因的显性效应;两对主基因的显性×加性互作(jba)为-48.54,说明第 2对主基因的显性效应抑制了第1对主基因的加性效应。多基因显性度|〔h〕/〔d〕|=2.32大于1,说明多基因遗传以显性效应为主。
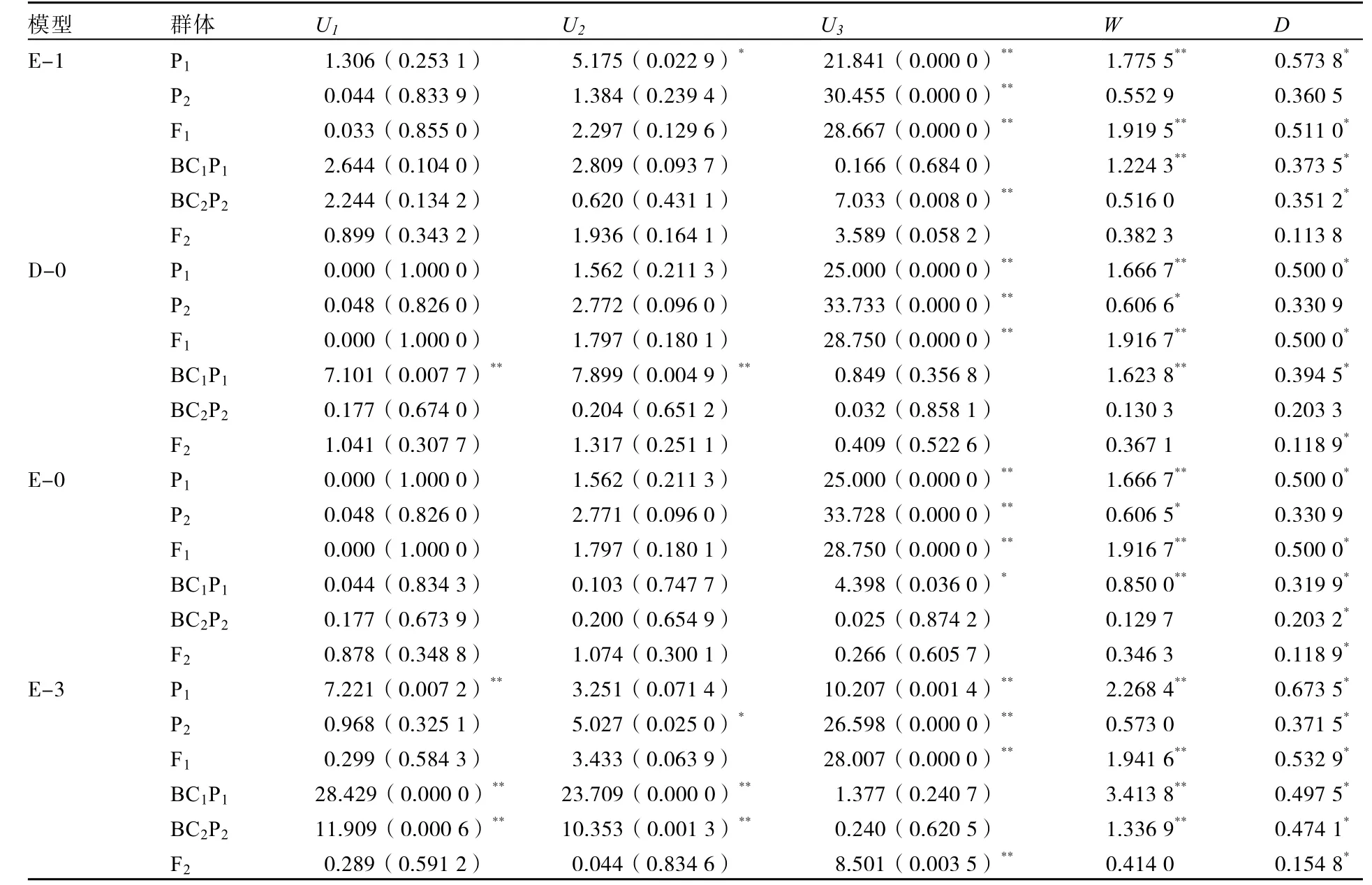
表2 β-胡萝卜素含量遗传模型的适合性检验
综上所述,第1对主基因效应大于第2对主基因,第1对主基因遗传以显性效应为主,第2对主基因遗传以加性效应为主;多基因效应以显性效应为主。由2阶参数可知(表 3),BC1P1、BC2P2、F2群体的主基因遗传率分别为86.80%、59.88%、92.66%,多基因遗传率分别为0、38.60%、5.40%。环境对 3个分离群体的影响分别为 13.20%、1.52%、1.94%,可见环境对 BC1P1群体β-胡萝卜素的含量有一定影响,但对BC2P2、F2群体β-胡萝卜素的含量影响很小。
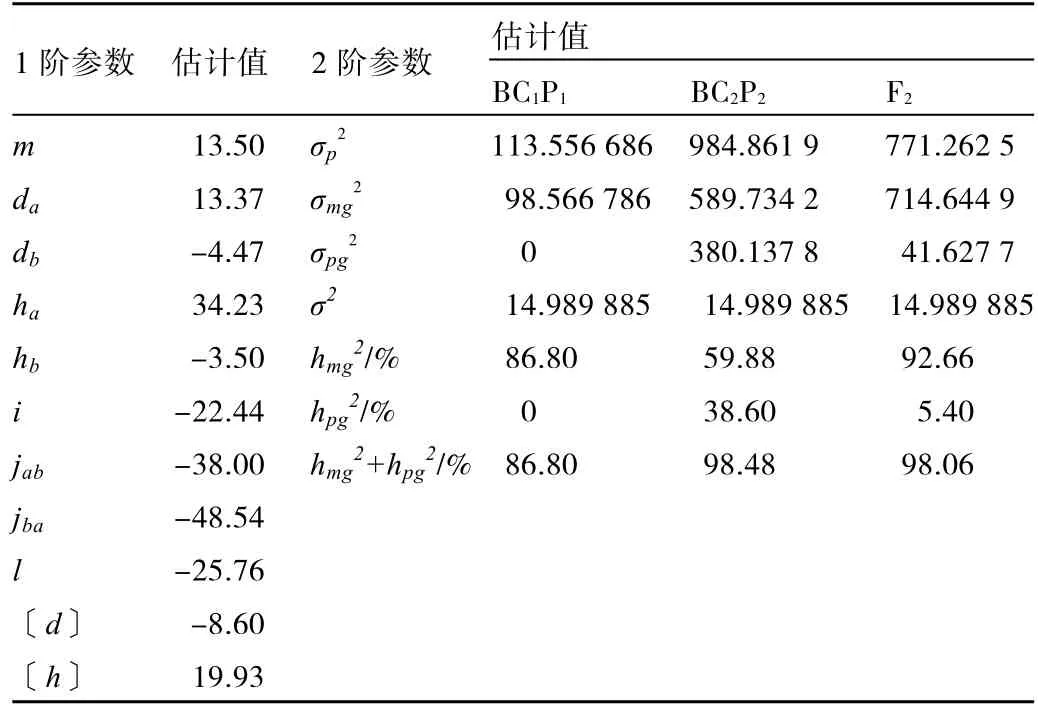
表3 β-胡萝卜素含量遗传参数估计值(E-1模型)
3 结论与讨论
Clayberg(1992)指出中果皮的绿色和白色相对于橘红色为隐性;Monforte等(2004)通过F2群体估计了甜瓜橘红色中果皮颜色的遗传,并且假设了3个位点可能控制甜瓜橘红色的表达;Cuevas等(2008)应用USDA846-1×Top Mark得到的RILs群体将β-胡萝卜素定位在第1、2、4、6条连锁群上;Cuevas等(2009)应用Top Mark(橘红色果肉)×Q 3-2-2(白色果肉)得到的F2-3群体为材料(种植于2006及2007年)将β-胡萝卜素定位在第1、2、4、6、8、9条连锁群上;Harel-beja等(2010)应用RILs群体将β-胡萝卜素含量的QTL定位于第2、6两条染色体上。关于甜瓜β-胡萝卜素含量的遗传报道较少。张红等(2009)利用多世代分析法通过甜瓜酸味突变自交系和黄皮脆杂交组合进行分析,得到果实总糖、葡萄糖、果糖、柠檬酸、糖酸比受两对主基因+多基因混合遗传模型控制;蔗糖、总酸、酸度受一对主基因+多基因混合遗传模型控制。糖含量、酸度和糖酸比性状受主基因的影响较酸含量大,酸含量性状受多基因影响较糖含量、酸度和糖酸比大。主基因+多基因效应决定了糖含量、酸含量和糖酸比性状变异的95.74%~99.45%,还有很小的变异是由环境因素决定的。林碧英等(2007)通过半轮配双列杂交,对甜瓜可溶性固形物含量遗传特性进行研究。但该试验仅从总体上估测了基因综合效应,其性状也只是一个综合性状,未对影响甜瓜品质性状因子的遗传特点进行探讨,对指导甜瓜品质育种有一定局限性。
本试验利用多世代联合分离分析法,应用植物数量性状遗传体系主基因+多基因混合遗传模型分离分析法,将主基因与多基因遗传效应从总表型效应中分离出来,能够更清楚地了解甜瓜果肉β-胡萝卜素含量的遗传模式。结果表明,β-胡萝卜素含量性状属于数量性状,符合“两对加性-显性-上位性主基因+加性-显性多基因(E-1模型)”遗传模型。第1对主基因以显性效应为主,第2对主基因以加性效应为主,并且第1对主基因效应大于第2对主基因效应。多基因以显性效应为主。BC1P1、BC2P2、F2群体的主基因遗传率分别为 86.80%、59.88%、92.66%,多基因遗传率分别为0、38.60%、5.40%。环境对3个群体的影响分别为13.20%、1.52%、1.94%。
此外,本试验还发现控制β-胡萝卜素含量的两对主基因的加性和显性互作效应较大,即存在明显的上位性。F2群体主基因遗传率较高(92.66%),多基因遗传率较低(5.40%),因此,对甜瓜β-胡萝卜素含量的性状改良应在早代进行选择。甜瓜果肉β-胡萝卜素含量遗传偏向父本(父本为高β-胡萝卜素含量)遗传,高β-胡萝卜素含量对低β-胡萝卜素含量为部分显性作用,因此要配制高β-胡萝卜素含量品种,应选择双亲均为高β-胡萝卜素含量或亲本之一为高β-胡萝卜素含量品系。此外,在本试验中BC2P2群体的主基因遗传率明显低于BC1P1、F2群体,而多基因遗传率明显高于两者,这可能与高β-胡萝卜素含量亲本的遗传背景增加,以及高β-胡萝卜素含量基因的部分显性效应有关,在其他作物的相似研究中(李纪锁 等,2006),也出现这种群体间明显的遗传率差异现象。
陈凤真,何启伟.2010.西葫芦株型性状主基因-多基因混合遗传分析.中国蔬菜,(22):34-40.
陈凤真.2011.西葫芦熟性性状主基因—多基因遗传分析.中国蔬菜,(6):42-48.
盖钧镒,章元明,王健康.2003.植物数量性状遗传体系.北京:科学出版社.
韩建明,侯喜林,史公军,陈沁滨.2008.不结球白菜株高性状主基因+多基因遗传分析.南京农业大学学报,31(1):23-26.
李纪锁,沈火林,石正强.2006.鲜食番茄果实中番茄红素含量的主基因-多基因混合遗传分析.遗传,28(4):458-462.
刘二艳,刘玉梅,方智远,杨丽梅,庄木,张扬勇,袁素霞,孙继峰,李占省,孙培田.2009.青花菜花球‘夹叶’性状主基因+多基因遗传分析.园艺学报,36(11):1611-1618.
林碧英,高山,林峰.2007.甜瓜可溶性固形物含量的遗传表现与基因效应分析.中国瓜菜,(1):4-6.
庞文龙,刘富中,陈钰辉,连勇.2008.茄子果色性状的遗传研究.园艺学报,35(7):979-986.
张红,王怀松,贺超兴,张志斌,张显,伊鸿平,吴明珠.2009.甜瓜糖酸性状的遗传研究.园艺学报,36(7):989-996.
Clayberg C D.1992.Interaction and linkage test of flesh color genes in Cucumis melo L.Cucurbit Genet Coop Rep,15:53.
Cuevas H E,Staub J E,Simon P W,Zalapa J E,McCreight J D.2008.Mapping of genetic loci that regulate quantity of beta-carotene in fruit of US Western Shipping melon(Cucumis melo L.).Theor Appl Genet,117:1345-1359.
Cuevas H E,Staub J E,Simon P W,Zalapa J E.2009.A consensus linkage map identifies genomic regions controlling fruit maturity and beta-carotene-associated flesh color in melon(Cucumis melo L.).Theor Appl Genet,119:741-756.
Monforte A J,Oliver M,Gonzalo M J,Alvarez J M,Dolcet-Sanjuan R,Arus P.2004.Identification of quantitative trait loci involved in fruit quality traits in melon(Cucumis melo L.).Theor Appl Genet,108:750-758.
Harel-Beja R,Tzuri G,Portnoy V,Lotan-Pompan M,Lev S,Cohen S,Dai N,Yeselson L,Meir A,Libhaber S E,Avisar E,Melame T,van Koert P,Verbakel H,Hofstede R,Volpin H,Oliver M,Fougedoire A,Stalh C,Fauve J,Copes B,Fei Z,Giovannoni J,Ori N,Lewinsohn E,Sherman A,Burger J,Tadmor Y,SchaVer A A,Katzir N.2010.A genetic map of melon highly enriched with fruit quality QTLs and EST markers,including sugar and carotenoid metabolism genes.Theor Appl Genet,121:511-533.

