大白菜根肿病抗性基因的标记和定位
王彤彤 张淑江 章时蕃 李 菲 张 慧 孙日飞
(中国农业科学院蔬菜花卉研究所,北京 100081)
大白菜根肿病是由芸薹根肿菌(Plasmodiophora brassicae Woron.)侵染引起的世界性土传病害,目前在很多国家都发生已久且普遍严重(杨永林,1990)。病原菌专性寄生于芸薹属等十字花科作物的根部,其休眠孢子可在土壤中存活长达8 a甚至以上(Wallenhammar,1996),主要为害根部,侵染后导致根部细胞异常分裂和膨大,形成肿瘤,造成根的正常生理机能受阻,植株缺乏养分而生长迟缓,枯萎落叶直至死亡。苗期和成株期均可以被感染,田间土壤一旦受到根肿病菌污染,将长期带菌,从而不再适合种植十字花科作物(孙保亚 等,2005)。近年来我国大白菜根肿病发病面积急剧增加,造成严重危害。培育抗根肿病品种是保证大白菜正常生产的重要措施,而利用分子标记辅助选择育种是经济有效的途径之一。
InDel(Insertion-deletion Length Polymorphism)标记是在等位基因位点上一定数量的核苷酸插入或缺失一段相对短的核苷酸序列而产生的长度多态性变异(Jander et al.,2002),是基于全基因组测序的第三代分子标记,具有标记特异性高、稳定性好、检测方法简单、经济等优点。这种新型标记的使用可大大增加白菜类作物中基于基因组序列的特异性分子标记数量。本试验在实验室已有的大量InDel标记的基础上,构建F2分离群体,利用分离群体分组分析法(Bulked Segregant Analysis,BSA)筛选与抗根肿病基因紧密连锁的InDel标记,从而为分子标记辅助选择育种奠定基础。
1 材料与方法
1.1 材料
供试大白菜材料由中国农业科学院蔬菜花卉研究所白菜课题组提供。利用高抗根肿病的材料F1金锦2号(编号A00645)和奈斯高(编号A00647)自交,分别构建包含197个和207个单株的F2群体,通过根肿菌接种鉴定进行抗性遗传分析,以大白菜品种黄美春作为感病对照。接种所用根肿病菌由本所菜病综防课题组提供。
1.2 方法
1.2.1 根肿菌接种方法 人工接种采用普通菌土法(李妍 等,2011),接种量为 1 g灭菌土含0.05 g肿根,取适量带有根肿菌的病根用组织打碎机打成匀浆,过滤,静置2 h,使游动孢子从孢子囊中充分释放。而后按照一定比例加水和灭菌土充分混合,制成孢子含量为8×106个·g-1(干土)的菌土,播种土全部为菌土。
1.2.2 根肿病抗性鉴定 2010年12月12日,将A00645、A00647和感病对照黄美春各15粒种子,两个F2群体各选197粒和207粒种子,经催芽后播种于装有菌土的苗钵中。土壤保持湿润,温度不低于 17 ℃。于 2011年 3月 10日洗净根部泥土,按 0~7级标准调查单株发病情况,0级:根系正常,无病害;1级:主根未发生病害,须根、侧根有个别细小根瘤;3级:主根出现病害症状但肿大不明显,须根、侧根较多根瘤或根瘤直径或长度超过0.5 cm;5级:主根肿大明显,肿大部分直径为茎基的2~3倍,大部分须根、侧根有肿瘤;7级:主根肿大明显,肿大部分直径为茎基的3倍以上。0、1级为抗病,3、5、7级为感病。接种鉴定试验在本所菜病综防课题组温室进行。病情指数(DI)计算方法为:
病情指数=〔Σ(各级病株数×相应级别值)/(调查总株数×发病最高级别代表值)〕×100
其中病情指数<10为抗病,病情指数≥10为感病。
1.2.3 基因组DNA提取及建池 采集大白菜单株叶片,冻干磨成粉末。采用改良CTAB法对冻干样品提取基因组DNA(Wang et al.,2005),用1.0%琼脂糖凝胶电泳检测DNA,并用Nanodrop ND1000(Gene Company Limited,China)检测DNA浓度及纯度。根据所测浓度,将单株 DNA浓度稀释至50 ng·μL-1。利用BSA法(Michelmore et al., 1991),根据F2群体接种鉴定结果选取10株高抗单株构建抗病池,10株高感单株构建感病池。
1.2.4 InDel反应体系建立和引物筛选 本试验中InDel标记反应体系的建立,主要对PCR反应体系中几个核心影响因素进行优化组合,从而确定出最佳的PCR反应体系。均采用20 μL标准反应体系:50 ng·μL-1基因组 DNA 5 μL,10×PCR buffer(含 Mg2+)2 μL,10 mmol·L-1dNTPs 1.6 μL,2.5 U·μL-1Taq DNA 聚合酶 0.2 μL,5 μmol·L-1正、反向引物各 0.4 μL,用 ddH2O调整体系终体积为20 μL。PCR扩增程序为94 ℃预变性5 min;94 ℃变性40 s,57 ℃退火40 s,72 ℃延伸40 s,35个循环;最后72 ℃延伸5 min,16 ℃保存。PCR产物加入5 μL非变性双色缓冲液,利用8%非变性聚丙烯酰胺凝胶电泳检测,电泳恒压120 V,0.5×TBE为缓冲液。利用快速银染法染色(Sanguinetti et al.,1994),照相保存。统计多态性条带,并把存在多态性条带的引物再次在抗性池中扩增,验证多态性。
1.2.5 多态性标记在群体中的验证及绘制遗传连锁图谱 将在抗感病池中表现多态的标记在 F2分离群体中进行验证,检测标记在群体中的多态性。统计带型,利用JoinMap4.0软件分析目的基因和分子标记位点的连锁关系,选择最小LOD阈值2.0构建连锁图。
2 结果与分析
2.1 大白菜根肿病抗性遗传分析
F1(A00645)为高抗,自交后代 F2群体(A00645-4)197个单株经过根肿菌接种鉴定,得到156个抗病单株和41个感病单株。经卡方检测,符合3∶1的孟德尔遗传分离比例(χ2=1.63<=3.84),说明该材料中根肿病抗性为单基因显性遗传,该性状可以按照质量性状进行分析;F1A00647表现高抗,自交后代 F2群体(A00647-3)207个单株经根肿菌接种鉴定,得到165个抗病单株和42个感病单株。经卡方检测,也符合3∶1的分离比(χ2=2.20<=3.84),说明该材料中根肿病抗性也是由显性单基因控制。
2.2 InDel标记筛选
利用A00645-4群体构建抗感病池,筛选了720对InDel引物,其中12对引物扩增出了多态性片段。进一步将这12对引物进行F2群体单株验证,结果得到9个与抗根肿病基因连锁的InDel标记,分别为 BrID10867,BrID11233,BrID11509,BrID11507,BrID10781,BrID11683,BrID90269,BrID11689,BrID10353(表 1)。
2.3 遗传连锁分析
在 197个单株的 F2群体 A00645-4中验证 9个标记的多态性(图 1)。统计数据后,利用JoinMap 4.0软件,LOD阈值5.0,分析数据并绘制遗传连锁图。其中,BrID90269和BrID11683距离抗根肿病基因最近,分别为2.0 cM和2.5 cM,BrID10353距离抗病基因最远,为16.2 cM(图 2)。
2.4 大白菜抗根肿病基因的定位
9个InDel连锁标记均位于大白菜连锁群A8上。其中BrID90269、BrID 11683和 BrID11689均位于 A8连锁群的Scaffold 10上,因此确定该根肿病抗性基因CR位于Scaffold10上(图2)。根据大白菜基因组测序结果以及抗病基因保守结构域在白菜基因组上的基因注释,标记BrID90269和BrID11683之间的区域内预测有6个抗病基因,并且这些抗病基因成簇分布。
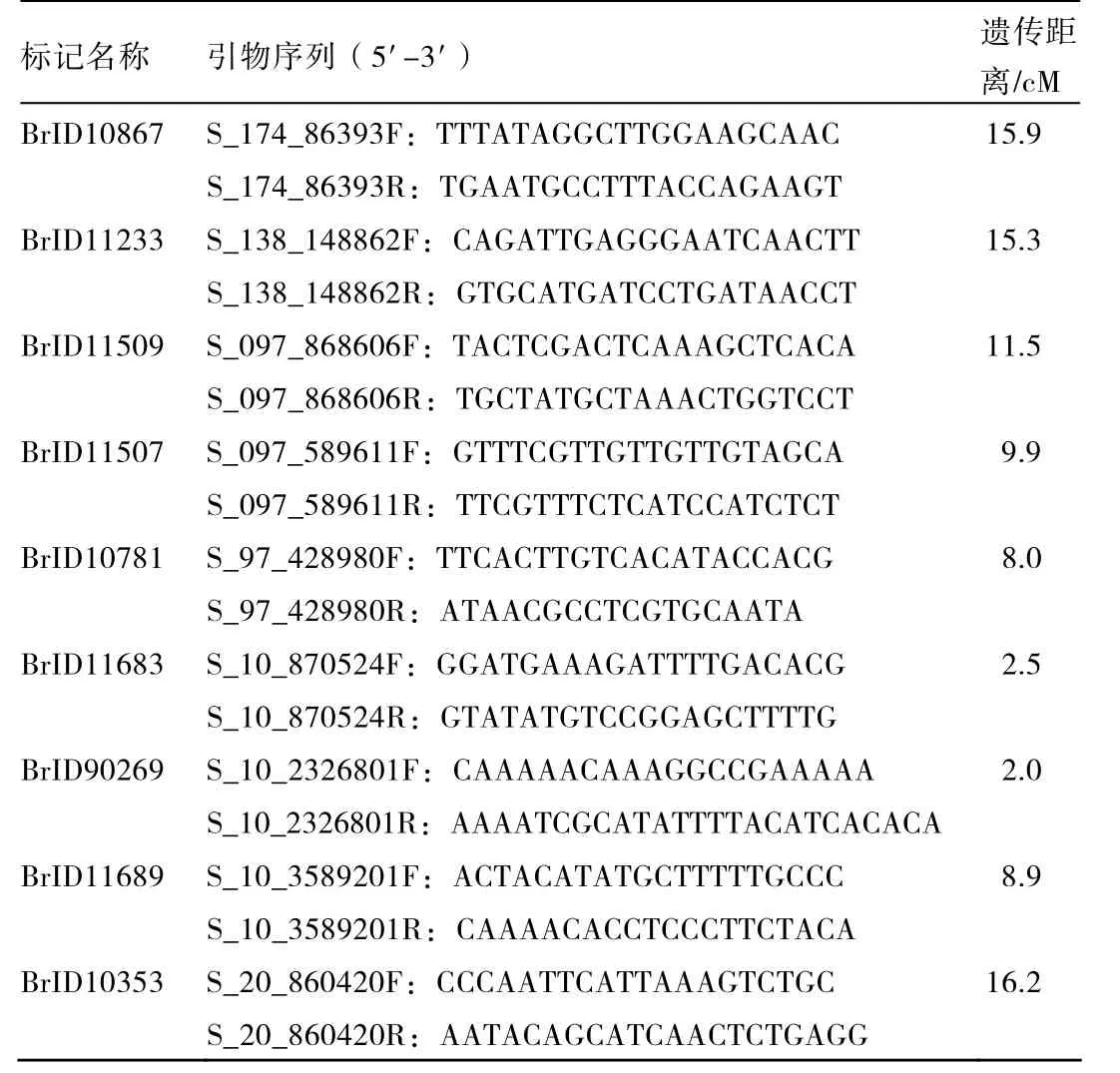
表1 与抗根肿病基因连锁的InDel标记信息
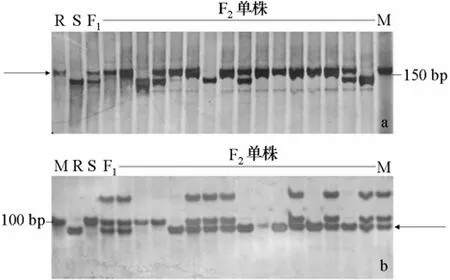
图1 InDel标记在抗感病池和单株中的扩增图谱

图2 遗传连锁图
3 讨论
本试验通过 InDel标记 BrID90269和BrID11683将抗根肿病基因 CR定位在大白菜连锁群A8上,具体是在Scaffold10上一个大于1450 kb的区间内。目前报道的抗根肿病基因中,CRa(Matsumoto et al.,1998;Hayashida et al.,2008),CRb(Piao et al.,2004),Crr3(Hirai et al.,2004),CRk(Sakanoto et al.,2008)皆位于A3上,Crr2和Crr4(Suwabe et al.,2006)分别位于A1和A6上,CRc(Sakanoto et al.,2008)位于 A2 上,只有 Crr1(Suwabe et al.,2003)位于A8上。但是与Crr1紧密连锁的SSR标记BRMS-088在本试验所用材料扩增后没有多态性。将BRMS-088标记引物序列与白菜基因组比对后发现,该标记位于 A8的Scaffold 97上,两个基因不在染色体的同一区域,因此初步认为本试验定位的抗病基因 CR和Crr1可能不是同一位点。根据大白菜测序结果以及抗病基因保守结构域在白菜基因组上的基因注释,在所定位的Scaffold10的区间内预测有6个抗病基因,且成簇分布。本试验结果有助于抗根肿病基因的精细定位以及进一步的克隆,并且所得到的紧密连锁InDel标记可用于分子标记辅助选择育种,加速培育大白菜抗根肿病优良品种。
李妍,谢学文,向文胜,石延霞,李宝聚,王平.2011.白菜根肿病的接种方法.植物保护学报,38(1):95-96.
孙保亚,沈向群,郭海风,周永红,卢维丰.2005.大白菜抗根肿病遗传规律初探.中国蔬菜,(6):15-17.
杨永林.1990.十字花科蔬菜根肿病抑菌型土壤初探.植物保护学报,17(2):127-131.
Hayashida N,Takabatake Y,Nakazawa N,Aruga D,Nakanishi H,Taguchi G,Sakamoto K,Matsumoto E.2008.Construction of a practical SCAR marker linked to clubroot resistance in Chinese cabbage,with intensive analysis of HC352b genes.J Japan Soc Hort Sci,77(2):150-154.
Hirai M,Harada T,Kubo N,Tsukada M,Suwabe K,Matsumoto S.2004.A novel locus for clubroot resistance in Brassica rapa and its linkage markers.Theor Appl Genet,108:639-643.
Jander G,Norris S R,Rounsley S D,Bush D F,Levin I M,Last R L.2002.Arabidopsis map-based cloning in the post-genome era.Plant Physiology,129:440-450.
Matsumoto E,Yasui C,Ohi M,Tsukada M.1998.Linkage analysis of RFLP markers for clubroot resistance and pigmentation in Chinese cabbage(Brassica rapa ssp.pekinensis).Euphytica,104:79-86.
Michelmore R W,Paran I,Kesseli R.1991.Identification of markers linked to disease-resistance genes by bulked segregant analysis:a rapidmethod to detect markers in specific genomic regions by using segregating populations.Proceedings of the National Academy of Sciences,88:9828.
Piao Z Y,Deng Y Q,Choi S R,Park Y J,Lim Y P.2004.SCAR and CAPS mapping of CRb,a gene conferring resistance to Plasmodiophora brassicae in Chinese cabbage(Brassica rapa ssp.pekinensis).Theor Appl Genet,108:1458-1465.
Sakamoto K,Saito A,Hayashida N,Taguchi G,Matsumoto E.2008.Mapping of isolate-specific QTLs for clubroot resistance in Chinese cabbage(Brassica rapa L.ssp.pekinensis).Theor Appl Genet,117:759-767.
Sanguinetti C J,Dias I,Neto E,Simpsor A J G.1994.Rapid silver staining and recovery of PCR products separated on polyacrylamide gels-polymerase chain reaction produel recovery.Biotechniques,17(5):914-921.
Suwabe K,Tsukazaki H,Iketani H,Hatakeyama K,Fujimura M,Nunome T,Fukuoka H,Matsumoto S,Hirai M.2003.Identification of two loci for resistance to clubroot(Plasmodiophora brassicae Woronin)in Brassica rapa L.Theor Appl Genet,107:997-1002.
Suwabe K,Tsukazaki H,Iketani H,Hatakeyama K,Kondo M,Fujimura M,Nunome T,Fukuoka H,Hirai M,Matsumoto S.2006.Simple sequence repeat-based comparative genomics between Brassica rapa and Arabidopsis thaliana:the genetic origin of clubroot resistance.Genetics,173:309-319.
Wallenhammar A C.1996.Prevalence of Plasmodiophora brassicae in a spring oilseed rape growing area in central Sweden and factors influencing soil infestation levels.Plant Pathology,45:710-719.
Wang X W,Lou P,Bonnema G,Yang B J,He H J,Zhang Y G,Fang Z Y.2005.Linkage mapping of a dominant male sterility gene Ms-cd1 in Brassica oleracea.Genome,48:848-854.

