Asia I型口蹄疫疫苗效力检验替代方法的初步研究
张怀宇,高桂云,张 梅,邹兴启,赵 耘,赵启祖
(1.二连浩特出入境检验检疫局,内蒙古 二连浩特 011100;2.内蒙古机电职业技术学院,内蒙古 呼和浩特 010070;3.中国兽医药品监察所,北京 100081)
抗原含量是决定口蹄疫疫苗质量和免疫效力的关键之一。口蹄疫疫苗生产按照GMP要求对每一步实行全程监控,包括病毒收获液、过滤、灭活和浓缩之后活病毒数量或病毒抗原量的监测,目前主要由生产厂家采用细胞培养、乳鼠接种法测定病毒毒价,或采用蔗糖密度梯度离心法测定146S抗原含量进行抗原含量的控制[1],而且这些方法都不适宜于成品疫苗中抗原量的监督控制。疫苗的质量检验特别是效力检验,主要依靠本动物(猪或牛)检验或正在研究的实验动物替代检验[2],需要使用活病毒,而活病毒只能在国家规定的生物安全实验室进行,这种方法无论从经济、人力和时间方面(例如需要购买大量的抗体阴性本动物,并且检测一次所需时间较长)还是散毒的危险性方面(由于使用活病毒,整个检测过程必须在P3实验室内进行,人员出入消毒不彻底都有可能导致散毒)都是不理想的。鉴于我国目前的特殊情况,急需建立一个检测成品口蹄疫疫苗抗原的方法,在监管机构不动用活病毒的前提下,对成品疫苗实施一定程度的检测管理,确保市售疫苗质量,提高动物防疫效果。
本研究将针对Asia I型口蹄疫病毒不同抗原表位的三株单抗按一定比例混合后,组建间接夹心ELISA方法,来对Asia I型口蹄疫疫苗中的抗原含量进行实验室测定,并结合疫苗半数保护剂量(PD50值),探索口蹄疫疫苗效力检验实验室替代方法。
1 材料和方法
1.1 抗原与血清
Asia I型口蹄疫抗体检测液相阻断ELISA试剂盒(内有Asia I型口蹄疫浓缩灭活抗原和Asia I型兔抗口蹄疫高免血清),兰州兽医研究所提供;Asia I型口蹄疫腹水单克隆抗体,本实验室制备;Asia I型口蹄疫病毒(LC株),中牧兰州生物制品厂提供;Asia I型口蹄疫灭活阻断样,金宇集团内蒙古生物制品厂提供;Asia I型、O型口蹄疫单价及双价灭活疫苗,分别来自A厂、B厂、C厂、D厂、E厂、F厂;部分疫苗样为双盲测试样,由本所病毒制品检测室提供;正常细胞培养物,中牧兰州生物制品厂提供。
1.2 实验动物和试剂
Balb/C经产母鼠(SPF级),购自北京维通利华实验动物技术有限公司;脱脂奶粉,DIFCO公司产品;OPD,华美生物工程公司产品;硫酸铵,北京化学试剂公司产品;葡聚糖凝胶G-50中,Pharmacia公司产品;三氯乙烯,购自苏州正兴化工研究所;肉豆蔻酸异丙酯(含90%以上GC),购自Sigma公司。
1.3 Asia I型口蹄疫腹水单克隆抗体的扩大生产和纯化
采用小鼠腹腔诱生腹水法对三株杂交瘤细胞株(1#G3C2、2#G6B9、10#C2G1)进行扩大生产,并用硫酸铵盐析法进行粗提纯化[3-8],SDS-PAGE电泳法检测纯化效果[9]。
1.4 三株单克隆抗体混合腹水效价的测定
将获得的三株单克隆抗体所有腹水纯化物分别混匀后,用间接夹心ELISA法测定效价,依据所测定的三株单克隆抗体腹水的效价值,按等效价原则使用pH 7.80.02mol/L的Tris-HCl缓冲液将三株腹水单克隆抗体稀释到相同的效价,各取1 mL混合均匀,加入万分之一柳硫汞,再加入等体积的50%无菌甘油,分装后,-20℃冰箱保存备用,即为制好的混合单克隆抗体。使用间接夹心ELISA法对混合单克隆抗体进行效价的测定。
1.5 混合腹水单克隆抗体最佳反应浓度测定
使用间接夹心ELISA法,包被抗体和反应抗原的使用参照兰州兽医研究所Asia I型口蹄疫抗体检测液相阻断ELISA试剂盒中规定的反应条件。使用Asia I型兔抗口蹄疫高免血清稀释包板,加入1:5稀释的Asia I型口蹄疫浓缩灭活抗原,将混合腹水单克隆抗体作1/160至1/160×217稀释,混合腹水单克隆抗体设两组重复,同时设两组重复正常小鼠血清做阴性对照,初步测定混合腹水单克隆抗体的反应浓度。 再将Asia I型口蹄疫浓缩灭活抗原作1:2、1:4、1:8和1:16稀释;对应每个抗原稀释度,混合腹水单克隆抗体设两组重复,同时设两组重复正常小鼠血清做阴性对照,混合腹水单克隆抗体作1/160×26至1/160×217稀释,测定反应浓度。将上述两个试验数据结合混合腹水单克隆抗体的效价,最终确定了混合腹水单抗和抗原的最佳反应浓度。
1.6 疫苗破乳方法的确定
对几批不同厂家所生产的Asia I型口蹄疫灭活疫苗及Asia I型和O型双价口蹄疫灭活疫苗,采用三氯乙烯破乳法、反复冻融破乳法、高速离心破乳法、肉豆蔻酸异丙酯破乳法比较破乳效果,从中选出最佳的破乳方法。
1.7 混合腹水单克隆抗体介导间接夹心ELISA方法的初步建立
用pH 9.6碳酸盐包被缓冲液将Asia I型兔抗口蹄疫高免血清作1:800稀释,包被反应板,以5%的脱脂奶作为封闭液,加入2倍梯度稀释的口蹄疫乳化前灭活抗原,再加入1/160×23稀释的混合腹水单克隆抗体进行反应,加入1:4000稀释的兔抗鼠酶结合物反应,使用OPD显色系统,显色时间为13~15 min,在酶标读数仪上,492 nm波长,测定OD值,以正常细胞培养物为阴性对照,以2倍P/N值为判定标准。同时,按同样的操作对Asia I型口蹄疫浓缩灭活抗原(兰州兽医研究所)、Asia I型口蹄疫病毒(LC株)的正常量培养病毒液(每转瓶接种3000 mL)进行间接夹心ELISA反应,并记录试验结果。
1.8 口蹄疫成品疫苗总抗原含量测定方法初探
共计对11个批次的Asia I型单价口蹄疫灭活疫苗、O型-Asia I型双价口蹄疫灭活疫苗及O型口蹄疫灭活疫苗,均采用三氯乙烯破乳法对各个厂家的疫苗进行完全破乳,再使用建立的单克隆抗体介导间接夹心ELISA法对其进行抗原含量测定,并记录测定结果。
2 结果与分析
2.1 腹水单克隆抗体的生产与纯化
三株杂交瘤细胞(1#G3C2、2#G6B9、10#C2G1)均生产了大量腹水单克隆抗体且粗提纯化效果较好。1#G3C2的粗提纯化SDS-PAGE电泳结果如图1所示,两箭头所指为抗体重链和轻链的蛋白分子量及其在SDS-PAGE电泳图中的位置,表明单克隆抗体的粗提纯化效果很好。

2.2 三株单克隆抗体混合腹水效价的测定结果
如图2所示,经测定混合腹水单抗的效价为1/160×27,即1:20480(此时OD值≥1)。

2.3 混合腹水单克隆抗体最佳反应浓度的测定结果
根据间接夹心ELISA测定的反应OD值,结合混合腹水单克隆抗体的测定效价OD值,最终以OD值2.0为临界点,确定了混合腹水单克隆抗体的工作浓度为1/160×23,即1:1280稀释。
如图3所示为使用不同稀释度的浓缩灭活抗原与倍比稀释的混合腹水单克隆抗体反应,总体上都有着良好的线性关系,并且同一稀释度混合腹水单克隆抗体所对应的不同稀释比的浓缩灭活抗原的OD值呈规律变化,即抗原稀释度越大,对应OD值越低,但考虑到抗原稀释度太低其非特异性反应影响较大,而抗原稀释度太高则OD值相对较低,不利于结果判定。因而从侧面也说明了使用1:5稀释的Asia I型口蹄疫浓缩灭活抗原所测定的混合腹水单克隆抗体反应浓度是最佳浓度。

2.4 疫苗破乳方法的确定
通过比对各种方法的破乳充分程度、抗原的性状,抗原吸取的难易程度等因素综合考虑,确定三氯乙烯破乳法为疫苗的破乳方法。
2.5 混合腹水单克隆抗体介导的间接夹心ELISA方法的初步建立
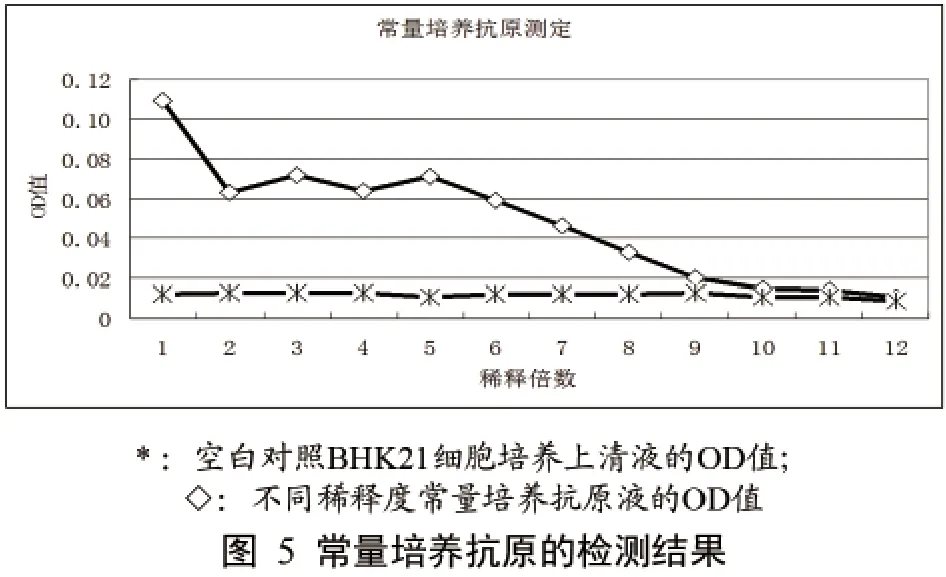
通过试验,初步确定我们建立的ELISA方法具有很好的线性关系。如图4所示两单位生产的浓缩培养灭活抗原效价大于1:2048,即11 log2。图5显示对于正常量培养病毒液(每转瓶接种3000 mL)抗原效价为1:128,即7 log2。

2.6 口蹄疫成品疫苗中总抗原含量测定方法初探
结果如表1所示:其中6批牛PD50测定合格的疫苗破乳抗原的效价分布在1:32到1:1024之间,C厂双价苗(1:32),D厂牛双价苗(1:64),B厂双价苗(1:128),E厂Asia I型单价苗(1:128),A厂双价苗(1:1024)说明不同厂家生产的疫苗中抗原含量是有差异的,间接反映各厂家疫苗质量不一致。两个厂家的O型疫苗根据判定标准均为阴性,该方法仅检测Asia I型并不与O型发生反应,说明方法特异性强。对5个厂家2006年汇检双价疫苗进行ELISA测定发现,效价总体比较低,与汇检结果一致,ELISA测定效价与牛PD50测定结果符合率较差,需要有大量的实验数据的积累,才能够通过统计学方法确定疫苗的牛PD50值与ELISA效价的相关性。
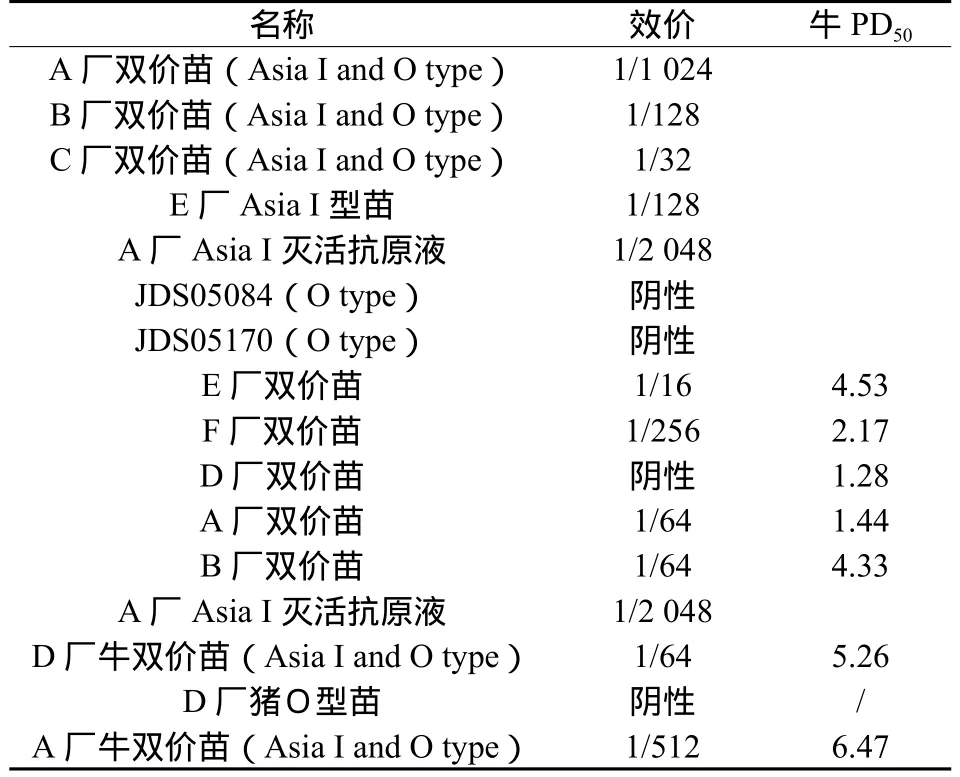
表1 11个批次疫苗的ELISA效价与PD50值
3 讨论
我们初步建立的这种实验室替代方法其基本原理是采用间接夹心ELISA测定破乳成品疫苗中的抗原含量,使用Asia I型兔抗口蹄疫高免血清包埋反应板,与破乳后疫苗水相抗原反应,再同确定的抗Asia I型口蹄疫146S抗原病毒中和性混合腹水单克隆抗体反应,经酶底物显色,测定OD值,达到监测成品疫苗中抗原含量的目的。并通过大量的实验数据的积累,研究它们与PD50、免疫动物血清抗体水平以及疫苗效力的关系,确定判定标准,从而最终建立起口蹄疫疫苗效力检验实验室替代方法。
使用单克隆抗体可确保实验方法的可操作性、重复性和稳定性,有利于方法的标准化。前期共获得四株单克隆抗体,对其进行各种生物学特性鉴定后,选出其中的三株(1#G3C2、2#G6B9、10#C2G1)进行腹水纯化处理,并按一定的方法混合,用来建立混合腹水单克隆抗体介导的间接夹心ELISA方法。包被抗体,即Asia I型兔抗口蹄疫高免血清,是兰州兽医研究所的Asia I型口蹄疫抗体检测液相阻断ELISA试剂盒试剂,其包被浓度和包被液都是经过测定的最佳结合浓度。使用5%的脱脂奶作为封闭液,不但可以取得很好的封闭效果,同时价格也很低廉。
试验数据表明疫苗中抗原含量与我们使用混合腹水单克隆抗体建立起来的方法所测定的血清学滴度间有着很好的线性关系,测定O型FMD疫苗的结果均为阴性,说明了方法是特异的,这为下一步研究疫苗中的抗原含量与免疫后动物所获得的保护力之间的关系提供了保证 ,同时也为最终成品口蹄疫疫苗抗原含量体外检测方法的建立奠定了基础。
目前,我国的疫苗生产厂家主要生产Asia I型、O型和A型口蹄疫灭活疫苗,为了对其进行质量监测,这就要求我们还应继续加大单克隆抗体的制备力度,不仅要尽可能多的获得抗Asia I型口蹄疫病毒不同抗原表位的单克隆抗体,进一步完善初步建立的测定疫苗中抗原含量的间接夹心ELISA方法,还要进行O型和A型口蹄疫病毒单克隆抗体的制备及间接夹心ELISA方法的建立。
[1]王明俊.兽医生物制品学[M].北京:中国农业出版社,1996.
[2]谢庆阁.口蹄疫[M].北京:中国农业出版社,2004.
[3]陈伯权,吴美芙,叶群瑞.几种部分纯化单克隆抗体方法的比较[J].病毒学报,1990,6(2):122-126.
[4]牛占坡,来锦明,罗学娅,等.腹水中单克隆抗体的简单快速纯化法[J].中国医学科学院学报,1987,9(3):212-216.
[5]Jiskoot W,Van Hertrooij J J,Klein Gebbinck J W,et al,Two-step purif i cation of a murine monoclonal antibody intended for therapeutic application in man.Optimisation of purification condition and scaling up[J]. J Immunol Meth,1989,124(1):143-156.
[6]Phillips AP,Martin K L,Horton W H,et al,The choice of method for immunoglobulin G purification:yield and purity of antibody activity[J]. J Immunol Meth,1984,74(2):385-393.
[7]Reading C L. Theory and methods for immunization in culture and monoclonal antibody production [J].J Immunol Meth,1982,53(3):261-291.
[8]Hurrel J G R. Monoclonal hybridomas antibodies:Techniques and applications[M].Boca Raton,Flordia:CRC Press Inc.1982:36-37.
[9]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,1999.

