兔股骨头坏死模型的血管内皮生长因子和Bcl-2的表达
田力,梁晓鹏,田晓晔,于鑫琛,田晶
(1.沈阳医学院临床教研室,辽宁 沈阳 110034;2.眼视光学院;3.铁岭经济开发区靖康康复养老中心;4.沈阳靖康医疗集团)
建立理想的股骨头缺血坏死动物模型,是研究股骨头缺血坏死病因及发病机制十分重要的手段,也是进行股骨头缺血坏死治疗研究的基础[1]。股骨头缺血坏死动物模型的造模方法文献已经有很多报道,目前兔股骨头坏死模型的激素诱导制作方法主要包括连续两次注射脂多糖(100 μg/kg)[2],单剂量静脉注射脂多糖(10 μg/kg)[3],连续多次肌注皮质类固醇(4 mg/kg)[4],大剂量脂多糖联合大剂量的皮质类固醇,但尚没有一种能够快速、高效、低死亡率以及更加接近人早期股骨头缺血坏死的动物模型。我们在总结前人成功经验的基础上,旨在建立一个能够真正模拟人早期股骨头缺血坏死的动物模型,使用小剂量脂多糖(10 μg/kg)联合大剂量的地塞米松(25mg/kg)诱导兔股骨头坏死,通过免疫组化和实时定量荧光PCR技术研究了不同时间点兔坏死股骨头内VEGF和Bcl-2基因表达的动态变化。
1 材料和方法
1.1 主要仪器及药品试剂 引物(大连宝生生物工程有限公司);Trizol Reagent(Invitrogen公司);DEPC(Sigma公司);宝生物rTaq酶及配套试剂;ABI9700型PCR扩增仪;台式低温高速离心机( Heraeus instruments,德国);稳压稳流定时电泳仪(BIO-RAD,美国);水平电泳槽(BIO-RAD,美国);紫外分光光度计(BIO-RAD,美国);Opticon荧光定量PCR仪(美国MJ Research公司);SP免疫组织化学试剂盒(Sigma公司);寡核苷酸探针杂交试剂盒(武汉博士德公司);DNaseI(RNase Free,5 U/μl,大连宝生生物工程有限公司);RNase Inhibitor(40 U/μl,美国Promega公司);10×Buffer RT(德国Qiagen公司);dNTP(5 mM,德国Qiagen公司);Qmmiscript RT(40 U/μl,德国Qiagen公司);RNase Free water(德国Qiagen公司);SYBR Green Supermix荧光定量染料(加拿大Bio-Rad Lab)。
1.2 实验动物分组与模型制作 30只雄性新西兰兔,体重2.5~4.0 kg,由沈阳医学院动物实验中心提供,随机分为实验组20只,对照组10只。实验组连续2天每日经耳缘静脉注射10 μg/kg的脂多糖,再连续3天每日臀部肌肉注射地塞米松25 mg/kg,对照组注射同等剂量的生理盐水,所有动物连续3天每日口饲8万单位庆大霉素。于造模第4、8、12周,用空气栓塞法处死后,立即取出双侧股骨头,一侧迅速置于液氮罐中保存作实时定量荧光PCR检测用。另一侧沿冠状面剖开,用20倍4%多聚甲醛液固定24 h后脱钙,常规脱水包埋切片,分别进行免疫组化检测。
1.3 实时荧光定量PCR检测
1.3.1 总RNA的提取 从液氮中取股骨头,置于无菌的研钵研成粉末状后,转入离心管,Trizol试剂加入该管后,按Trizol法的操作规程提取兔股骨头总RNA后纯化、反转录。
1.3.2 引物设计及合成 VEGF上游引物:5’-GTGGACATCTTCCAGGAGTACC-3’;下游引物:5’-GATCCGCATGATCTGCATGGTG-3’;Bcl-2上游引物:5’-GCTACGAGTGGGATACTGGAG-3’;下游引物:5’-ACGGTAGCGACGAGAGAAGT-3’;β-actin上游引物:5’-CGCTGGACTTCGAGCAGGAG-3’;下游引物:5’-CAGGAAGGAGGGCTGGAACA-3’。以上引物均由大连宝生生物工程有限公司合成、纯化。
1.3.3 检测 加入250 ng/μl的cDNA模板2 μl,10 μl SYBR Green荧光染料,上下游引物各0.5 μl,双蒸水7 μl,每个反应体系20 μl,加入定量PCR仪专用毛细管内,放入Opticon荧光定量PCR仪,按如下条件进行PCR反应:95 ℃变性4 min,58 ℃ 30 s,72 ℃ 40 s,76 ℃ 2 s检测荧光,共40个循环。同时,做53~95 ℃范围内的溶解曲线。
1.4 统计学处理 采用SPSS 11.5对数据进行统计,所有资料均用均数±标准差表示,组间比较使用one-way ANOVA方法统计,两组均数之间的比较应用t检验,多个均数之间的比较应用S-N-K检验,计数资料应用χ2检验。P<为差异有显著性。
2 结果
2.1 免疫组化结果 对照组VEGF棕褐色反应产物为阳性定位在血管内皮细胞,Bcl-2阳性定位在成骨细胞。实验组股骨头内VEGF和Bcl-2的表达在造模后第4、8、12周时均为阴性(图1)。
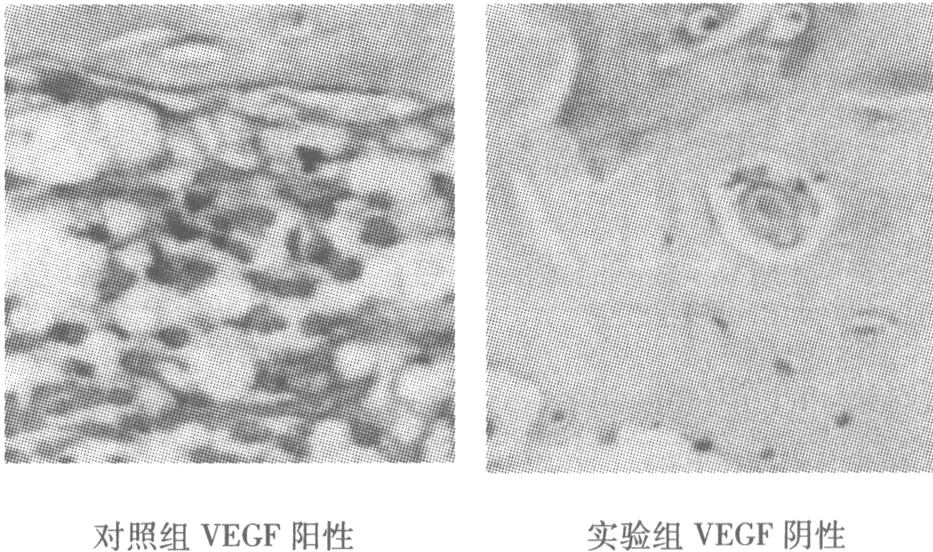
对照组VEGF阳性实验组VEGF阴性
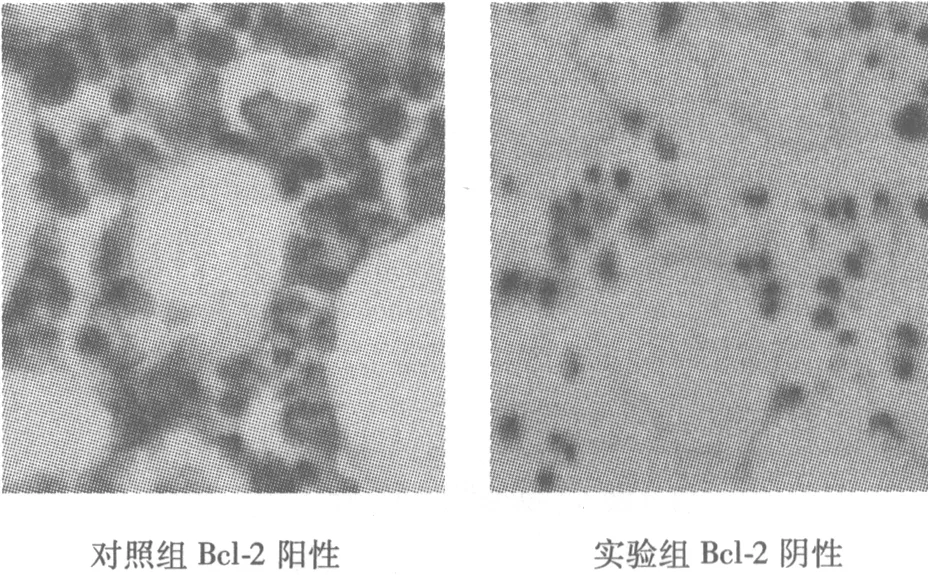
对照组Bcl-2阳性实验组Bcl-2阴性图1 两组免疫组化(×400)
2.2 实时定量荧光PCR结果 实验组在第4、8、12周时,股骨头内VEGFmRNA和Bcl-2mRNA的表达量均大大低于对照组,差异均有显著性(P<0.05)(表1,2)。

表1 实验组与对照组VEGFmRNA表达量
注:与对照组比较1)P<0.05

表2 实验组与对照组Bcl-2mRNA表达量
注:与对照组比较1)P<0.05
3 讨论
股骨头坏死一般自死骨边缘和周围活组织结合部开始修复,表现为血管再生,新骨形成和死骨吸收。但随着修复向死骨中央推进,死骨吸收增强,而血管再生和新骨形成明显减弱。VEGF能特异地作用于血管内皮细胞,主要作用于血管生成的前一阶段,促进其增殖和血管生成[5]。Suzuki等[6]已发现了VEGF可以促进股骨头坏死局部区域的新生血管形成。Li等[7]用ELISA测量研究表明,地塞米松可以降低骨髓多潜能细胞株中VEGF蛋白的合成。因此,股骨头坏死不同时期是否存在VEGF基因表达的差异仍有待探索。最近一项病例对照研究[8]分析了股骨头坏死患者与正常人VEGF基因的差异,发现VEGF基因启动子643G>C基因型与股骨头坏死的危险性显著相关。Tsu ji等[9]研究了导致凋亡过程中的基因表达,发现在低氧状态下细胞更容易凋亡。他还发现在低氧并伴有高剂量激素状态下诱导细胞凋亡的P53、Bax基因和抑制凋亡的Bcl-2和MDM2基因均下调,而在氧正常情况下,高剂量的激素可使Bcl-2 基因上调,他认为在低氧状态下高剂量激素更易引起凋亡。有学者发现,缺氧短期内上调Bcl-2,而较长时间缺氧则使之下调,加速凋亡进程,而转染Bcl-2基因能抑制缺氧诱导凋亡的发生[10]。Bcl-2作为凋亡抑制蛋白,在一些模型中能抑制MPT孔开放,阻抑cyt-C及凋亡诱导因子释入胞质[12]。Bcl-2高表达可以完全阻断复氧期间cyt-C释放及caspase-3,9活化而阻止凋亡发生,即使在缺氧的情况下,Bcl-2高表达也能保持缺氧/复氧细胞线粒体成分完整,促使复氧期间利用底物而促进ATP再生。内质网、线粒体外膜等是ROS产生的重要部位,Bcl-2存在于这些部位,Bcl-2可阻止ROS生成、拮抗H2O2等多种氧化剂诱导的细胞凋亡,这些氧化剂在低浓度时主要通过凋亡途径杀死细胞[12]。细胞凋亡与Ca2+从内质网流入胞质有关,Bcl-2也能阻止这种钙流而阻抑凋亡发生。在激素性股骨头坏死早期,股骨头局部缺血缺氧进一步促使Bcl-2mRNA的表达下调加速细胞凋亡。
实验中我们直接提取出股骨头内RNA,使股骨头坏死模型的研究直接得到了较准确可靠的定量而不仅是定性结果。并通过免疫组化和实时荧光定量PCR等技术检测且相互印证后所得到的结果是相互吻合的,即在地塞米松联合脂多糖制作的兔股骨头坏死动物模型中,股骨头内VEGF和Bcl-2的表达在造模后各时间均受到明显抑制。
参考文献:
[1]Pierre-Jacques H,Mom MA,Pacheco I,et al.An animal model of femoral head collapse with and without cortical and cancellous bone grafting[J].J Bone Joint Surg(Am),1997,79:1079-1084.
[2]Yamamoto T,Hirano K,Tsutsui H,et al.Corticosteroid enhances the experimental induction of osteonecrosis in rabbits with Shwartzman reaction.Clin Orthop Relat Res 1995;316:235-243.
[3]Irisa T,Yamamoto T,Miyanishi K,et al.Osteonecrosis induced by a single administration of low-dose lipopolysaccharide in rabbits[J].Bone,2001,286:641-649.
[4]Yamamoto T,Irisa T,Sugioka Y,et al.Effects of pulse methylprednisolone on bone and marrow tissues:corticosteroid-induced osteonecrosis in rabbits[J].Arthritis Rheum,1997,40:2055-2064.
[5]Ferrara N.Vascular endothelial growth factor:basic science and clinical progress[J].Endocr Rev,2004,25(4):581-611.
[6]Suzuki O,Bishop A T,Sunagawa T.VEGF promoted surgical angiogenesis in necrotic bone[J].Microsurgery,2004,24(1):85-91.
[7]Li X,Jin L,Cui Q,et al.Steroid effects on osteogenesis through mesenchymal cell gene expression[J].Osteoporos Int,2005,16(1):101-108.
[8]Kim T H,Hong J M,Lee J Y,et al.Promoter polymorphisms of the vascular endothelial growth factor gene is associated with an osteonecrosis of the femoral head in the Korean population[J].Osteoarthritis Cartilage,2008,16(3):287-291.
[9]Tsuji M,Ikeda H,Ishizu A,et al.A Itered expression of apoptosis-related genes in osteocytes exposed to h igh-dose steroid hormones and hypoxic stress[J].Pathobiology,2006,73(6):304-309.
[10]Shen JG,Quo XS,B Jiang,et al.Chinonin,a novel drug against cardiomyocyte apoptosis induced by hypoxia and reoxygenation[J].Biochim Biophys Acta,2000,1500(2):217-226.
[11]Cai J,Yang J,Jones DP.Mitochondrial control of apoptosis:the role of cytochrome [J].Biochim Biophys Acta,1998,1366(1):139-149.
[12]Shimizu S,Eguchi Y,Kamiike W,et al.Bcl-2 prevents apoptotic mitochondrial dysfunction by regulating proton flux[J].Proc Natl A cad Sci USA,1998,95(4):1455-1459.

