增龄是雄性大鼠碘对比剂急性肾损伤的促进因素
段绍斌, 汪 翩, 刘 芳, 王娜娜, 潘 鹏, 刘改灵, 许向青, 王予慧,刘伏友, 凌光辉, 李 瑛
(中南大学湘雅二医院肾内科, 长沙 410011)
临床上约10%的急性肾损伤(acute kidney injury,AKI)由对比剂所致, 对比剂急性肾损伤(contrastinduced acute kidney injury, CI-AKI)已成为当前院内 AKI的第三大原因[1]。临床研究显示, 原有肾脏损害、糖尿病肾病、对比剂的渗透性和剂量、充血性心力衰竭、老年(>70岁)是 CI-AKI的独立危险因素[2,3]; 但老龄作为 CI-AKI独立危险因素尚无基础实验研究的文献证实, 且作用机制尚不清楚。
目前大部分学者认为, CI-AKI发病机制与肾缺血、氧化性应激和直接肾小管毒性有关[2]。血管紧张素转换酶(angiotensin converting enzyme, ACE)是肾素-血管紧张素系统(renin angiotensin system,RAS)中一个关键酶, 现有的研究表明, 正常肾功能患者造影后血、尿ACE活性明显升高[4]; 血管紧张素转换酶抑制剂和血管紧张素受体拮抗剂对CI-AKI有一定的保护作用[5,6]。
Sp1蛋白为锌指家族中一种重要的核转录因子,在多种组织中广泛表达, 与细胞增殖、凋亡、分化、炎症修复和新生物的转化过程等密切相关[7]。但是,注射对比剂后肾脏局部组织中ACE活性的变化及Sp1在CI-AKI发病中的作用均未见文献报道。本研究主要探讨年龄对大鼠碘对比剂急性肾损伤的影响,探讨氧化性应激、肾组织ACE和核转录因子Sp1在增龄大鼠碘对比剂急性肾损伤中的作用。
1 材料与方法
1.1 主要试剂
Sp1一抗购自美国Santa Cruz公司, N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glocosaminidase, NAG)检测试剂盒购自上海太阳生物技术有限公司, 脂质过氧化物丙二醛(malonaldehyde, MDA)检测试剂盒购自南京建成生物工程研究所, ACE测定试剂盒(紫外法)购自北京海军总医院, 免疫组织化学二抗试剂盒购自深圳生物晶美科技有限公司, 76%泛影葡胺购自上海信宜制药厂, BCA试剂盒购自江苏碧云天生物科技有限公司。
1.2 实验动物分组与处理
36只健康雄性SD大鼠(购自中南大学湘雅二医院实验动物中心)根据月龄分为 4月龄、12月龄和24月龄组, 每组12只, 各年龄组大鼠再随机分为正常对照组和对比剂组, 每组6只。禁水24 h后, 对比剂组大鼠尾静脉注射碘对比剂 76%泛影葡胺(10 ml/kg), 对照组大鼠尾静脉注射等量生理盐水, 分别收集注射前和注射后24 h尿液测尿NAG酶; 收集注射后 24~48 h期间 24 h尿液测尿肌酐(urine creatinine, UCr); 注射后48 h, 采用10%水合氯醛(3 ml/kg)腹腔注射麻醉, 腹主动脉采血后处死大鼠。
1.3 血尿生化指标检测
自动生化分析仪(Beckmen Synchron CX3,USA)测定血清肌酐(serum creatinine, SCr)水平; 采用碱性苦味酸法测定尿肌酐; 内生肌酐清除率(endogenous creatinine clearance rate, Ccr)=每分钟尿量(ml/min)×尿肌酐浓度(mg/dl)/血清肌酐浓度(mg/dl)。根据试剂盒说明书采用比色法测定尿NAG酶。
1.4 肾组织匀浆MDA含量和ACE活性测定
取0.2g肾皮质组织, 根据试剂盒说明书制备肾组织匀浆液, 采用硫代巴比妥法测定肾组织 MDA含量, 采用马尿酰甘氨酰苷氨酸法测定肾组织 ACE活性, 组织蛋白浓度采用BCA蛋白浓度测定试剂盒测定; 肾组织MDA含量和ACE活性均以蛋白质量进行校正。
1.5 肾脏组织病理形态学观察
取大鼠右侧肾脏下极组织包括皮质和髓质, 用10%中性福尔马林固定12~24 h, 常规脱水, 石蜡包埋, 3 µm切片, HE染色, 光镜检查每组肾脏病理标本的变化并根据Capasso等[8]采用的肾小管损伤的半定量评分标准进行评分。
1.6 免疫组织化学方法检测核转录因子 Sp1蛋白在肾脏组织的表达
常规石蜡切片, 二甲苯脱蜡, 100%~75%乙醇梯度脱水, 用柠檬酸盐缓冲液进行抗原热修复, 加兔抗大鼠一抗Sp1(1:200), 4℃过夜, 37℃恒温烤箱复温30 min, 加生物素标记的二抗, DAB显色, 苏木素复染, PBS缓冲液为阴性对照, 光镜下观察Sp1抗体染色阳性的细胞。采用Image-Pro Plus 6.0在200倍视野下进行免疫组化染色图像分析。阳性细胞呈棕黄色, 每张切片随机选取10个不含肾小球的互不重叠视野分析各视野下阳性目标光密度和阳性面积百分比代表待测抗原的量; 每个样本重复 3次, 取其均数作为统计分析的原始数据。
1.7 统计学处理
所有数据采用SPSS16.0统计学分析软件分析,计量资料以均数±标准差表示, 同年龄段组资料比较采用组间t检验, 不同年龄段组资料组间比较采用单因素方差分析, 多个样本之间的两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血、尿生化指标的变化
表1结果表明, 4月龄鼠对比剂组与对照组比较,Scr、Ccr和注射对比剂前后24 h NAG酶水平差异均无统计学意义(P>0.05); 12月龄鼠对比剂组与对照组比较, Scr水平差异有统计意义(P<0.05), 但升高幅度小于其对照组的25%; 24月龄鼠对比剂组与对照组比较, Scr水平明显升高(P<0.01), 且Scr平均值的升高幅度超过其对照组的25%, Ccr明显降低(P<0.05), 注射对比剂后24 h尿NAG酶水平较注射造影前明显升高(P<0.001; 表1, 表2)。
表1 各组大鼠注射对比剂或生理盐水后Scr和Ccr的比较Table 1 Scr and Ccr after injection of contrast media or normalsaline in rats of different groups (n = 6,±s)
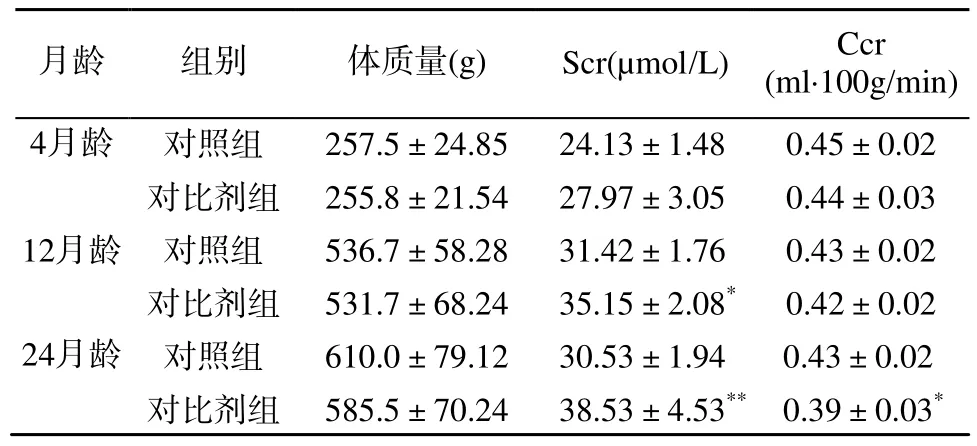
表1 各组大鼠注射对比剂或生理盐水后Scr和Ccr的比较Table 1 Scr and Ccr after injection of contrast media or normalsaline in rats of different groups (n = 6,±s)
注: Scr: 血清肌酐; Ccr: 内生肌酐清除率。与同月龄鼠对照组比较, *P<0.05, **P<0.01
月龄 组别 体质量(g) Scr(µmol/L) Ccr(ml·100g/min)4月龄 对照组 257.5±24.85 24.13±1.48 0.45±0.02 12月龄对比剂组 255.8±21.54 27.97±3.05 0.44±0.03对照组 536.7±58.28 31.42±1.76 0.43±0.02 24月龄对比剂组 531.7±68.24 35.15±2.08* 0.42±0.02对照组 610.0±79.12 30.53±1.94 0.43±0.02对比剂组 585.5±70.24 38.53±4.53** 0.39±0.03*
表2 各组大鼠注射对比剂或生理盐水前后尿NAG酶的变化Table 2 Urinary NAG before and after injection of contrast or normal saline in rats of different groups (n = 6, U/L,±s)

表2 各组大鼠注射对比剂或生理盐水前后尿NAG酶的变化Table 2 Urinary NAG before and after injection of contrast or normal saline in rats of different groups (n = 6, U/L,±s)
注: NAG: N-乙醇-b-D-氨基葡萄糖苷酶。与注射前比较,**P<0.01
月龄 组别 注射前 注射后4月龄 对照组 14.82±2.12 15.24±2.24 12月龄对比剂组 15.46±2.84 16.61±2.92对照组 16.43±3.05 17.69±3.54 24月龄对比剂组 16.73±3.02 19.13±3.12对照组 17.71±2.42 19.24±2.90对比剂组 17.80±3.03 25.18±3.33**
2.2 各组大鼠肾组织匀浆 MDA含量和 ACE活性的变化
表3结果表明, 4月龄鼠和12月龄鼠对比剂组分别和相应的对照组比较, 肾组织ACE和MDA水平差异均无统计学意义(P>0.05); 24月龄鼠对比剂组肾组织ACE和MDA水平均显著高于对照组(P<0.01)。
表3 各组大鼠肾组织匀浆液MDA含量和ACE活性的变化Table 3 MDA level and ACE activity of renal tissue of rats in different groups (n = 6,±s)

表3 各组大鼠肾组织匀浆液MDA含量和ACE活性的变化Table 3 MDA level and ACE activity of renal tissue of rats in different groups (n = 6,±s)
注: ACE: 血管紧张素转换酶; MDA: 丙二醛。与同月龄鼠对照组比较, **P<0.01; 与24月龄鼠对比剂组比较, ##P<0.01
月龄 组别 ACE (U/mg prot) MDA (nmol/mg prot)4月龄 对照组 1.75±0.71 2.90±0.69 12月龄对比剂组 2.10±0.84## 3.24±0.60##对照组 2.81±1.15 3.35±0.91 24月龄对比剂组 4.10±1.69## 3.89±1.16##对照组 2.61±0.49 5.43±1.53对比剂组 7.84±2.19** 7.65±2.03**
2.3 各组大鼠肾组织病理变化
HE染色结果提示, 4月龄鼠和12月龄鼠对照组肾小管、肾小球、肾间质区结构大致正常, 24月龄鼠对照组可见肾小球肥大、局灶肾小管上皮细胞空泡变性及肾小管上皮细胞萎缩; 4月龄鼠对比剂组和12月龄鼠造影组分别与相应对照组比较, 可见局灶肾小管上皮细胞空泡变性, 肾间质轻微水肿, 24月龄鼠对比剂组可见肾小管上皮细胞空泡变性, 管腔明显扩大, 刷状缘丢失, 大量上皮细胞核脱落,部分小管上皮细胞坏死(图1)。
半定量分析结果显示, 4月龄鼠和12月龄鼠对比剂组分别与相应对照组比较, 肾小管损伤分数无统计学差异(P>0.05), 24月龄鼠对比剂组肾小管损伤分数明显高于其他组(P<0.01; 表4)。
2.4 免疫组织化学方法检测各组大鼠肾组织 Sp1蛋白表达的变化
4月龄鼠对比剂组与12月龄鼠对比剂组分别与相应的对照组比较, Sp1蛋白表达均无明显差异(P>0.05); 24月龄对比剂鼠肾组织Sp1蛋白阳性表达明显增强(P<0.05; 图2)。
2.5 24月龄鼠对比剂组肾组织 Sp1蛋白表达、MDA含量、ACE活性与SCr和肾小管损伤分数的相关分析
相关分析结果显示, 24月龄鼠对比剂组肾组织Sp1蛋白表达、MDA含量、ACE活性均与Scr、肾小管损伤分数呈正相关(γ = 0.877, γ = 0.897, γ = 0.845,P<0.05; γ = 0.819, γ = 0.820, γ = 0.816,P<0.05)。
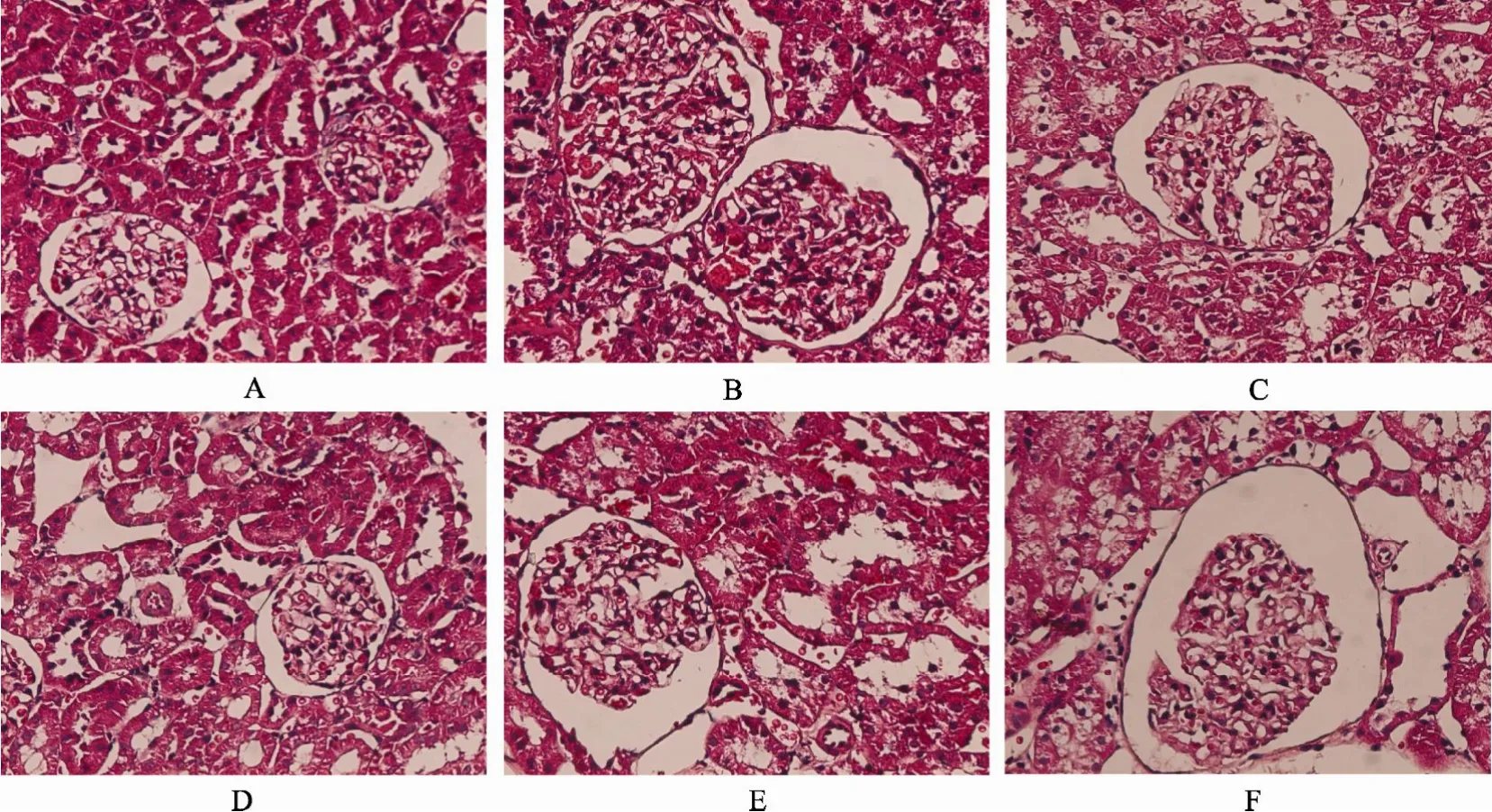
图1 各组肾脏病理改变Figure 1 Pathological changes of kidney in rats of different groups (HE ×200)
表4 各组大鼠肾小管损伤分数Table 4 Renal tubular injury score of rats in different groups (n = 6,±s)

表4 各组大鼠肾小管损伤分数Table 4 Renal tubular injury score of rats in different groups (n = 6,±s)
注: 与同月龄鼠对照组比较, *P<0.05; 与24月龄鼠对比剂组比较, ##P<0.01
月龄 组别 肾小管损伤分数4月龄 对照组 0.12±0.03对比剂组 0.14±0.04##对照组 0.22±0.03 12月龄对比剂组 0.25±0.04##对照组 1.26±0.17 24月龄对比剂组 3.46±0.68*

图2 免疫组织化学检测各组大鼠肾脏组织Sp1蛋白阳性表达率Figure 2 Expression rate of Sp1 protein assessed withimmunohistochemical method
3 讨 论
CI-AKI是X线对比剂使用后严重并发症之一,2010年欧洲泌尿系统放射学会对比剂安全委员会对1999年对比剂急性肾损伤指南进行更新, 提出年龄大于70岁是CI-AKI的危险因素[2]。但另有研究表明,年龄不是CI-AKI的危险因素[9,10]。本研究表明, 24月龄鼠注射对比剂后, SCr显著升高, 且升高幅度超过同组对照鼠的25%, Ccr明显降低, 注射对比剂后 24 h尿 NAG酶水平较注射造影剂前明显升高,肾组织出现明显损害, 肾小管损伤分数明显升高;而 12月龄鼠注射对比剂后, Scr虽然明显上升, 但升高幅度小于同组对照鼠的 25%; 4月龄鼠注射对比剂后与其对照鼠比较, 上述各项指标均无明显变化, 提示年龄是促进雄性大鼠对比剂急性肾损伤的危险因素, 进一步支持老龄是CI-AKI的危险因素。
目前大部分学者认为, 对比剂急性肾损伤的发病机制与肾缺血、直接肾毒性及氧化性应激有关。Gupta等[11]认为对比剂引起肾脏血流量下降可能与RAS的活性增高引起的肾血管收缩有关; Gami等[12]通过复习文献指出, AngⅡ可能参与了对比剂引起的肾血管收缩。ACE是RAS中一个关键酶, 正常肾脏组织ACE主要定位于近曲小管刷状缘, 较少存在于肾小球, 组织损伤可以导致 ACE活性的变化。本课题组过去的研究发现, 在注射对比剂后24 h和48 h,患者血、尿 ACE活性明显升高[4]; 对比剂可导致肾脏局部 AngⅡ水平的明显升高, 血管紧张素转换酶抑制剂和血管紧张素受体拮抗剂对 CI-AKI有保护作用[5,6]。本实验进一步观察到, 24月龄鼠注射对比剂后肾组织 ACE活性显著升高, 肾组织 ACE活性与SCr、肾小管损伤分数呈显著正相关, 提示肾脏局部ACE激活在24月龄鼠CI-AKI中起一定作用。其机理可能是对比剂促使肾脏局部ACE活性增强, 激活肾脏RAS系统, 导致肾脏组织局部AngⅡ急性升高, 引起肾脏血管收缩, 加重氧化性应激导致的肾脏损害。
氧化性应激在对比剂肾病发生发展中的作用已引起广泛关注, 活性氧可增加肾小球入球动脉阻力和肾小球出球动脉阻力, 且肾小球入球动脉阻力>肾小球出球动脉阻力, 因而降低了肾小球超滤系数,加剧了对比剂引起的肾缺血[13]。本课题组过去的研究表明, 对比剂可引起肾组织匀浆液中 MDA水平增高[14]; 本研究结果进一步提示, 24月龄鼠注射对比剂后, 肾组织MDA水平较同组对照鼠及4月龄和12月龄对比剂大鼠均明显增高, 肾脏出现明显病理损害, 肾组织MDA含量分别与SCr和肾小管损伤分数呈正相关, 提示氧化性应激在 24月龄鼠 CI-AKI发病机制中亦起一定作用。
Sp1蛋白是锌指家族中一种重要的核转录因子,与细胞增殖、凋亡、分化、炎症修复和新生物的转化过程等密切相关[7]。本实验结果发现, 24月龄鼠注射对比剂后肾组织Sp1蛋白表达较对照组明显升高,肾脏局部 Sp1蛋白与 SCr、肾小管损伤分数呈正相关, 提示Sp1可能在老年CI-AKI中起一定作用。
综上所述, 增龄是对比剂急性肾损伤的危险因素, 其发病机制除与肾缺血、氧化性应激、肾组织Sp1蛋白高表达等因素有关外, 可能还与随着年龄的增长, 肾脏的储备能力下降、不同程度的周围血管硬化、肾血流量改变、机体调节功能差、对急性外源性损伤因素的抵抗能力降低、对许多易致急性肾衰竭的危险因素的敏感性增高有关。
[1]Cronin RE. Contrast-induced nephropathy: pathogenesis and prevention[J]. Pediatr Nephrol, 2010, 25(2): 191-204.
[2]Stacul F, van der Molen AJ, Reimer P,et al. Contrast induced nephropathy: updated ESUR Contrast Media Safety Committee guidelines[J]. Eur Radiol, 2011, 21(12): 2527-2541.
[3]Mehran R, Aymong ED, Nikolsky E,et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation[J]. J Am Coll Cardiol, 2004, 44(7): 1393-1399.
[4]Duan SB, Wu HW, Luo JA,et al. Assessment of renal function in the early stages of nephrotoxicity induced by iodinated contrast media[J]. Nephron, 1999, 83(2): 122-125.
[5]Duan SB, Wang YH, Liu FY,et al. The protective role of telmisartan against nephrotoxicity induced by X-ray contrast media in rat model[J]. Acta Radiol, 2009, 50(7): 754-759.
[6]段绍斌, 邹 琴, 李英娟, 等. 高渗和低渗对比剂肾毒性及福辛普利或替米沙坦的保护作用[J]. 中南大学学报(医学版), 2007, 32(5): 812-818.
[7]Ishibashi H, Nakagawa K, Onimaru M,et al. Sp1 decoy transfected to carcinoma cells suppresses the expression of vascular endothelial growth factor, transforming growth factor beta1, and tissue factor and also cell growth and invasion activities[J]. Cancer Res, 2000, 60(22): 6531-6536.
[8]Capasso G, Di Gennaro CI, Della Ragione F,et al.In vivoeffect of the natural antioxidant hydroxytyrosol on cyclosporine nephrotoxicity in rats[J]. Nephrol Dial Transplant, 2008,23(4): 1186-1195.
[9]Pakfetrat M, Nikoo MH, Malekmakan L,et al, Risk factors for contrast-related acute kidney injury according to risk,injury, failure, loss, and end-stage criteria in patients with coronary interventions[J]. Iran J Kidney Dis, 2010, 4(2):116-122.
[10]李美花, 范 利. 老年人造影剂肾病及临床相关因素分析[J].中国老年医学杂志, 2005, 25(6): 649-650.
[11]Gupta RK, Kapoor A, Tewari S,et al. Captopril for prevention of contrast-induced nephropathy in diabetic patients: a randomised study[J]. Indian Heart J, 1999, 51(5):521-526.
[12]Gami AS, Garovic VD. Contrast nephropathy after coronary angiography[J]. Mayo Clin Proc, 2004, 79(2): 211-219.
[13]Pflueger A, Abramowitz D, Calvin AD,et al. Role of oxidative stress in contrast-induced acute kidney injury in diabetes mellitus[J]. Med Sci Monit, 2009, 15(6): 125-136.
[14]Duan SB, Liu FY, Luo JA,et al. Nephrotoxicity of high- and low-osmolar contrast media. The protective role of amlodipine in a rat model[J]. Acta Radiol, 2000, 41(5):503-507.

