乙型肝炎病毒x基因转染肾小管上皮细胞导致细胞凋亡的机制探讨
王 轩 周 益 朱 楠 袁伟杰
乙型肝炎病毒(HBV)感染除了导致急/慢性肝炎、肝硬化、肝癌以外,还可以并发多种肝外损害,其中HBV相关性肾炎(HBV-GN)最为常见,其发病机制至今尚未完全阐明。于艳等[1]研究发现,HBV-GN患者肾小管上皮细胞中存在HBV x基因(HBx)mRNA的异常表达,提示HBx与肾小管上皮细胞的损伤凋亡密切相关。Toll样受体4(TLR4)作为识别病原微生物的主要受体,可识别HBV,并抑制其复制;TLR4亦是一个损伤敏感性高度表达蛋白质,在急性肾损伤中表达上调并诱导细胞凋亡[2]。据此,本研究以人近端肾小管上皮细胞系(HK-2细胞)为研究对象,将HBx瞬时转染入细胞中,旨在观察HBx对HK-2细胞TLR4表达及细胞凋亡、细胞因子分泌的影响。
材料与方法
主要材料 HK-2永生化细胞株由上海长征医院梅长林教授馈赠。K-SFM无血清培养基购自GIBCO公司,限制性内切酶Kpn I和EcoR V、Taq酶购自Takara公司;T4 DNA连接酶、感受态细菌TOP 10、DNA纯化回收试剂盒和质粒抽提试剂盒购自TIANGEN公司;脂质体转染试剂 LipofectamineTM2000、Trizol RNA提取试剂盒购自Invitrogen公司,HBx抗体和TLR4抗体购自Abcam公司,ECL化学发光试剂盒购自Sigma公司,BCA蛋白浓度测定试剂盒购自碧云天生物科技,AnnexinV、PI购自BD公司,白细胞介素4(IL-4)ELISA kit、干扰素 γ(IFN-γ)elisa kit购自sunteam公司。
实验方法
质粒构建 根据GenBank中ayr亚型HBV基因组序列,设计HBx基因的引物,其引物上、下游分别包含有Kpn I和EcoR V内切酶酶切位点(画线处为酶切位点),上游引物为5’-GGGGTACCGTGGCAGAGGTGAAAAAGTTGC-3’,下游引物为5’-GCCGATATCCTAACATTGAGATTCCCGAG-3’扩增纯化HBx基因片段,将纯化得到的 HBx片段与pcDNA3.1/myc质粒分别用限制性内切酶Kpn I和EcoR V进行双酶切,于琼脂糖凝胶上电泳、回收纯化酶切产物,经T4 DNA连接酶16℃过夜连接后,转化TOP 10感受态细胞,氨苄青霉素筛选培养,挑取阳性克隆扩增后提取质粒进行双酶切和DNA测序鉴定。
细胞培养 从液氮中取出冻存的HK-2细胞,迅速复苏后置于K-SFM无血清培养基中,培养条件为37℃,5%CO2,隔天换液,细胞贴壁生长,密度达80%时,0.25%胰酶消化传代。
质粒转染 取对数生长期细胞,以8×105/孔接种至六孔板,K-SFM无血清培养基中37℃,5%CO2贴壁培养过夜。真核表达质粒用LipofectamineTM2000转染试剂进行转染,转染过程参照LipofectamineTM2000说明进行。步骤简述如下:(1)将一定量的HBx质粒或空载质粒溶于一定量的Opti-MEM I中,轻柔混匀(使用的量根据说明书计算获得);(2)稀释一定量的Lipofectamine 2000至一定量的Opti-MEM I中,室温孵育5 min;(3)将二者混匀,室温孵育20 min;(4)每孔加入混合物和一定量的Opti-MEM I,轻柔混匀,37℃孵育6h后换液继续培养。转染24h后在显微镜下观察细胞的形态。实验分为三组:未处理细胞组、转染pcDNA3.1b/myc质粒组和转染pcDNA3.1b/myc-HBx 质粒组。
RT-PCR验证HBx转染、检测TLR4 mRNA水平
用Trizol提取RNA,RNA用于反转录合成cDNA。cDNA模板于包含有ddH2O、10×反应缓冲液、dNTP、SYBR Premix EX Taq、DNA聚合酶和引物的PCR混合液中扩增。HBx及TLR4特异性引物序列见表l。热循环体系:95℃变性30s,接着40个循环包括95℃变性20s,60℃退火30s,72℃延伸20s。溶解曲线分析:温度从60℃以0.2℃/s的速度升至95℃,用于评估扩增的特异性。各样本HBx基因的扩增结果用 GAPDH的浓度校正。2-△△CT法计算HBx mRNA、TLR4 mRNA的倍数变化。
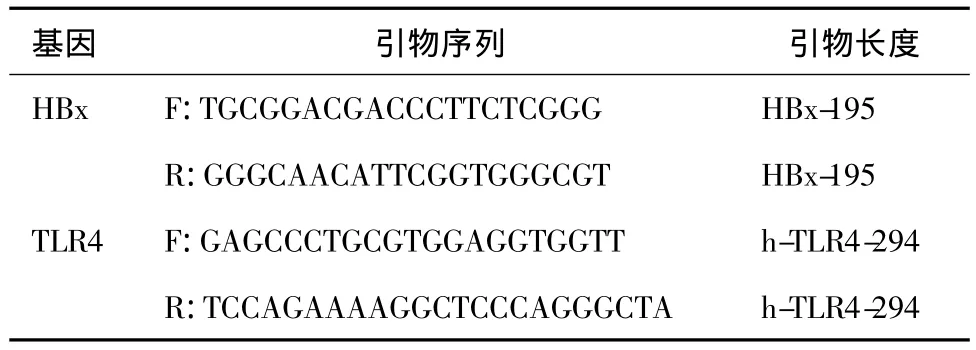
表1 各基因引物序列
Western Blot验证质粒特异性、检测TLR4水平
蛋白样品收集 将培养的细胞吸去培养液,用PBS冲洗两次后,加入2×细胞裂解液用枪头搅动以充分裂解细胞,95℃水浴加热10 min,立刻置于冰上,可立即使用或储存于-70℃。用BCA试剂盒(PIERCE)进行蛋白质定量,取合适量的裂解液加入等体积2×蛋白上样缓冲液,95℃水浴变性10 min,即可用于 Western Blot分析,或储存于 -70℃冰箱。
蛋白印迹 (1)电泳:SDS-PAGE电泳,80V 30 min,160V 50 min左右。(2)转膜:电泳结束后,将凝胶移入转膜缓冲液固定3~5 min。硝酸纤维素膜先用ddH2O浸湿后再用转膜缓冲液浸泡。按转膜电极板阴极至阳极方向,依次叠放滤纸、电泳凝胶、膜及滤纸。去除各层间的残留气泡,湿转仪(Invitrogen)30V转膜35 min。(3)转膜完毕后将膜置入含5%(w/v)脱脂奶粉的PBST中,室温下封闭1 h。(4)用封闭液稀释一抗,室温下反应2 h,或4℃反应过夜,用PBST洗涤3次,5 min/次。(5)用封闭液稀释荧光二抗,室温下反应30 min,用PBST洗涤3次,5 min/次。(6)用Odyssey红外成像系统(LI-COR Biosciences)扫描硝酸纤维素膜。
流式细胞术检测细胞凋亡 转染24h后的HK-2细胞以及未转染的对照组细胞用0.25%胰酶消化后收集细胞,每管细胞数1×105/100 μl,经 PBS洗涤2次,用凋亡检测Buffer洗涤一次,分别加入5 μl AnnexinV 和10 μl PI,室温孵育15 min后,再加入凋亡检测Buffer 400 μl,上FACS流式细胞仪检测后,用CELLQuest软件进行数据分析。
ELISA检测细胞培养上清中IL-4、IFN-γ水平取对数生长期的三组细胞,以2.5×106/孔接种至六孔板内,培养24h后,收集细胞培养上清,-80℃保存。按照ELISA试剂盒要求操作,酶标仪450 nm处各孔A值,根据标准曲线及A值计算各待测样本的浓度值。
统计学分析 应用SPSS 17.0统计软件进行处理,结果均用均数±标准差表示,两组间均值比较采用独立样本t检验,P<0.05为差异有统计学意义。
结 果
质粒图及质粒验证 所构建的质粒图如图1所示,菌液PCR鉴定,采用T7/BGH测序引物鉴定,序列正确,产物长度应为700 bp。结果表明挑选的4个克隆都为阳性(图1)。

图1 质粒图及质粒验证图
瞬时转染pcDNA3.1/myc-HBx质粒后 HK-2细胞中HBx的表达鉴定选取转染24h后的细胞为研究对 象,RT-PCR 结 果 显 示 (图 2A),转 染pcDNA3.1/myc-HBx质粒后 HK-2 细胞可见 HBx 表达,而转染空载体pcDNA3.1/myc的HK-2细胞中未见 HBx表达。Western blot检测结果显示(图2B),转染 pcDNA3.1/myc-HBx 质粒的 HK-2 细胞中可见HBx表达,而未经转染HBx基因的HK-2细胞未见HBx表达。
显微镜观察 pcDNA3.1/myc-HBx质粒转染后HK-2细胞的形态 显微镜下观察,正常未处理的细胞贴壁良好,呈“铺路石”样,细胞数量较多,折光性好;转染了pcDNA3.1/myc质粒后,细胞数量有所减少,细胞贴壁、折光性下降;转染 pcDNA3.1/myc-HBx质粒后,细胞数量明显下降,细胞形态不规则,贴壁率、折光性下降,细胞中有较多的颗粒,细胞状态受损(图3)。
各组HK-2细胞中TLR4的表达 RT-PCR结果(图4A)显示转染pcDNA3.1/myc细胞组和未处理细胞组中TLR4均呈低表达,转染HBx基因组较前两组细胞中TLR4 mRNA表达明显增加(P<0.05),前两组TLR4的水平无明显差异。Western Blot结果(图4B)和RT-PCR结果一致,转染 HBx基因组中TLR4蛋白表达水平较两组对照组明显上调(P <0.05)。
各组细胞凋亡情况 用Annexin V和PI双染的方法,流式细胞仪测定细胞的凋亡情况。结果显示转染pcDNA3.1/myc-HBx质粒的HK-2细胞凋亡率为14.94% ±0.32%,较对照组转染pcDNA3.1/myc质粒的 HK-2细胞 13.67% ±0.54%明显增加(P<0.05),较未处理的细胞13.86% ±0.18%增加(P<0.05)。转染pcDNA3.1/myc质粒组和未处理组细胞凋亡率无统计学差异(P>0.05)(图5)。
各组细胞培养上清中 IL-4、IFN-γ水平 ELISA结果显示(图6)转染 pcDNA3.1/myc-HBx质粒组IL-4水平(24.97±12.04),明显低于未处理细胞组(63.80±8.50)和转染 pcDNA3.1/myc质粒组(60.11±7.58)(P<0.05)。转染 pcDNA3.1/myc-HBx质粒组IFN-γ水平(16.32 ±2.52)明显高于未处理细胞组(12.08±0.75)和转染 pcDNA3.1/myc质粒组(12.73±2.96)(P<0.05)。

图5 流式细胞术检测各组细胞凋亡率

图6 ELISA检测各组细胞培养上清中IL-4、IFN-γ水平
讨 论
我国是HBV感染高发地区,HBV-GN已成为我国主要的继发性肾脏疾病之一,但由于HBV结构、感染方式、免疫特性等因素的复杂性,至今HBV-GN发病机制仍不完全清楚。HBV具有明显的种属特异性,仅感染人类和某些灵长类细胞,且HBV体外感染细胞持续时间短,稳定性差,给建立HBV感染细胞模型及进一步进行相关研究带来很大的困难。由于HBx基因在HBV感染相关疾病发病过程中起关键作用[3],因此探讨HBx基因片段功能可为更好地揭示HBV感染的发病机制提供新的实验途径。本研究以中国人易感染型HBV adr亚型中基因片段HBx作为基因来源,选择真核表达载体pcDNA3.1/myc作为母载体,构建了质粒 pcDNA3.1/myc-HBx,并经酶切、测序等鉴定,表明pcDNA3.1/myc-HBx质粒构建成功。由于所使用的人近端肾小管上皮细胞系HK-2较易进行转染,故本研究采用脂质体介导的瞬时转染法将pcDNA3.1/myc-HBx 转染入HK-2细胞,通过RT-PCR及Western Blot方法验证了HBx基因在HK-2细胞中的表达,表明已成功的建立HBx转染肾小管上皮细胞模型,这为后续细胞损伤及凋亡研究奠定了基础。
HBx基因转入HK-2细胞后,细胞形态发生不规则改变,贴壁率及折光率下降,且细胞中出现较多的颗粒。我们前期研究结果亦显示,HBV感染后肾小管上皮细胞,形态不规则,出现较多的细胞碎片,且细胞融合现象显著。提示HBV成分感染细胞后可导致细胞形态及生物学特性受损[4]。现已明确,HBx基因转入细胞后,HBx蛋白能够诱导线粒体渗透性改变,使钙离子内流至细胞质,激活钙离子依赖的激酶途径,促进HBV-DNA的复制,损伤组织细胞[5]。HBx 也可通过活化蛋白 1(AP-1)、AP-2、转录活化因子/环磷酸腺苷反应元件结合蛋白(ATF/CREB)、核因子 κB(NF-κB)、活化的 T 细胞核因子(NF-AT)等多重顺式元件及肾素血管紧张素系统/促分裂原活化蛋白激酶(RAS/MAPK)、富含脯氨酸的酪氨酸激酶2(Pyk2)、C-Jun氨基末端激酶(JNK)等多个信号转导途径激活转录,促进病毒复制[6]。然而,HBx基因的转入虽使肾小管上皮细胞形态受损,但其具体机制尚不明确。
HBx是HBV复制所必需的转录因子,具有反式激活作用,不仅能通过调控多种转录因子,促进病毒的复制,损伤细胞[7],亦能通过蛋白与蛋白之间的相互作用参与细胞的增生和凋亡[8]。HBx引起的细胞过度凋亡是HBV持续感染肝组织致肝脏纤维化及肝癌发生的重要机制之一[9]。本研究在HBx转染肾小管上皮细胞基础上,采用流式分析术检测细胞凋亡情况,发现转染HBx基因后,与对照组相比,细胞的凋亡率明显上升。我们曾在HBV-GN患者肾组织中发现Bcl-2和Bax表达显著升高,提示HBV-GN中存在细胞凋亡[10]。当细胞大量凋亡超过吞噬细胞的清除能力时,可导致大量凋亡小体的聚集、降解和前炎症内容物的释放,引起前炎症因子肿瘤坏死因子 α(TNF-α)、转化生长因子 β(TGF-β)等产生。有研究证实,HBx诱导肾小管上皮细胞的过度凋亡可导致肾小管间质纤维化[11]。
我们体内研究发现HBV-GN患者肾组织中有TLR4表达异常,且主要分布于肾小管上皮细胞及间质组织,参与肾组织病变的进展[12]。体外实验证实HBV感染肾小管上皮细胞后TLR4表达明显增加[4]。本研究采用 RT-PCR及 Western blotting检测各组细胞TLR4的表达水平,结果显示,转染HBx基因后TLR4的表达水平与对照组相比明显上升,提示HBx蛋白具备调节TLR4生成的作用。本研究还发现TLR4表达水平较高的组,细胞的凋亡率亦较高,细胞的凋亡率与TLR4水平有相关性。由此推测HBx促进细胞凋亡发生可能与其引起TLR4的表达上调有关。TLR4是一种模式识别受体,可表达于肾小管上皮细胞表面,其能识别多种病毒,启动细胞内信号转导通路,激活IL-6、TNF-α等相关炎症因子的表达,诱发细胞内的炎症反应,导致细胞损伤或细胞凋亡;TLR4也能通过MyD88途径激活NF-κB,引起后续生物学反应。据郝诚诚[13]等报道,大鼠过度训练动物模型中肾小管上皮细胞TLR4表达上调,上调的TLR4激活周围炎性细胞上的Fas配体,被激活的Fas配体与肾小管上皮细胞表面的Fas蛋白相互作用,激活Fas相关死亡结构域蛋白(FADD)/Caspase-8信号转导通路从而导致细胞凋亡。肝细胞表面TLR4诱发失控性炎症产生的细胞毒作用亦可引起肝细胞通过FasL凋亡机制发生凋亡[14]。在人肾小管上皮细胞中TLR4以何种途径介导HBx对肾小管上皮细胞凋亡作用还需进一步研究。
目前研究认为HBx引起TLR4激活后,可启动细胞内信号转导通路,诱导特异性基因表达,分泌多种促炎症细胞因子,诱导炎症发生,促进T辅助细胞(Th)发生 Th1/Th2格局变化[15]。本研究中用ELISA方法检测了细胞培养上清中细胞因子IL-4、IFN-γ水平,发现转染HBx基因后肾小管上皮细胞分泌 IL-4、IFN-γ 异常,即 HBx 抑制了 IL-4 分泌,增强IFN-γ分泌,导致 IL-4/IFN-γ水平失衡。而细胞因子的类别及细胞因子之间的平衡对Th0细胞分化为Th1/Th2具有重要的调节作用。Th2细胞的分化依赖IL-4,而IFN-γ可以抑制Th2细胞的增生,使分化朝着Th1细胞方向发展,因此,IL-4和IFN-γ之间的平衡影响着Th1/Th2细胞之间的平衡,Th1/Th2细胞之间的失衡参与了慢性HBV感染过程[16]。根据本研究结果,HBx基因引起 IL-4、IFN-γ异常,可能由此引起 Th1/Th2细胞失衡,参与 HBV-GN的进展。
综上所述,HBx在体外转染肾小管上皮细胞后,可引起肾小管上皮细胞损伤,细胞凋亡率增加,这可能与HBx引起TLR4上调有关。HBx亦能引起一些细胞因子分泌紊乱,参与肾脏的损伤。进一步的相关机制的研究必将为临床治疗HBV-GN提供新的治疗靶点。
1 于 艳,张 静,王汉民,等.乙型肝炎病毒相关性肾炎肾组织中HBx、MHBst mRNA的表达及其意义.细胞与分子免疫学杂志,2008,24(9):915 -917.
2 Pulskens WP,Teske GJ,Butter LM,et al.Toll-like receptor 4 coordinates the innate immune response of the kidney to renal ischemia/reperfusion injury.PloS One,2008,3(10):e3596.
3 Birrer RB,Birrer D,Klavins JV.Hepatocellular carcinoma and hepatitis virus.Ann Clin Lab Sci,2003,33(1):39 -54.
4 朱 楠,袁伟杰,周 益,等.乙型肝炎病毒感染肾小管上皮细胞Toll样受体4的表达及其作用.中华内科杂志,2011,50(6):505-509.
5 Tan C,Guo H,Zheng M,et al.Involvement of mitochondrial permeability transition in hepatitis B virus replication.Virus Res,2009,145(2):307 -311.
6 Keasler VV,Hodgson AJ,Madden CR,et al.Enhancement of hepatitis B virus replication by the regulatory X protein in vitro and in vivo.J Virol,2007,81(6):2656 -2662.
7 Moolla N,Kew M,Arbuthnot P.Regulatory elements of hepatitis B virus transcription.J Viral Hepat,2002,9(5):323 - 331.
8 Clippinger AJ,Gearhart TL,Bouchard MJ,et al.Hepatitis B virus X protein modulates apoptosis in primary rat hepatocytes by regulating both NF-kappaB and the mitochondrial permeability transition pore.J Virol,2009,83(10):4718 -4731.
9 Hu L,Chen L,Li L,et al.Hepatitis B virus X protein enhances cisplatin-induced hepatotoxicity via a mechanism involving degradation of Mcl-1.J Virol,2011,85(7):3214 - 3228.
10孙莉静,于建平,袁伟杰,等.Bcl-2和Bax在乙型肝炎病毒相关性肾炎患者肾组织中的表达.第二军医大学学报,2007,28(5):492-494.
11 Huang H,Ma C,Yang M,et al.Adrenomedullin impairs the profibrotic effects of transforming growth factor-beta1 through recruiting Smad6 protein in human renal tubular cells.Cell Physiol Biochem,2005,15(1-4):117 -124.
12 朱 楠,周 益,袁伟杰,等.乙型肝炎病毒相关性肾炎中Toll样受体4沉积特点及其意义.中华内科杂志,2011,50(12):1008-1012.
13 郝诚诚,吴广礼.过度训练可部分通过上调TLR4的表达激活死亡受体凋亡通路诱导大鼠肾小管上皮细胞凋亡.中国中西医结合肾病杂志,2012,13(2):125 -128.
14 Akira S,Takeda K.Toll-like receptor signaling.Nat Rev Immunol,2004,4(7):499 -511.
15 Yu Y,Wu H,Tang Z,et al.CTLA4 silencing with siRNA promotes deviation of Th1/Th2 in chronic hepatitis B patients.Cell Mol Immunol,2009,6(2):123 -127.
16 Jiang Y,Ma Z,Xin G,et al.Th1 and Th2 immune response in chronic hepatitis B patients during a long-term treatment with adefovir dipivoxil.Mediators Inflamm,2010,2010:143026.

