俄罗斯鲟雌核发育诱导及其后代的微卫星分析*
姜彦超,苏建通,董 颖,胡红霞
(1.大连海洋大学,辽宁 大连 116023;2.北京市水产科学研究所,北京 100086)
鲟形目Acipenseriformes是一种很古老的软骨硬鳞鱼类,在鱼类乃至整个脊椎动物进化史上占有着很重要的地位,素有“活化石”之称[1]。世界上现存的鲟形目鱼类约27种,其中绝大部分为河海洄游性鱼类[2]。鲟鱼因其鱼籽酱的高价值而成为一种重要的世界性经济鱼类,由于过度捕捞、鲟鱼产卵场所和栖息地的破坏以及环境污染等原因的影响,导致世界鲟鱼资源总量急剧下降,许多种类濒临灭绝[3]。因此采用人工养殖和繁殖鲟鱼的方法,可以大大减轻对野生资源依赖的压力,非常有利于资源的恢复。随着鲟鱼养殖业的迅速发展,生产目标已经由鲟鱼产量向鲟鱼最有价值的产品——鱼籽酱方向转化,因此,生产和培育全雌化的苗种就成为鲟鱼产业化发展的研究重点,全雌鲟鱼的养殖也具有很高的经济价值。
人工诱导鱼类雌核发育就是用遗传失活的精子激活卵子后,再通过抑制受精卵的极体排出或第一次卵裂而发育成子代的一种特殊的有性生殖方式。雌核发育技术已被成功应用于青鳉[4]、斑马鱼[5]、牙鲆[6]、鲤鱼[7]等鱼类的遗传育种研究中。但是传统的鱼类雌核发育子代纯合度都依赖于表型、染色体技术等去鉴定。尽管所得雌核发育子代可证明是由雌核发育所获得,但无法确定所获雌核发育子代是否存在基因重组现象,也无法证明其在基因座位 (特别是与经济性状相关的基因座位) 上表现为纯合子还是杂合子。因此还应利用微卫星等分子标记对其进行进一步分析。
微卫星 (Microsatellites) ,又称简单序列重复(Simple sequence repeats,SSRs) 、 短串联重复 (Short tandem repeats,STRs) 、 简单序列长度多态性(Simple sequence length polymorphism,SSLP) ,是指以少数几个核苷酸(一般为 1~6 个)为重复单位组成简单的串联重复序列 ,由于重复的次数不同以及重复的程度不一致而造成这些序列的多态性[8]。1992年Goff等[9]首次从斑马鱼基因组中筛选出微卫星标记序列,此后微卫星标记便成为生物标记领域中极为重要的一员。目前已经在斑马鱼Daniorerio[10]、尼罗罗非鱼Oreochromisnilotica[11]、鲑科鱼类(大西洋鲑Salmosalar,红点斑Salvelinusalpinus,虹鳟Oncorhynchusmykiss)[12,13 14 ]以及鲟形目鱼类(密西西比铲鲟Scaphirhynchusplatorynchus,高首鲟Acipensertransmontanus和太平洋鲟A.medirostris)[17-18 ]等多种鱼类中获得了微卫星标记序列。因微卫星标记可提供高多态性高分辨率的遗传信息[21-22 ],且通用性好、呈孟德尔方式遗传、属于共显性的标记,具有明显优于其他分子标记的优势[23],所以已被广泛应用于鱼类遗传育种研究的各个方面,包括种群遗传结构分析、亲子鉴定与个体识别、遗传作图等,取得了较大的进展。
本研究以冷休克和热休克法诱导俄罗斯鲟雌核发育,在对其后代进行形态学鉴定的基础上,进一步利用微卫星标记区分其中的雌核发育后代、单倍体后代和杂交后代,并计算出雌核发育后代的重组率,证明了微卫星DNA分子标记是可以用来进行雌核发育后代分析的,特别是在常规方法难以分辨的单倍体后代鉴别以及雌核发育后代重组率计算方面具有突出的优点。为探讨和完善俄罗斯鲟人工雌核发育的诱导方法和分子鉴定方法的研究,更好地利用雌核发育技术于俄罗斯鲟育种提供理论指导。
1 材料与方法
1.1 实验材料
俄罗斯鲟雌核发育诱导实验于2010年5月在北京鲟鱼良种场(北京十渡名优鱼类繁育基地)进行,采用30 cm(20 cm(30 cm的玻璃钢桶进行孵化和鱼苗饲养。
1.2 雌核发育诱导
1.2.1 亲本选择 从北京鲟鱼良种场养殖的繁殖种群中选取体质健壮且性成熟的雄性达氏鳇Husodauricus和雌性俄罗斯鲟Acipensergueldenstaedtii各一尾分别作为父母本,进行催产,分别获得相应的精子和成熟的卵。
1.2.2 精子的处理 将收集的精液放在显微镜下观察精子活力,选取活力良好的精液放于4℃待用。取少量精液,用Hank’s液(氯化钠8 g,氯化钾400 mg,碳酸氢钠350 mg,七水磷酸氢二钠90 mg,十二水磷酸氢二钠100 mg,无水磷酸二氢钾60 mg,葡萄糖1 g,七水硫酸镁100 mg,六水氯化镁100 mg,氯化钙140 mg,蒸馏水加至1 000 mL,用5.6%碳酸氢钾调pH至7.5)按5∶19的比例进行稀释后置于玻璃培养皿中,将培养皿放在紫外线照射装置的水平摇床上,摇床振动频率为60次/min,轻轻振荡以使精子均匀分散。用紫外灯照射精液,从2 min 30 s开始镜检观察精子活力,直到约80%精子停止活动,确定照射时间,收集灭活精液待用做人工授精。
1.2.3 受精卵的获得和处理 使用灭活的精液与成熟的卵进行干法授精,待受精3 min后用滑石粉脱粘,将脱粘后的受精卵平铺于玻璃培养皿上,分别进行冷休克或热休克处理后,放入孵化器中使用17 ℃左右的池水进行孵化。
1.2.4 雌核发育诱导 冷休克诱导:在人工授精10 min后立即将受精卵放置于4 ℃冰箱中,进行40 min冷休克诱导,然后放回17 ℃水中继续进行孵化,编号为M1。热休克诱导:在人工授精18 min后立即将受精卵放入37 ℃水中,进行热休克处理2 min,然后放回17 ℃水中继续进行孵化,编号为M2。对照组人工授精:将余下的少部分卵与未经紫外线照射的精液混合,正常受精后移入到17 ℃池水中孵化,编号为G1。
1.3 微卫星分析
1.3.1 取样 催产成功后分别剪取各亲鱼鳍条保存于φ=95%的乙醇中。子代样本于孵化后第2天开始从各组中进行采样,冷休克组收集个体20尾、热休克组收集40尾、对照组收集20尾,分别保存于φ=95%的乙醇中,带回实验室。
1.3.2 基因组DNA的提取 剪取保存在乙醇中的亲鱼鳍条及其后代鱼苗肌肉组织大约0.2 g,分别加入400 μL裂解液,55 ℃消化过夜,待组织完全消化后取出,用酚(氯仿(异戊醇(体积比为25∶24∶1)法提取DNA。为了确保DNA样品的质量,对提取的DNA样品进行琼脂糖凝胶电泳检测和紫外分光光度计A260测定。将DNA质量浓度调至20 ng(μL,并保存于-20 ℃冰箱中备用。
1.3.3 PCR反应 本实验中使用的微卫星引物来自董颖等(未发表数据)开发的5种鲟鱼跨种扩增荧光微卫星引物。PCR扩增反应总体积为10 μL,其中包括DNA模板0.5 μL(20 ng(μL),10(PCR buffer 1 μL,25 mmol/L MgCl20.25 μL,2.5 mmol/L dNTP 0.8 μL,5 mmol/L正反向荧光引物各0.3 μL,5 U/μL Taq酶(TAKARA)0.05 μL,双蒸水7.05 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,50~61 ℃退火30 s,72 ℃延伸30 s,41个循环;72 ℃充分延伸10 min。微卫星引物序列及具体退火温度情况见表1。扩增产物用w=1.0%的琼脂糖凝胶电泳进行分离,GelRed染色后用BIORAD凝胶成成像仪进行定性分析。

表1 微卫星引物序列及特异退火温度
1.3.4 基因型分析 使用ABI PRISM 3100 型遗传分析仪(applied biosystems) 对扩增片断进行测定,并用GeneMapper3.0 软件(applied biosystems) 对基因型进行判读。
1.3.5 数据分析 根据所得到的基因型数据,利用SPAGeDi软件[24]计算微卫星基因座的等位基因数、(Number of alleles,A)、等位基因频率(Allele Frequency,P)、期望杂合度(Expected Heterozygosity,He)。并分别根据父本基因型和母本基因型分辨子代中的杂交后代、单倍体后代和雌核发育后代。
2 结 果
2.1 精子的最佳照射时间
对照组卵(俄罗斯鲟与达氏鳇杂交)的受精率与孵化率分别为95.3%和76.5%,说明俄罗斯鲟卵质量良好。用Hank’s液稀释精液(19∶5)并放在紫外灯下照射,采用镜检的方法观察精子的活动状态,照射2 min 30 s时发现绝大部分精子仍在活动;照射3 min时发现约20%精子仍在活动,但其余大部分精子不活动;照射3 min 30 s时发现几乎所有的精子都已经停止活动了。因此认为3 min的紫外线照射为最佳的照射时间,此时的精子绝大部分处于遗传失活的状态。
2.2 雌核发育诱导结果
将成活的鱼苗饲养至可以清楚观察其外形特征时,通过形态学分析发现在冷休克组和热休克组中都即存在外形符合俄罗斯鲟(达氏鳇杂交后代特征的杂交鲟,也存在与纯种俄罗斯鲟特征相吻合的雌核发育诱导后代[25]。
2.3 微卫星检测结果
选用6对具有高多态性的微卫星标记,分别对父母本亲鱼及其经过雌核发育诱导产生的后代(冷休克组20尾,热休克组40尾)进行扩增,结果6对引物均可扩增出清晰的条带,扩增片段大小在116~414 bp。
2.4 遗传变异分析
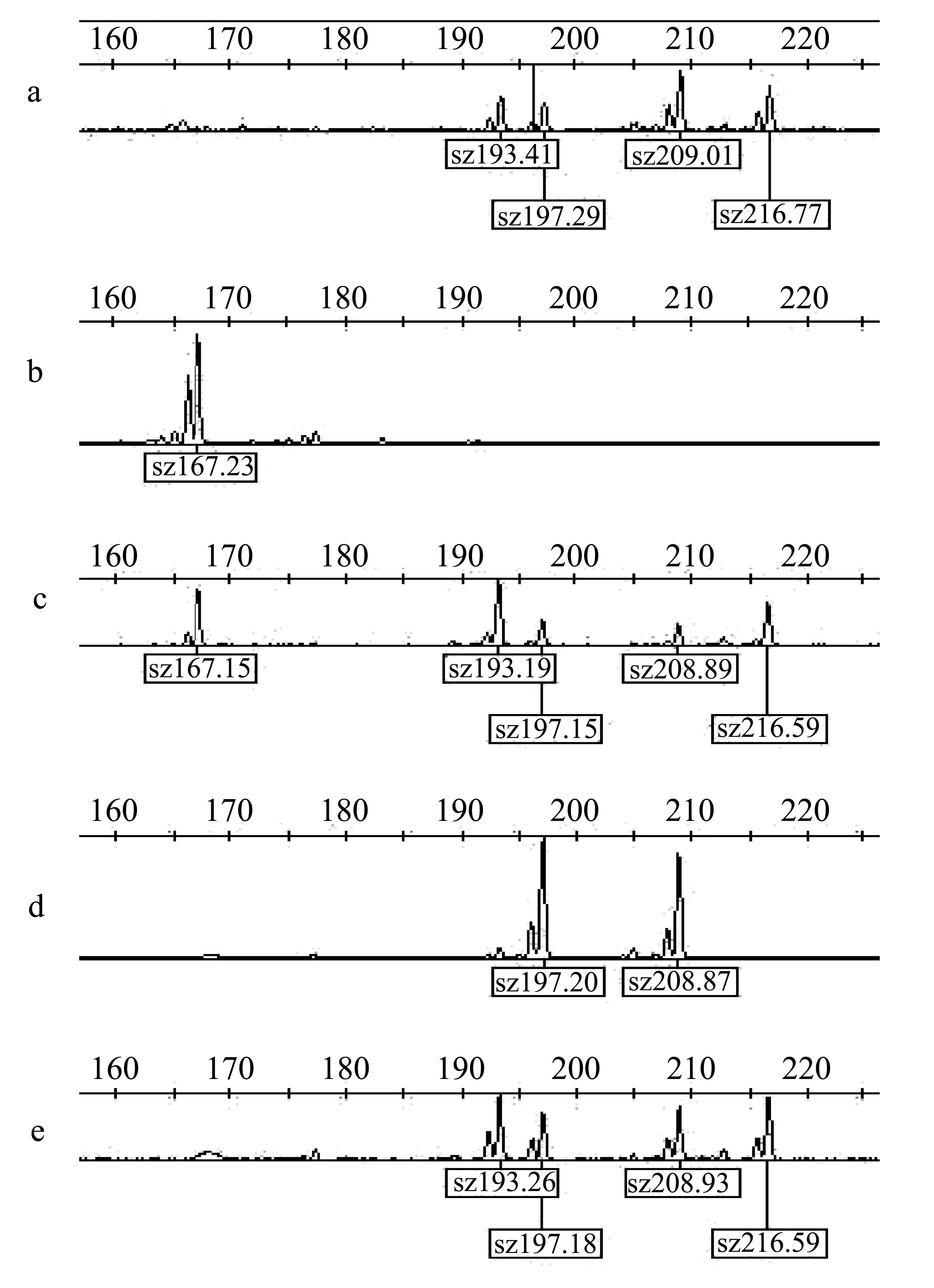
遗传杂合度(H)又称基因多样度,是指所检测到的微卫星位点上杂合子基因型占该位点所有基因型的比例。从表2的结果可以看出,所检测的等位基因座位有4~9个等位基因,各基因座位的等位基因频率由0.006~0.774不等;其中热休克雌核发育组的等位基因频率为0.006~0.774,期望杂合度的平均值为0.6873,平均多态信息含量为0.610 7,平均等位基因数5.5;冷休克雌核发育组的等位基因频率为0.001~0.708,期望杂合度平均值为0.590 6,平均多态信息含量为0.6754,平均等位基因数为6.0。Boestein等[26]认为当PIC>0.5时该位点表现为高度多态,当0.25 表2 俄罗斯鲟2个雌核发育群体6个座点的等位基因数、杂合度和多态信息含量 从图1中可以看出,在微卫星位点Afu54,母本(a)存在4个不同大小的等位基因,父本(b)为纯合体,只存在1个等位基因。以父本b的基因型为诊断标记,对所检测的样品进行鉴定,只要在样品中出现了父本b的基因型则认为该样本是杂交个体,由此可认定样本c为杂交后代。通过与父母本基因型的比对,可以区分样本d为单倍体后代,而样本e为雌核发育后代。 图1 父母本及热休克雌核发育组部分个体在位点Afu54的基因型 综合运用6对微卫星多态性标记数据,以父本特异条带作为诊断标记,对两组雌核发育后代进行鉴定,结果发现热休克雌核发育组在6个微卫星座位上,检测出11个样本含有父本基因型,因此可认定此11个样品是由杂交发育而来的(此结果与表型判断结果相吻合),杂交后代占整个热休克雌核发育组的27.5%。另外9个样品的基因型与母本的完全相同,认为这9个样本是由雌核发育而来的,是完全的雌核发育后代,占热休克雌核发育组的22.5%。还有6个样本的基因型数目在所有位点均为母本基因型数目的一半,且不含父本基因型,因此认为其为单倍体后代,占雌核发育组的15.0%。剩下的14个样本所检测的基因型出现了不同程度的重组现象,占整个雌核发育组的35.0%。 冷休克雌核发育组出现了8个样本含有父本的基因型,杂交后代占冷休克雌核发育组的40.0%。2个单倍体样本占雌核发育系的10.0%,未发现完全的雌核发育后代,出现了50.0%的重组基因型后代。 本研究中采用与俄罗斯鲟不同属的达氏鳇作为父本,用来提供精子诱导进行俄罗斯鲟雌核发育,是因为可以从外形上很明确地区分俄罗斯鲟、达氏鳇及其杂交后代,达氏鳇口裂大,可达头侧,呈半月形,且左右鳃膜相互连接;俄罗斯鲟口裂小,且鳃膜与颊部相连;而二者杂交后代的口裂大小则介于这两者之间(比达氏鳇口裂小,比俄罗斯鲟口裂大),且鳃膜与颊部仅有较小部分相连。而雌核发育后代则具有和其母本相同的外形特征,因此可以通过外形鉴定区分出杂交后代。但是仅通过外形观察尚不能区分雌核发育后代和单倍体后代,因此虽然大部分单倍体后代表现出脊柱侧弯等单倍体综合症特征而不能存活,但仍不能确定所有存活下来的后代中是否有单倍体后代。Fopp-Bayat[27]使用微卫星DNA分子标记成功辨别出西伯利亚鲟雌核发育诱导后产生的单倍体后代,本研究中也利用微卫星标记来区分单倍体和雌核发育后代,并取得了成功。但目前使用微卫星标记分辨单倍体尚具有一定的局限性,必须要先开发出多对具有一定多态性的微卫星标记,再从中选择一对在双亲中基因型不同的用来进行分析,因此此种方法不适用于多对亲本混合使用的情况。另外,对于多倍体的鲟鱼,为确保结果的准确性,最好使用多对微卫星位点综合分析。 本次实验使用的6对微卫星引物在两组雌核发育系中均能扩增出相应的目的条带,未出现无效等位基因现象。两组雌核发育中,所有位点都表现出一定的杂合性。在人工诱导鱼类雌核发育过程中,有时会因精子的遗传物质没有完全的失活,而使部分父本的雄性基因参与了遗传,因此有必要对雌核发育后代的真实性进行确认。张海发等[28]对彭泽鲫雌核发育进行了分析,发现雌核发育子代中具有与父本相同而与母本相异的特异条带。相似率为21.05%;邹桂伟等[29]比较发现雌核发育鲢含有少数与父本相同的特异DNA扩增条带,表明雌核发育鲢整入了父本雄鲤的遗传物质。本研究用6对微卫星引物对2组俄罗斯鲟的雌核发育后代进行分析,结果在M1和M2两组雌核发育系中分别检测出8尾和11尾含有父本达氏鳇中存在而母本俄罗斯鲟中并没有的父本特异DNA扩增条带,说明此样本为杂交个体,杂交率分别为40.0%和27.5%。实验中检测到杂交个体较多,是因为这两种鱼杂交后代可活,并且具有杂交优势,生存能力更强。本实验选择紫外照射后仍有20%左右活动镜子进行雌核发育诱导,可以通过增加灭活精子比例来降低杂交后代比例。 在两组雌核发育系中分别得到了不同程度的单倍体个体,分别占雌核发育组的10.0%和15.0%,由于本次实验采样是在仔鱼孵化后第2天开始的,起初所采集的样品有一部分脊椎弯曲、肢节模糊,为单倍体综合症的表现,与实验所得数据分析的结果相一致。在孵化阶段虽有少数单倍体个体存活,但活力较差,最终全部死亡。本实验雌核发育后代中单倍体个体存活时间相对较长,从初孵仔鱼到存活3~4 d,可能与本实验所选的材料母本俄罗斯鲟(n=8)是多倍性有关.本实验得到的单倍体比例明显少于邹远超等[30]在匙吻鲟雌核发育后代中单倍体的比例(33.5%以上),可能因为取样检测时期不同,他们在原肠胚期取样检测,而本实验取的是孵出仔鱼,有很多单倍体不能孵化成仔鱼,在胚胎时期就死亡了。 在对异质雌核发育后代共显性分子标记检测中一般会存在一些杂合位点,一般认为这是因卵母细胞经减数分裂时同源染色体之间发生交换引起的[33-34],有关鱼类的雌核发育群体基因重组的报道中,基因重组率的变动范围比较大。如王伟等采用筛选获得的10对高多态性的微卫星引物对牙鲆异精雌核发育进行了分析,其中7个基因座位上均发生了基因—着丝粒之间的重组,重组率在42.6%~100%之间;王晓清等[36]运用6对微卫星引物对2组大黄鱼雌核发育家系进行了微卫星标记分析,发现在G1代有3个微卫星位点上发生了基因重组,重组率为12.5%,G2代有10个座位发生了重组,重组率为41.7%;Francescon等[37]发现欧洲鲈在6个微卫星座位上发生了基因重组,重组率为40%~94%;Nagy等[38]发现鲤在9个基因座位上发生了重组,重组率为35%。本次研究的两组俄罗斯鲟雌核发育后代在6对微卫星引物中分别检测出不同程度的重组现象,重组率分别为50%和35%。重组现象出现可能是所选择的位点距着丝点较远,也可能是与实验材料的多倍性有关,当然,要获得准确的结论还需要反复的实验来验证。 本实验所获得的两组雌核发育系;热休克组中得到了22.5%的完全雌核发育个体,而冷休克中并无完全雌核发育个体,由此可见采用热休克诱导俄罗斯鲟雌核发育较冷休克相比具有明显的优势,是一个行之有效的方法。 目前有关于鲟鱼雌核发育的报道中只有西伯利亚鲟AcipenserbaeriBrandt[39]、短吻鲟A.brevirostrum[40]和杂交鲟Bester(H.husofemale×A.ruthenusmale)[41]的性别决定机制为雌性异型配子。通过雌核发育可产生3种基因型后代雌鱼为(ZW或WW型),雄鱼为(ZZ型),因雌鱼(WW型)为超雌鲟鱼,所以将其与雄性鲟鱼(ZZ型)交配可获得全雌鲟鱼。而匙吻鲟的雌核发育后代全部为雌性,说明其为同型雌性配子。至于俄罗斯鲟的性别决定机制尚未知晓。本实验得到的完全雌核发育个体的性别还需要至少2 a的饲养才能进行鉴定。总之利用雌核发育的手段来提高俄罗斯鲟品种的遗传纯度,减少个体之间的遗传变异以及全雌育种具有重要的意义。 参考文献: [1]GARDMER B G.Sturgeons as living fossils [M].New York: Springer Verlag Press,1984: 148-152. [2]BE,MIS W E,KYNARD B.Sturgeon rivers: an introduct ion to acipenseriform biogeography and life history [J].Environmental Biology of Fishes,1997,48: 167-183. [3]PIKITCH E K,DOUKAKIS P,LAUCK L,et al.Status,trends and management of sturgeon and paddlefish fisheries [J].Fish and Fisheries,2005,6: 233-265. [4]IJIRI K.Gamma-ray irradiation of the sperm of the fishOryziaslatipesand induction of gynogenesis [J].Journal of Radiation Research,1980,21: 263-270. [5]PELEGRI F,SCHULTE-MERKER S.A gynogenesis-based screen for maternal-effect genes in the zebrafish,Daniorerio[J].Methods in Cell Biology,1998,60: 1-20. [6]YAMAMOTO E.Studies on sex-manipulation and production of cloned populations in hirame,Paralichthysolivaceus(Temminck et Schlegel)[J].Aquaculture,1999,173: 235-246. [7]刘明华,白庆利,沈俊宝.德国镜鲤选育及生产应用研究[J].黑龙江水产,1995,61(3): 4-10. [8]ASHLEY M V,DOW B D.The Use of Microsatellite Analysis in population biology: Background,methods and potential applications[M]//Molecular ecology and evolution: Approaches and applications.Switzerland: Birkhäuser Verlag Basel,1994: 185-201. [9]GOFF D J,GALVIN K,KATZ H,et al.Identification of polymorphic simple sequence repeats in the genome of the zebrafish [J].Genomics,1992,14: 200-202. [10]SHIMODA N,KNAPIK E W,JOHN Z,et al.Zebrafish genetic map with 2000 microsatellite markers [J].Genomics,1999,58: 219-232. [11]CARLETON K L,STREELMAN J T ,LEE B Y,et al.Rapid isolation of CA microsatellites from the tilapia genome [J].Animal Genetics,2002,33(2): 140-144. [12]KING T L,EACKLES M S,LETCHER B H.Microsatellite DNA markers for the study of Atlantic salmon (Salmosolarr) kinship,population structure,and mixed-fishery analyses [J].Molecular Ecology Notes,2005,5(1):130-132. [13]MCGOWAN R,DAVIDSON E A,WORAM R A,et al.Ten polymorphic microsatelite markers from Arctic charr (Salvelinusalpinus): linkage analysis and amplification in other salmonids [J].Animal Genetics,2004,35(6): 479-481. [14]RODRIGUEZ F,REXROAD C E,PALTI Y.Characterization of twenty-four microsatellite markers for rainbow trout (Oncorhynchusmykiss) [J].Molecular Ecology Notes,2003,3(4): 619-622. [17]DRAUCH J,ISRAEL J.Development of mew microsatellite primers for green and white sturgeon [J].Conservation Genetics,2007,10: 12-18. [18]BRIAN L S,ROBERT J S.Microsatellite analysis of genetic variation in sturgeon: New sequences forScaphirhynchusand Acipenser [J].Fisheries Society,2000,129: 1380-1388. [21]JAME P,LAGODAP J L.Microsatellites,from molecules to populations and back [J].Trends in Ecology and Evolution,1996,11: 424-429. [22]QUELLER D C,STRASSMANN J E,HUGHES C R.Microsatellites and kinship [J].Trends in Ecology and Evolution,1993,8: 285-288. [23]O′CONNELL M,WRIGHT J M.Microsatellite DNA in fishes [J].Reviews in Fish Biology and Fisheries,1997,7: 331-363. [24]HARDY O J,VEKEMANS X.SPAGeDi: a versatile computer program to analyse spatial genetic structure at the individual or population levels [J].Molecular Ecology Notes,2002,2: 618-620. [25]胡红霞,董颖,朱华,等.应用热休克和冷休克技术进行俄罗斯鲟雌核发育初试 [J].中国水产,2010,11: 82-83. [26]BOSTIN D,WHITE R L,SKOLNICK M.Construction of a genetic linkage map in man using restriction tragment length polymorphism [J].American Journal of Hunan Genetics,1980,32: 314-331. [27]FOPP-BAYAT D.Inheritance of microsatellite loci in polyploid Siberian sturgeon (Acipenser baeri Brandt) based on uniparental haploids [J].Aquaculture Research,2008,39(16): 1787-1792. [28]张海发,陈湘麟,舒虎,等.异源精子激发彭泽鲫雌核发育产生的子一代及亲本RAPD分析 [J].应用与环境生物学报,1999,5(5): 507-511. [29]邹桂伟,潘光碧,汪登强,等.人工雌核发育鲢的遗传多样性及异源遗传物质整入的RAPD分析 [J].水生生物学报,2004,28(2): 180-185. [30]邹远超,危起伟,潘光碧,等.施氏鲟精子诱导匙吻鲟雌核发育 [J].中国水产科学,2009,16(5): 728-735. [33]TANIGUCHI N,KIJIMA A,TAMURAT,et al.Color,growth and maturation in ploidy-manipulated fancy carp [J].Aquaculture,1986,57: 321-328. [34]朱晓琛,刘海金,孙效文,等.微卫星评价牙鲆雌核发育二倍体纯合性 [J].动物学研究,2006,27(1): 63-67. [35]王伟,尤锋,高天翔,等.人工诱导牙鲆雌核发育群体的微卫星标记分析 [J].高技术通讯,2005,15(7):107-110. [36]王晓清,王志勇,柳小春,等.大黄鱼人工诱导雌核发育后代的微卫星标记分析 [J].遗传,2006,28(7): 831-837. [37]FRANCESCON A,BARBARO A,BERTOTTO D,et al.Assessment of homozygosity and fertility in meiotic gynogens of the European sea bass (DicentrachuslabraxL.) [J].Aquaculture,2005,243: 93-102. [38]NAGY A,CSANYI V.Changes of genetic parameters in successive gynogenetic generations and some calculations for carp gynogenesis [J].Theoretical and Applied Genetics,1982,63: 105-110. [39]FOPP-BAYAT D.Meiotic gyongenesis revealed not homogametic female sex determination system in Siberian sturgeon (AcipenserbaeriBrandt) [J].Aquaculture,2010,5: 4-7. [40]FLYNN S R,MATSUOKA M,REITH M,et al.Gynogenesis and sex determination in shortnose sturgeon,AcipenserbrevirostrumLesuere [J].Aquaculture,2006,253,721-727. [41]OMOTO N,MAEBAYASHI M,ADACHI S,et al.Sex ratios of triploids and gynogenetic diploids induced in the hybrid sturgeon,the bester (Husohusofemale×Acipenserruthenusmale) [J].Aquaculture,2005,245: 39-47.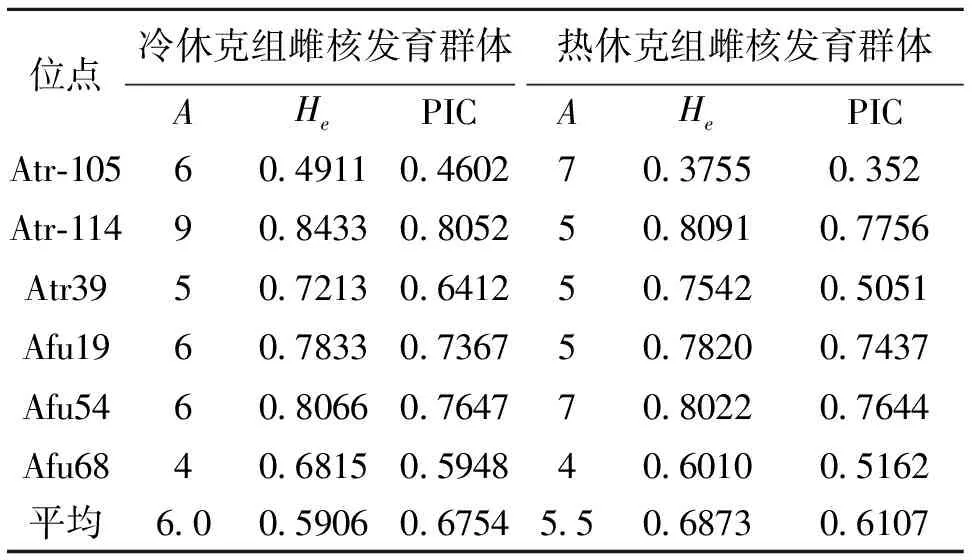
3 讨 论

