聚氨酯中心静脉导管表面接枝聚维酮碘及抗菌性能研究*
陈 翠,丁侃贤,李志云,庞来兴,祝方明
(中山大学化学与化学工程学院,广东 广州 510275)
血管内介入诊疗技术是一种借助于介入导管通过血管管腔到达体内较远的病灶处,然后注入诊疗剂实现“低创”、“少创”治疗的一种新兴医疗技术[1]。血管内介入导管是血管内介入技术的主要器械之一,理想介入导管应具有以下特点:①优良的血液相容性;②优良的可操作性,包括扭矩传导性和抗扭结性;③适当的柔软性和良好的润滑性。与聚乙烯(PE)、聚氯乙烯(PVC)等其他材料相比,医用聚氨酯(PU)具有优异的力学性能和一定的生物相容性,基本能满足这些要求,是制作介入导管等血液接触装置的理想材料[2]。随着现代诊疗技术的提高,中心静脉导管植入已经成为临床上救治重危患者的一种常规手段。但是,中心静脉导管植入也带来了各种并发症。其中,引发凝血和感染一直是困扰医务人员的一个棘手问题,因此,其表面抗凝血和抗感染的修饰改性已成为该领域的研究热点。
文献调研结果表明,中心静脉导管表面抗感染改性的方法主要有三种:①在导管表面浸渍或涂覆抗生素或杀菌剂[3-4];②基体材料中添加抗菌剂,通过共混将抗菌物质直接加入到高分子材料中[5];③通过化学键将抗菌基团接枝在基体材料上或者将抗菌剂嵌入基体材料使材料本身具有抗菌效果[6]。方法①中抗菌物质通过物理方法附着在导管表面,在使用过程中容易脱落,抗菌性能常与预期的理想效果有差距;方法②存在无机抗菌剂易变色、有机抗菌剂易挥发和释放毒性、破坏基体材料结构和性能等问题,而且共混的方法虽然能将抗菌物质均匀地分散在导管基材中,但所得改性导管表面的抗菌物质浓度相对较低,导管的抗感染高效性和有效期受限制;而方法③,接枝改性或嵌入抗菌基团后的导管在保留基体材料原有的性能外,具有良好的抗菌性能。
本文采用紫外光接枝技术,将聚乙烯基吡咯烷酮(聚维酮,PVP)接枝在聚氨酯中心静脉导管(PU)表面,然后与碘络合,得到表面接枝聚维酮碘(PVP-I)的改性导管。Heiden等[7]通过紫外光辐照,处理聚醚型聚氨酯表面,再将带有磷酸胆碱基的化合物接枝在表面,得到的聚氨酯材料对血小板的黏附作用明显降低,血液相容性也得到了提高。Hsu等[8]将聚氨酯在四氢呋喃中溶解后用氩气等离子气处理,再浸入左旋丙交酯溶液中反应,得到的改性薄膜表面接枝有左旋丙交酯,对血小板的黏附有较大幅度的减小。本文通过紫外光接枝,在聚氨酯中心静脉导管材料表面接枝高亲水性高分子PVP,改善材料表面的润滑性。而PVP-I与碘酒具有同等的杀菌消毒效果,而且没有对生物体的刺激性和其他副作用[9]。该方法不但提高导管的润滑性和抗感染性,同时也能降低蛋白介导的细菌在材料表面的粘附,全面改善导管的抗感染性能[10]。
1 实验部分
1.1 试剂与仪器
N-乙烯基吡咯烷酮(NVP,上海晶纯试剂有限公司)、Irgacure 907(瑞士Ciba公司)、无水乙醇(国药集团化学试剂有限公司)、n-庚烷(φ>97.0%,国药集团化学试剂有限公司)、碘(天津市东丽区天大化学试剂厂)、氯化钠(天津市光复科技发展有限公司)为分析纯;二苯甲酮(BP,国药集团化学试剂有限公司)为化学纯;细菌学蛋白胨(广东环凯微生物科技有限公司),牛肉浸膏(广东环凯微生物科技有限公司);大肠杆菌(D)、白色葡萄球菌(B)、金黄色葡萄球菌(J)、蜡样芽孢杆菌(L)的菌悬液,由中山大学有机化学研究所化学生物学实验室提供;聚氨酯中心静脉导管,由珠海福尼亚医疗设备有限公司提供。
紫外光谱灯(光源波长为365 nm);单孔电热恒温水浴锅;分析天平;不锈钢手提式高压蒸汽灭菌器;恒温振荡器(IS-RDV1);双光束紫外可见分光光度计(TU-190)。红外光谱仪(Nicolet 205 FTIR)。
1.2 聚氨酯中心静脉导管表面紫外光辐照接枝PVP
取一定长度的聚氨酯中心静脉导管将其两端封口,在体积比为1∶1的乙醇和超纯水的混合液中超声洗涤2 h后,真空干燥至恒质量。将聚氨酯中心静脉导管置入含有引发剂Irgacure 907和光敏剂二苯甲酮的不同浓度的NVP的乙醇溶液中浸泡约2 min,然后取出在氮气氛围中紫外光均匀辐照20 min,冷却后在65 ℃的水浴中纯水浸泡24 h,其间换水6~8次,真空干燥至恒质量,计算每组聚氨酯中心静脉导管表面的接枝率。
1.3 聚氨酯中心静脉导管表面接枝PVP-I
将表面接枝PVP的聚氨酯中心静脉导管置入盛有0.01 g/mL碘的φ=95%的乙醇溶液中络合,每组分成4小组,各浸泡5、10、15、20 min后,取出晾干,在n-庚烷中浸泡24 h除去表面没有络合上的游离碘,真空干燥后密封保存。
1.4 抗菌性能测试
1.4.1 培养基的制备 参照文献[11],制备牛肉膏蛋白胨液体培养基,调节pH在7.2~7.5范围内,分装在小试管中,每支2 mL,用棉塞塞好,高压蒸汽灭菌后冷却备用。
1.4.2 接种培养 将一定长度表面接枝聚维酮碘的聚氨酯中心静脉导管剪切后添加到灭菌后的液体培养基中,培养基分别添加2 μL大肠杆菌、白色葡萄球菌、金黄色葡萄球菌和蜡样芽孢杆菌的菌悬液,每组实验平行三次。设置空白试验,即:灭菌后的培养基(KK组),培养基灭菌后分别接种2 μL大肠杆菌(KD组)、白色葡萄球菌(KB组)、金黄色葡萄球菌(KJ组)和蜡样芽孢杆菌(KL组)的菌悬液。用棉塞塞好试管口,置于恒温振荡器中37 ℃下恒温培养16~18 h。
采用双光束紫外可见分光光度计测定每个培养基的浊度,并用Origin等软件分析所得的数据,绘制抗菌性能曲线。
2 结果与讨论
反应机理中分光接枝过程和络合过程。
光接枝过程分为链引发、链增长和链终止3步。
链引发:
(1)光敏剂在紫外光照射后将获得的能量转移到本体材料PU上;

(2)引发剂在紫外光照射后断裂形成初级自由基引发单体聚合。

这里X─Y是指引发剂,X·和Y·指引发剂断裂后生成的初级自由基。


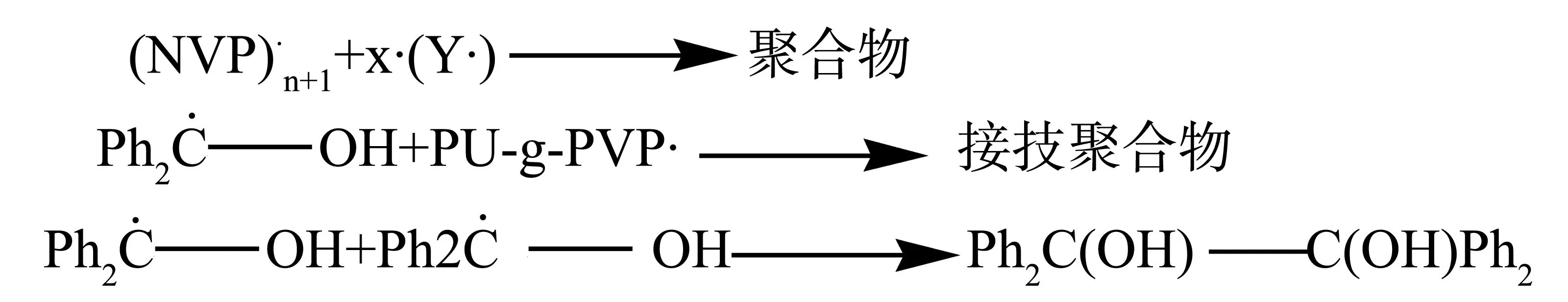
络合过程:PU-g-PVP+I2→ PU-g-PVP-I2
反应过程图见图1。

图1 反应过程示意图
2.1 聚氨酯中心静脉导管表面接枝PVP
采用FTIR表面全反射光谱对聚氨酯中心静脉导管表面接枝PVP前后的结构进行了比较,如图2所示。聚氨酯中心静脉导管表面的红外谱图在1 300~1 050 cm-1处有两个酯基C-O伸缩振动吸收峰,在1 735 cm-1处有酯基中羰基强的伸缩振动吸收峰,在1 550~1 530 cm-1区域有N-H弯曲振动吸收峰。而PVP为含有-CON-基团的高分子,红外谱图中在1 673 cm-1处有强的反射峰,在1 270 cm-1处有C-N键伸缩振动峰。

图2 接枝前后聚氨酯中心静脉导管的FTIR表面全反射光谱
将接枝前聚氨酯中心静脉导管(PU)和表面接枝PVP后的导管表面(PU- PVP)的全反射谱图进行比较,发现后者在1 290 cm-1和1 660 cm-1处新增了较强的吸收峰。由此证明,在聚氨酯中心静脉导管表面已接枝上PVP分子链。
2.2 聚氨酯中心静脉导管表面接枝PVP-I
表1为NVP浓度和与碘络合时间对聚氨酯中心静脉导管表面紫外光辐照接枝PVP的接枝率和络合碘的量的影响结果。
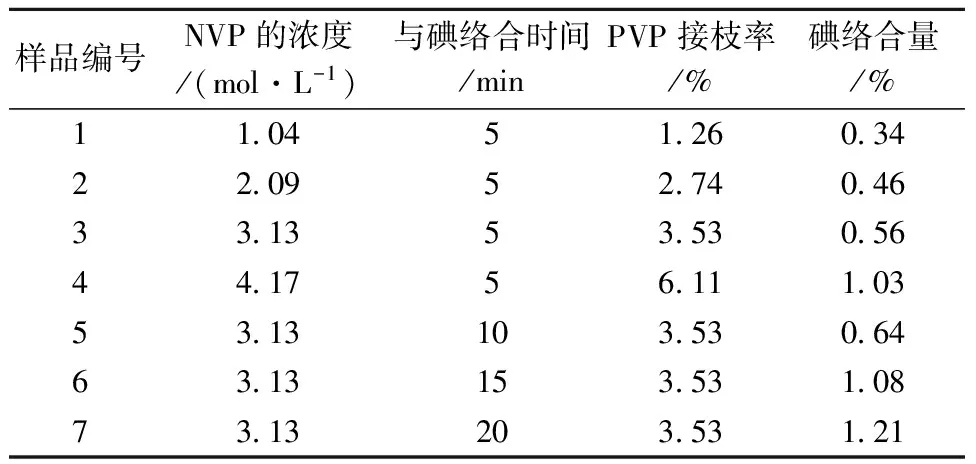
表1 NVP的浓度对PVP接枝率和与碘络合量的影响


表1所示,NVP浓度增大,PVP的接枝率几乎随之呈正比例增大。接枝后的聚氨酯中心静脉导管表面变得更光滑、更有光泽,表明PVP已经成功并均匀地接枝在导管表面。此处不再对更大浓度的NVP溶液下导管表面PVP的接枝率进行研究,是考虑到较大浓度的NVP溶液可能会对导管表面的结构产生影响。随着PVP接枝率的增大,碘的络合量增大。这是因为接枝率较大时PVP分子链上碘的络合点较多,形成的PVP-I也较多。随着与碘络合时间的增长,PVP接枝率相同的导管表面碘的络合量增大,但这种络合作用会随着时间的延长达到饱和,表1中络合时间从10 min增至15 min时,碘的络合量增大幅度较大,但从15 min增至20 min时,碘的络合量增幅较小,络合反应趋于平衡。
2.3 抗菌性能研究
2.3.1 PVP接枝率和与碘络合时间对改性导管抗菌性能的影响 图3所示为表1中编号为1、2、3、4的样品对大肠杆菌的抗菌性能曲线。其中,纵坐标表示液体培养基的紫外吸收值,对应培养基的浊度值,浊度越靠近KK组浊度水平,抗菌性能越明显。(也适用于后文中抗菌性能曲线图)

图3 PVP接枝率对改性导管的抗菌性能曲线的影响
如图所示,4种不同接枝率的改性导管都有一定的抗菌能力,曲线1和2在培养基中的导管长度增大到5 cm后才有明显的下滑趋势,但曲线3和4随着导管长度的增加下滑趋势比较陡峭,且曲线4最先达到KK组的浊度水平。上述结果表明,随着接枝率增大,改性导管的抗菌性能增强,且接枝率为6.11%的改性导管具有最优越的抗菌效果。
3、5、6、7号样品为PVP接枝率相同、与碘络合时间不同的条件下所得的改性导管,其抗菌性能曲线如图4所示:
图4中,随着改性导管长度增加,4条曲线均在下滑,即4个样品的培养基浊度都在减小,长度增大到某一值后,曲线变得平缓,即浊度减小至KK组水平并保持稳定。其中,与碘络合时间为15 min的改性导管的抗菌性能曲线下滑趋势最为陡峭,对应样品培养基的浊度值减小得最快,抗菌性能最为强效。

图4 与碘络合时间对抗菌性能曲线的影响
2.3.2 有效期 将在4种不同PVP接枝率、与碘络合时间均为15 min条件下的改性导管在相同条件下干燥保存,分别在放置2、7、15、30、45、60、68 d后对大肠杆菌做抗菌性能测试,总结抗菌有效期,结果列表2。

表2 改性导管抗菌有效期
测试结果表明,改性导管的抗菌有效期随着接枝率的增大而延长,这是因为接枝率较大的聚氨酯中心静脉导管表面有较多的PVP-I,而且PVP这种亲水性极强的分子链大大地提高了材料表面的润滑性,减少了细菌在导管表面滞留和增殖的可能。
2.3.3 广谱性 图5中(a)、(b)、(c)、(d)分别为表1中6号样品对大肠杆菌、白色葡萄球菌、金黄色葡萄球菌和蜡样芽孢杆菌的抗菌性能曲线图。由图知,PVP-I改性导管对4种菌都呈现出比较明显的抗菌性能,并且随着改性导管长度的增加,抗菌效果愈加明显;当改性导管的长度达到2.0 cm后,所测大肠杆菌、金黄色葡萄球菌、蜡样芽孢杆菌培养液的浊度骤然降至接近于KK组的水平;PVP-I改性导管在长度为0.5 cm时便达到了对白色葡萄球菌的稳定强效抗菌性能。上述结果表明,PVP-I改性聚氨酯中心静脉导管具有广谱抗菌性能。

图5 改性导管对不同菌种的抗菌性能曲线
3 结 论
本文通过优化接枝条件,得到接枝率不同的PVP-I改性聚氨酯中心静脉导管。表面接枝PVP-I改性导管对大肠杆菌、金黄色葡萄球菌、白色葡萄球菌、蜡样芽孢杆菌都有明显的抗菌能力,体现了改性导管的广谱抗菌性。通过对改性导管抗菌性能的测定总结出,在所研究范围内,PVP接枝率的越大,PVP-I改性导管的抗菌性能越好。
参考文献:
[1]武衡,王翔.介入导管的表面改性研究进展 [J].科技资讯,2010 (10):12-13.
[2]周雪锋,江筱莉,顾宁.医用聚氨酯表面功能化与血液相容性 [J].化工学报,2009,60(06):1341-1343.
[3]BASAK P,ADHIKARI B,BANERJEE I.Sustained release of antibiotic from polyurethane coated implant materials [J].J Mater Sci Mater Med,2009,20(5B):S213-S221.
[4]程莉萍,胡英,郑昌琼,等.聚氨酯抗菌创伤敷料的制备及其灭菌效果的研究 [J].生物医学工程研究,2004,23(4):240-243.
[5]SIMMONS A,PADSALGIKAR A D,FERRIS L M.Biostability and biological performance of a PDMS-based polyurethane for controlled drug release [J].Biomaterials,2008,29(20): 2987-2995.
[6]温志国,董声雄,李春艳.聚氨酯抗菌生物材料的研究进展 [J].化工新型材料,2010,38(11):24-26.
[7]VANNDER HEIDEN A P,WILLEMS G M,LINDHOUT T,et al.Adsorption of proteins onto poly(ether urethane) with a phosphorylcholine moiety and influence of preadsorbed phosphplipid[J].J Biomed Mater Res,1998,40(2): 195.
[8]HSU S H,CHEN W C.Improved cell adhesion by plasma-induced grafting ofL-lactide onto polyurethane surface[J].Biomaterials,2000,21(4): 359-367.
[9]崔英德,易国斌,廖列文.聚乙烯基吡咯烷酮的合成与应用 [M].北京:科学出版社,2001:161.
[10]FUJIMOTO K J,TADOKORO H,UEDA Y.Polyurethane surface modification by graft polymerization of acrylamide for reduced protein adsorption and platelet adhesion [J].Biomaterials,1993,14 (6): 442-448.
[11]蔡信之,黄军红.微生物学 [M].北京:高等教育出版社,2002: 394-395.

