海洋微生物来源的α-葡萄糖苷酶抑制剂的筛选及性质研究
倪孟祥,马丽娜
(中国药科大学生命科学与技术学院微生物制药教研室,江苏 南京 210009)
糖尿病是严重威胁着人类健康的重大疾病之一,可分为Ⅰ型糖尿病和Ⅱ型糖尿病,其中Ⅱ型糖尿病占90%以上[1]。目前针对Ⅱ型糖尿病的口服降糖药主要有以下四类:磺酰脲类、双胍类、α-葡萄糖苷酶抑制剂类及噻唑烷二酮类,其中α-葡萄糖苷酶抑制剂作为一类有效的口服降糖药受到广泛关注。
α-葡萄糖苷酶抑制剂通过抑制人体小肠上皮绒毛膜刷状缘上α-葡萄糖苷酶的活性,减少食物中碳水化合物的消化,延缓葡萄糖的生成和吸收,从而达到降低餐后高血糖、减少其并发症发生的目的[2]。目前临床上使用的α-葡萄糖苷酶抑制剂(如阿卡波糖、伏格列波糖等)均采用化学与生物相结合的方法制备,价格昂贵且存在不良反应,因此微生物来源的α-葡萄糖苷酶抑制剂成为研究热点[3]。
作者在此建立了α-葡萄糖苷酶抑制剂的体外筛选模型,并且从5株海洋极地放线菌和5株海洋极地细菌中筛选出6株具有α-葡萄糖苷酶抑制活性的菌株,其中菌株N-1的抑制活性较强,并对菌株N-1进行了进一步研究。
1 实验
1.1 菌株及试剂
海洋极地放线菌5株(N-1、BM-22、BM-11、F-1-2、FM-5)及海洋极地细菌5株(T-2-2-1、T-1-3-Y2、T-1-1-2、T0-2-5、T0-2-1),自行保存。其中菌株N-1初步鉴定为生金链霉菌[4]。
α-葡萄糖苷酶(α-Glucosidase,EC 3.2.1.20)、4-硝基苯-α-D-吡喃葡萄糖苷(PNPG),Sigma公司;牛血清白蛋白(BSA);阿卡波糖,Bayer;其它试剂均为分析纯。
α-葡萄糖苷酶液:将α-葡萄糖苷酶冻干粉用pH值6.8的0.1 mol·L-1含0.2% BSA的磷酸盐缓冲溶液配制成溶液,分装,-20 ℃保存。
底物:将PNPG用pH值6.8的0.1 mol·L-1磷酸盐缓冲溶液配制成10 mmol·L-1的工作液,分装,-20 ℃保存。
阿卡波糖溶液:将一片阿卡波糖(含阿卡波糖50 mg)溶解于pH值6.8的0.1 mol·L-1磷酸盐缓冲溶液中,用容量瓶定容至50 mL,超声溶解,用0.22 μm滤膜过滤,室温保存。
1.2 培养基
斜面菌种培养基(g):可溶性淀粉20,NaCl 0.5,KNO31,K2HPO40.5,MgSO4·7H2O 0.5,FeSO40.01,海盐20,琼脂20,自来水1000 mL,pH值6.8~7.2。
种子培养基(g):酵母提取物0.25,葡萄糖0.5,可溶性淀粉2,蛋白胨2.5,海盐2,CaCO30.1,自来水100 mL,pH值6.8~7.2。
发酵培养基:60 g黄豆沸水煮2 h,取上清,添加酵母提取物2.5 g、可溶性淀粉20 g、海盐20 g、CaCO31 g,用自来水补足1000 mL,pH值6.8。
1.3 方法
1.3.1 菌株培养及摇瓶发酵
将纯化菌株接种于斜面菌种培养基中,28 ℃恒温培养2~3 d,直至灰白色的孢子形成;琼脂挖块于无菌试管中,用无菌生理盐水吹打均匀,形成孢子悬液。将孢子悬液以1%接种量接种于装有100 mL种子培养基的500 mL锥形瓶中,于28 ℃、200 r·min-1摇床培养72 h作为种子液。将种子液以5%的接种量接种于装有200 mL发酵培养基的1000 mL锥形瓶中,于28 ℃、200 r·min-1摇床培养48 h,得到发酵液。将发酵液用低温高速离心机10 000 r·min-1离心20 min,取上清用布氏漏斗抽滤,得到澄清发酵液,4 ℃冰箱保存。
1.3.2 样品液的制备
将2 L新鲜的发酵液用8层纱布过滤除去菌体,于4500 r·min-1、4 ℃离心20 min,上层发酵液用布氏漏斗抽滤,得到澄清发酵液。以预处理的大孔树脂XAD-7HP吸附,先用蒸馏水洗涤至无氯离子等无机盐离子,再依次用6~8倍柱体积的20%、40%、60%、80%的甲醇溶液进行梯度洗脱,收集洗脱液,测定不同洗脱组分的活性,并减压浓缩成干粉,得到除去无机盐、部分色素的粗提物粉末,将粗提物粉末用DMSO配制成0.1 mg·mL-1的溶液,即得样品液。
1.3.3α-葡萄糖苷酶抑制剂筛选模型的建立及应用
1.3.3.1α-葡萄糖苷酶抑制剂活性测定[5]
以PNPG为底物、0.2 mol·L-1Na2CO3为终止液,405 nm比色测定。
酶活力单位定义为:在37 ℃、pH值6.8的条件下,1 min内水解PNPG释放1 mol对硝基苯酚(PNP)所需的酶量。
抑制剂活力单位定义为:在相同的条件下降低1个酶活力单位所需的抑制剂量。
1.3.3.2 筛选模型的建立
采用PNPG法[6](略有改动)。PNPG法的原理是:由于α-葡萄糖苷酶催化水解PNPG释放出的PNP在405 nm处有一定的吸光度,因此,可通过检测PNP的量来测定α-葡萄糖苷酶活性的变化,从而筛选出对α-葡萄糖苷酶有抑制作用的活性物质。
取α-葡萄糖苷酶液40 μL,加入样品液200 μL(pH值6.8)、pH值6.8的磷酸盐缓冲溶液600 μL,37 ℃水浴保温10 min;然后加入50 μL PNPG溶液,37 ℃水浴反应20 min;再加入800 μL 0.2 mol·L-1的Na2CO3溶液终止反应,在405 nm处测定吸光度(An)。以磷酸盐缓冲溶液代替酶液作为阴性对照;以磷酸盐缓冲溶液代替样品液作为空白对照;以200 μL 1 mg·mL-1的阿卡波糖溶液代替样品液作为阳性对照。按下式计算样品液对α-葡萄糖苷酶的抑制率(I):
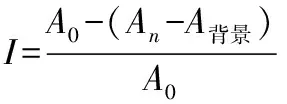
式中:An为加入样品液反应后的吸光度;A0为未加样品液反应后的吸光度;A背景为只加样品液的吸光度。
为检验是否存在假阳性:在同等浓度的PNPG中加入样品液保温20 min,测试405 nm处吸光度的变化情况。结果发现,加样前后吸光度无明显变化,表明样品液中不存在与PNPG反应的物质。
1.3.3.3 筛选模型的有效性验证
以阿卡波糖为阳性对照,检验筛选模型的有效性。具体过程为:通过对底物浓度、酶浓度、反应时间的研究最终建立较为规范的筛选模型;在该筛选模型下,通过测定不同浓度(0.2 mg·mL-1、0.5 mg·mL-1、1.0 mg·mL-1、1.5 mg·mL-1、2.0 mg·mL-1)的阿卡波糖对α-葡萄糖苷酶的抑制效果(重复3次,每组3个平行,取平均值),以阿卡波糖浓度为横坐标、抑制率为纵坐标,绘制抑制活性曲线,以检验筛选模型的有效性。
1.3.3.4 菌株N-1筛选模型的应用
以5株海洋极地细菌和5株海洋极地放线菌为筛选对象,利用建立的筛选模型进行筛选,依据筛选结果选取对α-葡萄糖苷酶的抑制作用最强的菌株进行后续实验。
1.3.4 菌株N-1的抑制动力学实验
1.3.4.1 保温时间对抑制活性的影响
在5支试管中分别加入40 μLα-葡萄糖苷酶和200 μL N-1样品液,在37 ℃水浴中分别保温5 min、10 min、15 min、20 min、30 min,然后加入50 μL PNPG,反应20 min后测定其对α-葡萄糖苷酶的抑制率。
1.3.4.2 温度对抑制活性的影响
将N-1样品液分别置于30~100 ℃的水浴中,60 min后冷却至室温,测定其对α-葡萄糖苷酶的抑制率。
1.3.4.3 样品液浓度对抑制活性的影响
将N-1样品液浓度(mg·mL-1)分别稀释到0.10、0.08、0.06、0.04、0.02、0.01,测定其对α-葡萄糖苷酶的抑制率。
1.3.4.4 pH值对抑制活性的影响
取14支试管分别用HCl或NaOH调N-1样品液的pH值为1~14(梯度为1),置沸水浴中60 min,冷却至室温,调pH值为7,测定其对α-葡萄糖苷酶的抑制率。
1.3.4.5 N-1样品液与阿卡波糖的抑制活性比较实验
将N-1样品液与1 mg·mL-1阿卡波糖分别稀释至原浓度的0.1倍、0.2倍、0.4倍、0.6倍、0.8倍,测定其对α-葡萄糖苷酶的抑制率。
1.3.5 活性物质的极性及成分分析
取N-1发酵液10 mL,调pH值为7,分别用等体积的乙酸乙酯、石油醚、二氯甲烷萃取,充分振荡、静置分层,将有机溶剂蒸干后,用DMSO溶解,测各样品的活性。结果发现,用乙酸乙酯萃取的样品活性最大,达到原发酵液的80%。因此,以乙酸乙酯萃取产物为样本进行以下成分鉴定实验。
蛋白质检测:取样品液1 mL于试管中,加入适量双缩脲试剂,摇匀,加热至沸腾,冷却后观察颜色变化。如果显紫红色,表明可能存在蛋白质和肽类。
氨基酸检测:取样品液1 mL于试管中,滴加数滴0.2%茚三酮溶液,加热至沸腾,冷却后观察颜色变化。如果显蓝紫色,表明含有氨基酸。
糖类检测(Molish试验):取样品液1 mL于试管中,加入α-萘酚试剂数滴,再沿试管壁滴加少量浓硫酸。如果样品液于浓硫酸接触面产生紫红色环, 表明可能存在糖类、苷类或其它还原性物质。
皂苷检测:取样品乙醇提取液蒸去乙醇后的残渣溶于0.5 mL醋酐中,滴加1滴浓硫酸。如果显紫红色且溶液上层逐渐变绿,表明含有甾体三萜类和皂苷物质。
2 结果与讨论
2.1 筛选模型的有效性验证结果
通过建立的筛选模型,测定了不同浓度的阿卡波糖对α-葡萄糖苷酶的抑制率,结果见图1。

图1 阿卡波糖的抑制活性曲线
由图1可看出,该模型能灵敏地监测到0.2 mg·mL-1以上浓度的阿卡波糖对α-葡萄糖苷酶的抑制活性,说明该筛选模型有较高的可行性。
2.2 海洋微生物发酵液中α-葡萄糖苷酶抑制剂筛选结果(表1)
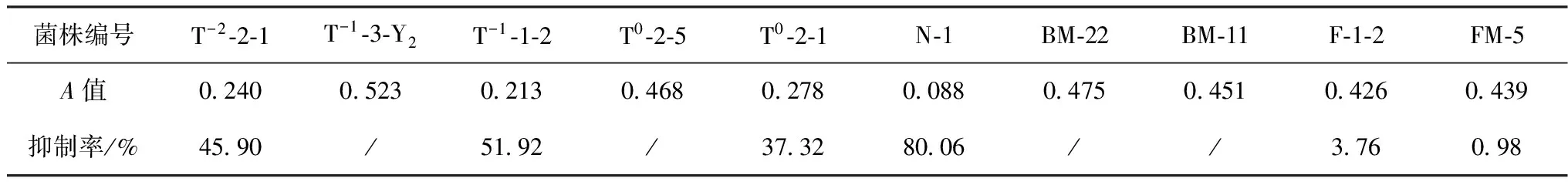
表1 10株海洋微生物发酵液中α-葡萄糖苷酶抑制剂筛选结果
由表1可知,共有6株菌株的代谢产物有不同程度的α-葡萄糖苷酶抑制活性,其中菌株N-1的代谢产物的抑制活性最强,因此选取其进行后续研究。
2.3 保温时间对抑制率的影响(图2)
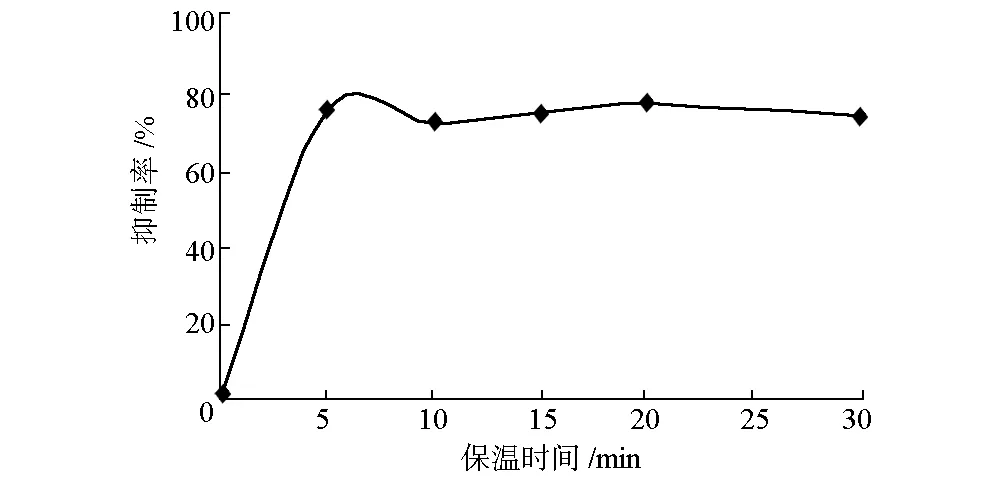
图2 保温时间对抑制率的影响
由图2可知,样品液对α-葡萄糖苷酶的抑制作用非常迅速,当保温时间为5 min时,对α-葡萄糖苷酶的抑制率达到74%;继续延长保温时间,抑制率基本保持在70%以上。表明样品液对α-葡萄糖苷酶有很高的亲和性,是一种活性很强的α-葡萄糖苷酶抑制剂。
2.4 温度对抑制率的影响(图3)

图3 温度对抑制率的影响
由图3可知,温度对抑制率有一定的影响。当温度超过40 ℃后,样品液对α-葡萄糖苷酶的抑制率开始下降;当温度为50 ℃时,抑制率下降10%;继续升高温度,抑制率变化不大。表明50~100 ℃时,样品液对α-葡萄糖苷酶的抑制活性较稳定。
2.5 样品液浓度对抑制率的影响(图4)
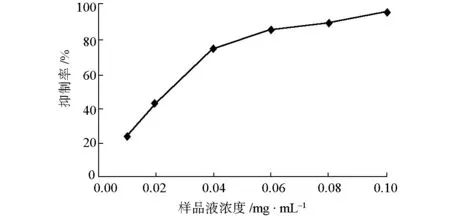
图4 样品液浓度对抑制率的影响
由图4可知,随着样品液浓度的增大,其对α-葡萄糖苷酶的抑制率不断上升;当浓度达到0.10 mg·mL-1时,抑制率为95.79%。表明样品液对α-葡萄糖苷酶有很强的抑制活性。
2.6 pH值对抑制率的影响(图5)
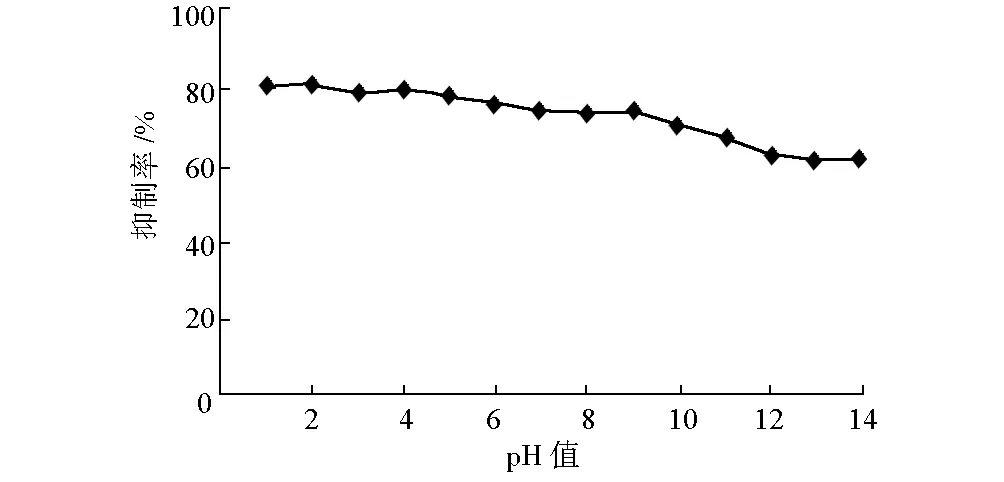
图5 pH值对抑制率的影响
由图5可知,样品液对α-葡萄糖苷酶的抑制率随pH值的增大缓慢下降。说明样品液对α-葡萄糖苷酶的抑制效果稳定,在pH值为1~14范围内稳定性良好。
2.7 N-1样品液与阿卡波糖的抑制活性比较
将N-1样品液与1 mg·mL-1阿卡波糖分别稀释后,测定其对α-葡萄糖苷酶的抑制活性,以抑制率为50%左右为合适的稀释倍数,结果见图6。

图6 N-1样品液与阿卡波糖的抑制活性比较
由图6可知,稀释0.2倍的N-1样品液对α-葡萄糖苷酶的抑制率为43.77%,1 mg·mL-1的阿卡波糖对α-葡萄糖苷酶的抑制率约为45.07%,那么,可计算出:每毫升N-1样品液对α-葡萄糖苷酶的抑制活性约相当于5 mg[(1/0.2)×1 mg·mL-1]的阿卡波糖对α-葡萄糖苷酶的抑制活性。
2.8 活性物质的极性及成分分析
有机溶剂萃取结果表明,乙酸乙酯的萃取效果最好,萃取率达到80%。萃取物经双缩脲试验、茚三酮试验、检测糖类和皂苷类的试验结果均为阴性,表明活性物质并非蛋白质、氨基酸、糖类、甾体三萜类及皂苷类,具体成分还有待进一步分析。
3 结论
建立了α-葡萄糖苷酶抑制剂的体外筛选模型。以其对10株海洋微生物进行筛选,发现有6株菌株的代谢产物均具有不同程度的α-葡萄糖苷酶抑制作用,其中菌株N-1的代谢产物对α-葡萄糖苷酶的抑制作用最强,每毫升N-1样品液的活性代谢产物对α-葡萄糖苷酶的抑制作用相当于5 mg阿卡波糖的抑制作用;该活性产物具有较强的酸碱耐受性及温度耐受性,在pH值1~14、50~100 ℃时稳定性较好;初步分析活性产物的成分并非蛋白质、氨基酸、糖类及皂苷类物质。
参考文献:
[1] Gunawan-Puteri M D P T,Kawabata J.Novelα-glucosidase inhibitors fromMacarangatanariusleaves[J].Food Chemistry,2010,123(2):384-389.
[2] 李宪璀,范晓,韩丽君,等.海藻提取物中α-葡萄糖苷酶抑制剂的初步筛选[J].中国海洋药物,2002,21(2):8-11.
[3] 顾觉奋,陈紫娟.α-葡萄糖苷酶抑制剂的研究及应用[J].药学进展,2009,33(2):62-67.
[4] 倪孟祥,田静.南极放线菌菌株N-1抗菌活性物质的初步研究及其菌种鉴定[J].药物生物技术,2011,18(5):403-406.
[5] 李英,沈忠明,杨万山,等.α-葡萄糖苷酶抑制剂的分离纯化及其性质研究[J].天然产物研究与开发,2000,12(4):24-26.
[6] Chapdelaine P,Tremblay R R,Dubé J Y.p-Nitrophenol-α-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J].J Clin Chem,1978,24(2):208-211.

