RAW264.7细胞与脂类代谢关系的研究进展
赵丽丽,田庆龙,冯毅凡
(广东药学院中心实验室,广东 广州 510006)
脂类物质是生物体的能量提供者,参与了大量的生命活动,具有非常重要的生理功能,包括维持细胞膜结构、能量储藏、信号转导和载体等[1]。美国国立卫生研究院(NIH)2003年资助的“脂质代谢途径研究计划”(Lipid metabolites and pathways strategy,LIPID MAPS)项目提出的脂质分类系统(The LIPID MAPS lipid classification system),将脂质大体分为8大类,见表1[2]。
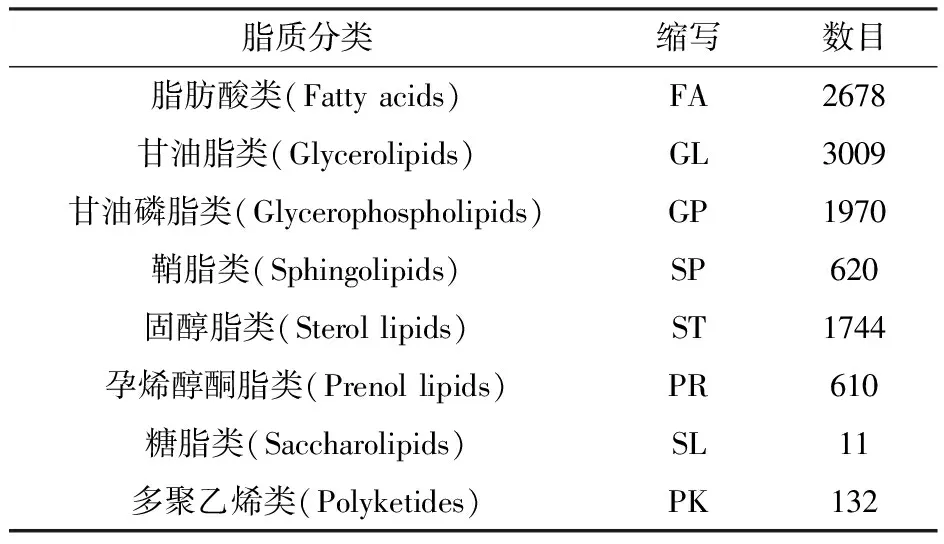
表1 脂质的分类、缩写及数据库中收录的数目
由于脂类分子具有多种生物功能,脂类代谢网络的紊乱可引起多种疾病的发生,如动脉粥样硬化[3]、冠心病[4]、阿尔茨海默病(Alzheimer′s disease)[5]、肥胖病[6]、脑损伤[7]、癌症[8]、疼痛和炎症[9]、糖尿病[10]等。测定脂类分子组成的改变、含量水平的变化、空间异质性和代谢转换(Metabolic turnover)有助于解释疾病中脂质的作用。
1 RAW264.7细胞与脂类物质的关系
1.1 RAW264.7细胞中脂类物质的含量
与其它哺乳细胞一样,作为生命的基本单位,RAW264.7细胞中包含着众多细胞器,每个细胞器都有其特定的功能。每个亚细胞膜上都存在着如细胞膜小凹和脂筏等微区域,共同调控着细胞的结构。哺乳细胞膜是由蛋白质和脂质分子组成的,其中蛋白质占膜质量的70%,其余为脂质分子。在多数哺乳细胞中,甘油磷脂类约占整个脂类分子的60%(以物质的量计),糖脂类和神经鞘脂类约占整个脂类分子的10%,非极性脂(包括甘油三酯和胆固醇)在不同细胞类型和亚细胞间隔中分布范围为0.1%~40%,类脂代谢物(如游离脂肪酸、溶血磷脂、甘油二酯、神经酰胺等)占整个脂类分子的比例不到5%,但它们在机体病变条件下能够聚集并产生有害的病理特征。数以千计的脂质分子组成了生物膜脂双层[11]。研究表明,哺乳动物细胞含有1000~2000种脂质,而且随着新技术、新方法的不断发展,各种新的脂质分子还在不断地被发现[12]。
1.2 RAW264.7细胞中脂类物质的分布
脂双层两侧的脂类物质的组分是不同的。其中,磷脂酰胆碱(PC)、神经鞘磷脂(SM)和胆固醇主要位于膜外侧面,而磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)和磷脂酰丝氨酸(PS)主要位于膜胞浆侧。多个亚细胞器和膜微区域的存在、脂类分子的不均匀分布以及脂类分子相互作用的内在动力学使得脂质组学的研究更具吸引力,也更有挑战性。
1.3 RAW264.7细胞中主要脂类物质的生物学功能
甘油磷脂类中的磷脂酸(PA)是合成所有磷脂的媒介物,也是哺乳细胞内的信号分子,影响脂类代谢的多个通路;磷脂酰丝氨酸位于细胞内膜的小叶中,其在细胞表面出现是细胞凋亡的特征性标志,这对识别及清除细胞凋亡的碎片十分重要;溶血磷脂酸(LPA)在血小板聚集及癌细胞侵害时具有一定的生物活性,同时,也是G蛋白偶联受体的天然配体;溶血磷脂酰丝氨酸主要是作为成纤维细胞趋化性的媒介;缩醛磷脂可以保护细胞防止过氧化应激;脂肪酸(FA)长链的氧化作为哺乳动物能量的来源;固醇类物质(类固醇激素、维他命、胆汁酸)等为机体代谢提供燃料[13,14];神经酰胺与细胞凋亡有关;鞘氨醇-1-磷酸能够促进细胞生长和迁移。
2 RAW264.7细胞与脂类代谢的关系
脂质组学主要研究生物体受外界刺激和疾病干扰后脂类代谢物以及脂类分子相互作用的变化。Hermansson等[15]总结出哺乳细胞中脂质处于一个稳定的状态,绘制了在所有的哺乳细胞中都存在的甘油磷脂的生物合成和代谢的途径,包括作用的关键酶。脂质代谢具有一定的代谢网络,而网络的紊乱可引起多种疾病的发生,通过测定细胞内脂质分子的变化(如脂种类、亚种类和单个脂类分子)、脂质分子的动态代谢以及类脂与蛋白质的相互作用,人们对许多疾病有了新的认识。因此脂质及其代谢物有望作为健康或疾病状态的指征。脂质组学的发展为药物开发、标记物的发现以及疾病的早期诊断提供了新的机遇[10]。
细胞是构成人体最基本的结构和功能单位,每种细胞分布于机体的特定部位,执行特殊的功能。RAW264.7细胞是小鼠单核巨噬细胞白血病细胞,属于小鼠腹腔上皮细胞,在炎症反应、免疫反应和吞噬反应中发挥着关键的作用[16]。脂多糖(LPS)是革兰氏阴性菌细胞壁的主要成分,是机体炎症和免疫反应的强诱导剂,在启动宿主防御细菌感染的炎症和免疫反应中发挥重要作用。巨噬细胞经脂多糖刺激后,可以产生大量金属基质蛋白酶(MMPs)、一氧化氮(NO)、促炎症因子如肿瘤坏死因子(TNF-α)和白介素-6(IL-6)等,从而引发炎症损伤[17]。为了探讨该过程中脂质代谢通路,国内外学者进行了一系列的研究。
2.1 对RAW264.7细胞脂类物质代谢通路的研究
美国加州大学进行了RAW264.7细胞脂质组学的研究,研究了脂多糖诱导前后的巨噬细胞中所有脂质成分的变化[18]。以RAW264.7 细胞作为研究对象,采用一种选择性激动该细胞的TLR4受体的物质Kdo2-Lipid A(一种脂多糖类似物),诱导细胞成炎症模型,系统分析了经Kdo2-Lipid A处理后8个时间点(0 h、0.5 h、1 h、2 h、4 h、8 h、12 h、24 h)内,二十四烷酸类、脂肪酸类、甘油脂类、甘油磷脂类、鞘磷脂类及固醇类脂质的动态变化。结果表明,Kdo2-Lipid A处理后,脂质成分发生了很大的变化,并鉴定出400余种脂质分子,根据实验数据,并结合相关文献报道,LIPID MAPS 通过VANTED 软件绘制了一系列脂质代谢途径,如二十四烷酸类脂质代谢途径、ω-3、ω-6、ω-9 脂肪酸的代谢途径、含32:0、32:1、34:0、34:1、36:0、36:1、38:0、38:1、38:4 脂肪酸链的甘油脂类和甘油磷脂类脂质的代谢途径、部分鞘磷脂类脂质代谢途径、固醇类脂质代谢途径等,并完成了对哺乳动物脂类物质的首次定量研究[19]。
2.2 对RAW264.7细胞亚细胞器脂类代谢的研究
脂质的功能是由其局部浓度决定的,脂质浓度在各细胞器之间、脂质双分子层的2个小叶之间、甚至在细胞膜的侧内面都是不同的。研究细胞脂质成分的功能,不仅要确定哪种脂质成分是存在的,还要确定每个特殊细胞部位的每种脂质的浓度及与其相互影响的成分[20]。Andreyev等[16]对RAW264.7细胞的亚细胞器脂质成分进行了研究,详细探讨了各亚细胞器中甘油磷脂类、神经鞘脂类、固醇脂类及孕烯醇脂类的提取方法及色谱质谱的分析方法,并分析了Kdo2-Lipid A诱导前后RAW264.7细胞各亚细胞器中的脂质成分,结果鉴别出163个甘油磷脂类成分、48个神经鞘脂类成分、13个固醇脂类成分及5个孕烯醇脂类成分,并进一步证明各亚细胞器间甘油磷脂类成分明显不同,迈出了RAW264.7细胞亚细胞器脂质组学的第一步。
2.3 对RAW264.7细胞花生四烯酸类脂质代谢的研究
Gupta等[21]通过建立Kdo2-Lipid A刺激诱导的RAW264.7巨噬细胞的炎症模型,研究了基因及药理学干预条件下脂质通路的变化,绘制了花生四烯酸类脂质在炎症反应中的代谢网络,结果表明,花生四烯酸类脂质在炎症反应中具有重要作用。Buczynski等[22]通过建立同样的细胞模型,探讨了花生四烯酸合成通路的基因组和脂质组的短暂变化,并绘制了基因组及脂质组的代谢网络,结果表明,在Kdo2-Lipid A刺激下,首先促进COX途径的代谢,引起大量COX途径产物的上调、5-LOX途径产物的下调,表明这些产物在炎症反应中具有重要作用。因此,对花生四烯酸类脂质进行分析对了解其在健康状态和炎症状态的作用及对药物的开发都具有重要的意义。
在脂质代谢网络中,含有二十碳四烯酸碳链的甘油磷脂是花生四烯酸的前体物质,Rouzer等[23]运用质谱法测定了脂多糖诱导前后,与二十碳四烯酸代谢有关的甘油磷脂的结构和两种巨噬细胞(RPMs细胞和RAW264.7细胞)的脂质组成。结果发现,诱导前后甘油磷脂的组成有很大的不同,并与细胞种类密切相关,这表明了甘油磷脂的组成在脂质介质生物合成过程中的重要性。该实验组随后又进一步进行研究[24],采用酵母多糖诱导该两种巨噬细胞,结果表明,在脂质代谢网络中,含有二十碳四烯酸碳链的磷脂酰胆碱是花生四烯酸的主要来源,而烷酰基的磷脂酰乙醇胺作为一种瞬时来源,可以快速被补充。
2.4 对RAW264.7细胞胆固醇代谢的研究
冯旭等[25]以 RAW264.7细胞为研究对象,探讨人胆固醇脂水解酶(hCEH)在细胞内的瞬时表达对细胞内胆固醇代谢产生的影响,结果表明,hCEH基因在 RAW264.7细胞内成功表达,可降低细胞内胆固醇水平、抑制泡沫细胞的形成。Zhou等[26]以RAW264.7细胞源性泡沫细胞为研究对象,观察对氧磷对RAW264.7细胞源性泡沫细胞ABCA1表达和胆固醇流出的影响并探讨其机制。结果显示,对氧磷以时间和剂量依赖的方式增加RAW264.7细胞源性泡沫细胞中总胆固醇、游离胆固醇和胆固醇脂水平,减少ABCA1表达和胆固醇流出。陶建等[27]初步探讨了整合素β1基因在RAW264.7细胞摄脂过程中的作用,发现整合素β1基因明显影响RAW264.7细胞的摄脂功能,进而影响RAW264.7细胞向泡沫细胞的转化。
2.5 对RAW264.7细胞磷脂酶代谢的研究
细胞中磷脂的代谢同时受G蛋白和酪氨酸激酶的调控,包括磷脂酶C、D、A1和A2,另外也受到一些脂质激酶和磷酸酶的调节,这些酶可以将脂质成分转化为生物活性的信号分子,如磷脂酸、甘油二酯和聚磷酸肌醇[28]。Zhang等[29]证实了经脂多糖诱导后的RAW264.7细胞中磷脂酶的作用。用胆碱磷脂酶C抑制剂和胆碱磷脂酶D抑制剂对诱导后的细胞作用,结果表明,该两种抑制剂分别部分抑制脂多糖诱导的炎症因子iNOS和TNF-α的表达,并抑制甘油二酯和磷脂酸的生成,而合用该两种抑制剂可以达到完全阻断的目的。因此,可以通过胆碱磷脂酶C和胆碱磷脂酶D的活性调节脂多糖诱导后的RAW264.7细胞的脂类代谢。
3 结语
结合特定的生命体、组织、体液、细胞等样品,进行不同层面的脂质组(Lipidome)研究,使脂质代谢通路的分析具有一定的复杂性及探索性。LIPID MAPS Networks 主要是整合基因组学、蛋白质组学和脂质组学的研究结果,尝试建立某种特定情况下的代谢途径,是目前研究RAW264.7细胞脂类代谢最全面的机构,已鉴别出1000多种脂质分子,甚至发现了很多稀少的、以前未确定的磷脂种类。然而,不断优化提取方法、发展新的技术和分析方法(如亲和探针、生物信息学等)、探索其它未知的脂质成分及可能的代谢通路仍有待研究。另外,已发现的脂类成分中,花生四烯酸类脂质在炎症反应中的作用已经明确,但其它脂质成分的生物学功能仍需进一步探索。鉴于脂质成分与疾病的关系,探索其与疾病相关的生物学功能将有望为疾病的治疗寻找到新的靶点。
参考文献:
[1] Bou Khalil M,Hou W,Zhou H,et al.Lipidomics era:Accomplishments and challenges[J].Mass Spectrometry Reviews,2010,29(6):877-929.
[2] Fahy E,Subramaniam S,Murphy R C,et al.Update of the LIPID MAPS comprehensive classification system for lipids[J].Journal of Lipid Research,2009,50(Suppl):S9-S14.
[3] Stein O,Stein Y.Lipid transfer proteins (LTP) and atherosclerosis[J].Atherosclerosis,2005,178(2):217-230.
[4] Tsironis L D,Katsouras C S,Lourida E S,et al.Reduced PAF-acetylhydrolase activity associated with Lp(a) in patients with coronary arterydisease[J].Atherosclerosis,2004,177(1):193-201.
[5] Walter A,Korth U,Hilgert M,et al.Glycerophosphocholine is elevated in cerebrospinal fluid of Alzheimer patients[J].Neurobiology of Aging,2004,25(10):1299-1303.
[6] Taskinen M R.Type 2 diabetes as a lipid disorder[J].Curr Mol Med,2005,5(3):297-308.
[7] Han X,Yang J,Cheng H,et al.Shotgun lipidomics identifies cardiolipin depletion in diabetic myocardium linking altered substrate utilization with mitochondrial dysfunction[J].Biochemistry,2005,44(50):16684-16694.
[8] Cohen Leonard A.Lipids in cancer:An introduction[J].Lipids,1992,27(10):791-792.
[9] Boggara M B,Krishnamoorti R.Partitioning of nonsteroidal antiinflammatory drugs in lipid membranes:A molecular dynamics simulation study[J].Biophysical Journal,2010,98(4):586-595.
[10] Wenk M R.The emerging field of lipidomics[J].Nature Reviews,2005,4(9):594-610.
[11] 许国旺,等.代谢组学——方法与应用[M].北京:科学出版社,2008:161-162.
[12] 蔡潭溪,刘平生,杨福全,等.脂质组学研究进展[J].生物化学与生物物理进展,2010,37(2):121-128.
[13] Nakanishi H,Ogiso H,Taguchi R.Qualitative and quantitative analyses of phospholipids by LC-MS for lipidomics[J].Methods in Molecular Biology,2009,579(2):287-313.
[14] Ivanova P T,Milne S B,Byrne M O,et al.Glycerophospholipid identification and quantitation by electrospray ionization mass spectrometry[J].Methods in Enzymology,2007,432:21-57.
[15] Hermansson M,Hokynar K,Somerharju P.Mechanisms of glycerophospholipid homeostasis in mammalian cells[J].Progress in Lipid Research,2011,50(3):240-257.
[16] Andreyev A Y,Fahy E,Guan Z.Subcellular organelle lipidomics in TLR-4-activated macrophages[J].Journal of Lipid Research,2010,51(9):2785-2797.
[17] Raetz C R H,Whitfield C.Lipolysaccharide endotoxins[J].Annu Rev Biochem,2002,71:635-700.
[18] Raetz C R,Garrett T A,Reynolds C M,et al.Kdo2-Lipid A ofEscherichiacoli,a defined endotoxin that activates macrophages via TLR-4[J].Journal of Lipid Research,2006,47(5):1097-1111.
[19] Dennis E A,Deems R A,Harkewicz R.A mouse macrophage lipidome[J].Journal of Biological Chemistry,2010,285(51):39976-39985.
[20] van Meer G.Cellular lipidomics[J].The EMBO Journal,2005,24(18):3159-3165.
[21] Gupta S,Maurya M R,Stephens D L,et al.An integrated model of eicosanoid metabolism and signaling based on lipidomics flux analysis[J].Biophysical Journal,2009,96(11):4542-4551.
[22] Buczynski M W,Stephens D L,Bowers-Gentry R C,et al.TLR-4 and sustained calcium agonists synergistically produce eicosanoids independent of protein synthesis in RAW264.7 cells[J].J Biol Chem,2007,282(31):22834-22847.
[23] Rouzer C A,Ivanova P T,Byrne M O,et al.Lipid profiling reveals arachidonate deficiency in RAW264.7 cells:Structural and functional implications[J].Biochemistry,2006,45(49):14795-14808.
[24] Rouzer C A,Ivanova P T,Byrne M O,et al.Lipid profiling reveals glycerophospholipid remodeling in zymosan-stimulated macrophages[J].Biochemistry,2007,46(20):6026-6042.
[25] 冯旭,罗俊生,关宁,等.人胆固醇酯水解酶在RAW264.7巨噬细胞内瞬时表达对胆固醇代谢的影响[J].重庆医科大学学报,2010,35(11):1609-1613.
[26] Zhou S H,Yang X H,Wu S J,et al.Paraoxon down regulates ATP-binding cassette transporter A1 expression and decreases cholesterol efflux through cyclic AMP signaling pathway in RAW264.7 macrophage-derived foam cells[J].Progress in Biochemistry and Biophysics,2010,37(2):190-199.
[27] 陶建,李晓辉,刘雅.整合素β1基因对RAW264.7细胞摄脂功能的影响[J].第三军医大学学报,2011,33(2):128-131.
[28] Ivanova P T,Milne S B,Forrester J S,et al.Lipid arrays:New tools in the understanding of membrane dynamics and lipid signaling[J].Molecular Interventions,2004,4(2):86-96.
[29] Zhang F,Zhao G,Dong Z.Phosphatidylcholine-specific phospholipase C and D in stimulation of RAW264.7 mouse macrophage-like cells by lipopolysaccharide[J].International Immunopharmacology,2001,1(7):1375-1384.

