分光光度法测定黄花草木樨中总黄酮含量
汤春妮,闫晓前,马喜锋,张军科
(陕西国防工业职业技术学院,陕西 西安 710302)
黄花草木樨(Melilotus)为豆科(Leguminosae)草木樨属(MelilotusMill.)一年生或两年生草本植物,在我国分布广泛[1],其全草具有抗炎抗菌、改变血管通透性、促进血液循环、改善血管平滑肌、调节免疫、抗氧化和清除自由基等药理作用[2,3]。黄花草木樨含有香豆素类、黄酮类、酚酸类、甾体类、三萜类、糖类、蛋白质类等化学成分,其中黄酮类化合物是主要功效成分之一[4~8]。目前,国内对黄花草木樨中总黄酮含量测定方法的研究报道甚少[9]。分光光度法常用来测定植物中总黄酮含量。黄酮类化合物本身在紫外光谱区具有吸收带,但存在较多干扰,故通过NaNO2-Al(NO3)3-NaOH 比色法[即黄酮类化合物在亚硝酸盐存在的碱性条件下与Al(NO3)3形成稳定的红色配合物]使其吸收带位移至可见光区进行测定,以较少干扰测得以芦丁为标样的总黄酮含量。作者采用分光光度法测定黄花草木樨中总黄酮的含量,以期为黄花草木樨中总黄酮的开发提供依据。
1 实验
1.1 试药、试剂与仪器
芸香叶苷(芦丁),生化级,中国医药上海化学试剂公司;其余所用试剂均为分析纯;市购草木樨,经鉴定为黄花草木樨M.officinalisL.Desr。
UV-9200型紫外可见分光光度计,北京瑞利分析仪器公司;BP211D型电子天平,SARTORLUS;DF-101S型集热式恒热加热磁力搅拌器,上海东尔制冷仪器设备有限公司;KQ3200型超声波清洗器,昆山超声仪器有限公司;LDA-2型低速离心机,北京医用离心机厂。
1.2 供试品溶液的制备
方法一(热回流提取法):精密称取粉碎过筛的草木樨药材1.0000 g,加入30 mL 80%甲醇溶液,在60 ℃下回流提取2 h,离心分离,共提取3次,合并滤液定容至100 mL作为供试品溶液备用。
方法二(超声波提取法):精密称取粉碎过筛的草木樨药材1.0000 g,加入30 mL 80%甲醇溶液,常温下超声提取40 min,离心分离,共提取3次,合并滤液定容至100 mL作为供试品溶液备用。
方法三(冷浸提取法):精密称取粉碎过筛的草木樨药材1.0000 g,加入30 mL 80%甲醇溶液,常温下提取24 h(前6 h时时振摇,后18 h静置),离心分离,共提取3次,合并滤液定容至100 mL作为供试品溶液备用。
1.3 标准曲线的绘制[10,11]
精确称取芦丁10.0 mg(105 ℃烘干至恒重),用80%的甲醇溶解并定容至100 mL,得0.1 mg·mL-1的芦丁标准储备液,备用。精密量取芦丁标准储备液1 mL、2 mL、3 mL、4 mL、5 mL置于10 mL容量瓶中,分别加入5% NaNO2溶液0.3 mL,静置6 min,再分别加入10% Al(NO3)3溶液0.3 mL,静置6 min,最后加入4% NaOH溶液4 mL,用甲醇定容至10 mL,静置20 min;以相应试剂为空白,用紫外可见分光光度计在510 nm处测定吸光度值。结果表明,芦丁在10~50 μg·mL-1浓度范围内,吸光度值与浓度呈良好的线性关系:A=0.0128c-0.0194(R=0.9992)。
1.4 样品含量的测定
分别精密吸取按1.2项方法制备的供试品溶液2.0 mL置于10 mL容量瓶中,按1.3项操作,测定吸光度,计算总黄酮含量。
2 结果与讨论
2.1 精密度实验
精密量取6份芦丁标准储备液各3.0 mL,分别置于10 mL容量瓶中,按1.3项操作,测定吸光度分别为0.372、0.373、0.371、0.375、0.372、0.371,平均值为0.372,RSD=0.41%。表明方法的精密度良好。
2.2 稳定性实验
精密吸取供试品溶液2.0 mL,置于10 mL容量瓶中,按1.3项操作,每隔10 min测定1次吸光度,共测6次,吸光度分别为0.348、0.347、0.346、0.344、0.343、0.341,平均值为0.345,RSD=0.77%。表明供试品溶液在显色后60 min内稳定性良好。
2.3 重现性实验
取同一批草木樨药材6份,按1.2项方法一制备供试品溶液,精密吸取制备的供试品溶液2.0 mL,置于10 mL容量瓶中,按1.3项操作,测定吸光度分别为0.346、0.349、0.345、0.344、0.340、0.343,平均值为0.345,RSD=0.88%。表明方法的重现性良好。
2.4 回收率实验
精密量取9份已知含量的供试品溶液(方法一)1.0 mL至10 mL容量瓶中,再分别准确加入芦丁标准储备液1.1 mL、1.4 mL、1.8 mL,进行3组平行实验,每组3份,按1.3项操作,分别测定吸光度,计算回收率,结果见表1。
由表1数据计算,平均回收率为99.19%、RSD为0.79%,表明方法的回收率良好。
2.5 样品含量测定
按1.2项方法制备供试品溶液,精密吸取2.0 mL置于10 mL容量瓶中,按1.3项操作,分别测定吸光度,结果见表2。
由表2可知,与超声波提取法、冷浸提取法相比,热回流提取法提取黄花草木樨中总黄酮的效果最好,其平均含量为1.44%,这可能与黄花草木樨中含有的黄酮类化合物的种类与结构有关。因此, 确定热回流提取法为测定黄花草木樨中总黄酮时的提取方法。
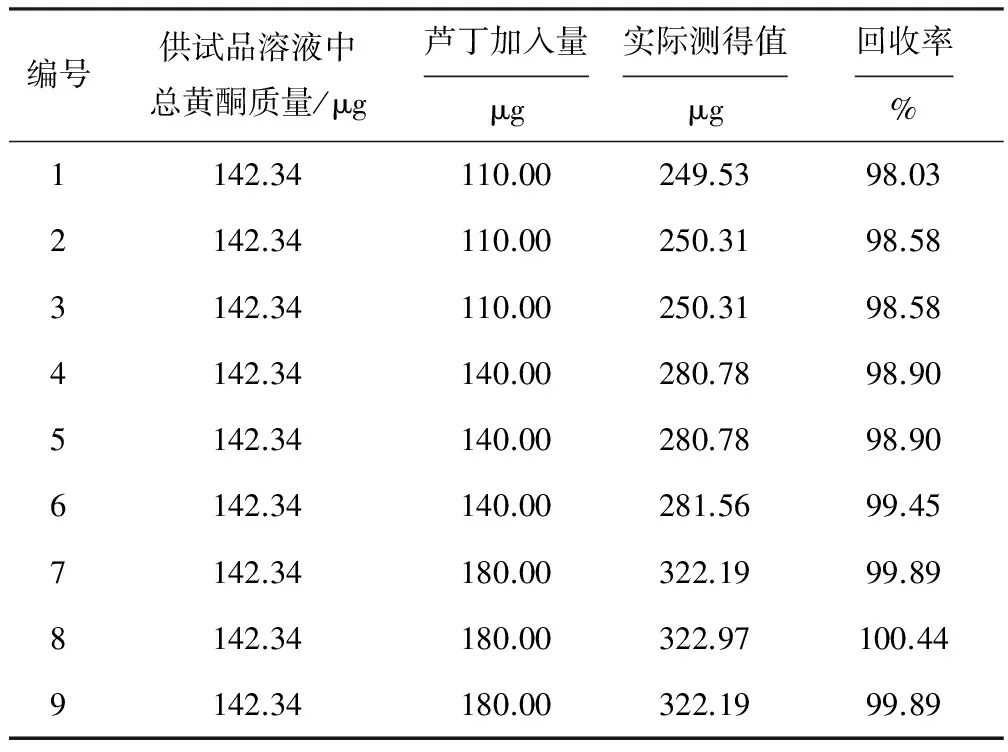
表1 回收率实验结果
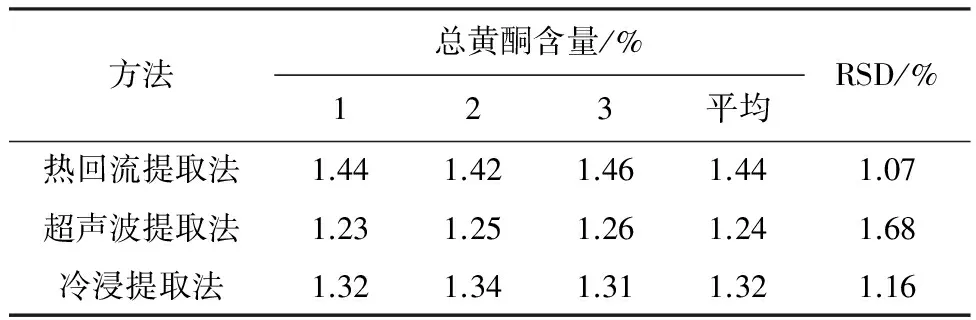
表2 不同提取方法的总黄酮含量测定结果
3 结论
采用分光光度法测定黄花草木樨中总黄酮含量,操作简便、准确、可靠、稳定性和重现性好,可用于黄花草木樨中总黄酮的含量测定。
参考文献:
[1] 杨玉凤.耐旱耐瘠的先锋牧草草木樨[J].北京农业,2003,(10):26-27.
[2] 张海峰,高成富,卢柳燕.草木樨提取物的制备及其抑菌作用[J].中药材,2009,32(1):131-134.
[3] 魏刚.草木樨属植物药理作用研究进展[J].湖北中医杂志,2009,31(11):79-80.
[4] Bubenchikova V N,Drozdova I L.HPLC Analysis of phenolic co-mpounds in Yellow Sweet-Clover[J].Pharm Chem J,2004,38(4):195-196.
[5] Kang S S,Lee Y S,Lee E B.Saponins and flavonoid glycosides from Yellow Sweet Clover[J].Arch Pharmacal Res,1988,11(3):197-202.
[6] 康菊珍.藏药草木樨的化学成分研究[J].西北民族大学学报(自然科学版),2009,30(3):40-41.
[7] Maeias F A,Simonet A M,Galindo J G,et al.Bioactive polar triterpenoids fromMelilotusmessanensis[J].Phytochemistry,1998,49(3):709-717.
[8] 李静.黄花草木犀香豆素类和黄酮类化学成分研究[D].武汉:湖北中医学院,2007.
[9] 高成富,张海峰.草木樨提取物中香豆素、总多酚、黄酮的测定[J].科协论坛,2008,(7):58-59.
[10] 林亮.化香树果序黄酮类化合物提取、分离及抑菌活性研究[D].西安:西北大学,2009.
[11] 姜秀娟,唐金成,白红进.可见分光光度法测定刺山柑花蕾中总黄酮含量[J].食品科学,2010,31(18):252-254.

