响应面法优化米曲霉降解黄水的营养条件
刘 丹 ,张志才,3*,冯 凡,李佳少,李 敏,庞巧霞,陈克平
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.江苏大学 生命科学研究院,江苏 镇江 212013;3.北京绿科天成生物有限公司,北京 102300)
黄水是固态法生产浓香型大曲酒的发酵过程中,酒醅在微生物的作用下部分由水浸出的,由上层连续向窖底渗透的一种棕黄色、微粘稠的浑浊液体。该废水含有较多的酚类、醇类化合物[1],呈酸性,pH值为3.0~4.5[2];其COD和BOD较高,远超出了国家允许的废水排放标准。如该废水不经处理直接排放至水体中,会降低水体中的溶氧量并且会阻碍水生生物的生长[3],导致严重的环境污染。
目前为止,黄水的处理方法主要包括生物法和物理-化学法[3-4],或者通过酯化、串蒸、生产调味酒等方式回收[5]。但是,回收方式只能回收一些较低沸点的具挥发性的酯类物质[6],该废水仍需进一步处理。而物理-化学法处理黄水包括吸附,凝聚和絮凝、氧化法、膜处理以及蒸发等[3]。有资料显示活性炭作为一种吸附剂可以达到99%的脱色效果[3]。也有研究表明在碱性条件下,生物法结合利用传统凝聚剂如硫酸亚铁、硫酸铁或明矾处理废水,98%的有色物质可以被去除[3,7]。但是这些处理方法不仅成本较高,还会造成二次污染[8]。目前,生物法在废水处理中起着主要作用,已被广泛应用[9]。生物法处理是通过微生物的新陈代谢,降解废水中的有机物,从而能显著降低废水的COD。与回收、物理-化学处理法相比,生物降解更环保,且高效、成本较低[10]。
米曲霉,属半只菌亚门,可以分泌多种酶,如蛋白酶、淀粉酶、纤维素酶和植酸酶等[11-12],已被美国食品药品管理局和美国饲料控制官员协会认定为安全无毒[13-14]。目前米曲霉已被广泛应用于废水处理和水体修复、食品、饲料、曲酸生产、酿酒等发酵行业[12,15]。如TUNGTG等[16]人利用米曲霉处理木薯淀粉加工中的废水,通过优化降解条件,可以去除废水中90%COD。BHALERAOTS和PURANIK PR[17]研究发现一株能降解土壤中久效磷的米曲霉ARIFCC1054,该菌具有磷酸酶活性,可用于修复被久效磷污染的土壤以及废水的处理。另外,秸秆经过粉碎后用米曲霉发酵,其纤维素和半纤维素可降低24.36%和69.90%[18]。除此之外,米曲霉也已被广泛应用于重金属的吸附或者染料的去除[19-20]。
在本文中,我们所利用的米曲霉CGMCC5992能有效降解黄水中的有机物质并在发酵过程后期能产生活性物质生物碱,生物碱能有效降低糖尿病诱导小鼠的血糖含量。本研究通过单因素试验和Box-Behnken设计试验优化米曲霉CGMCC5992降解黄水中有机物质,降低其COD的营养需求。而生物碱的结构功能分析将在另撰文阐述。
1 材料与方法
1.1 材料
1.1.1 菌株
米曲霉CGMCC5992为自主分离菌株,被保藏于中国普通微生物菌种保藏管理中心。
1.1.2 黄水
黄水:由江苏洋河酒厂提供,常温保存。黄水为棕褐色,有典型气味,呈酸性(pH值为3.5),化学需氧量(COD)为40g/L~45g/L,生物需氧量(BOD)为15g/L~20g/L,氨氮浓度为0.2mg/L~0.5mg/L,悬浮体浓度为165mg/L~200mg/L。
1.2 种子液的制备
从斜面上取一环该菌接种于无菌的固体培养基中(含15g麸皮,20mL水),在28℃静置培养4d~7d。然后取该种子转接至含有100mLPD培养基的三角瓶中,在28℃、150r/min下摇床培养1d~2d作为种子液用于黄水降解。
1.3 黄水的生物降解
以10%黄水作为基础培养基,并按照试验设计方法添加各种营养物质,通过促进米曲霉的生长讨论对其COD的影响。培养基于121℃下灭菌30min。冷却后,接种10%(v/v)上述制备的种子液,在28℃、150r/min摇床培养5d。每隔24h,测定发酵液的pH值,同时取1mL发酵液在6000r/min下离心5min,取上清液用于COD的分析。
1.4 试验设计
选择不同的氮源、无机盐、维生素进行试验,确定对米曲霉CGMCC5992降解黄水有机物质有显著影响的单因素。并在单因素试验基础上,应用3因素3水平的Box-Behnken设计,以发酵液的COD为响应值,采用响应面法进行分析,实验因素及水平安排见表1。
1.5 分析方法
COD采用酸性高锰酸钾法测定[21],pH值用pH计在无菌条件下测定。响应面试验结果运用Expert Design 8.0.4分析软件进行方差分析(ANOVA)。
2 结果与分析
2.1 单因素试验结果
2.1.1 氮源对黄水COD的影响
由于黄水中含有较多的有机酸、醇类、酯类,其可作为米曲霉生长的足够碳源,故试验中未选择碳源作为优化因素。为研究不同氮源对米曲霉CGMCC5992去除黄水COD的影响,在基础培养基中分别添加100mg/L的尿素、蛋白胨、硝酸钾、氯化铵作为不同的氮源,进行发酵试验。实验结果如图1所示,因尿素和蛋白胨是有机氮源,故黄水起始COD要高于另外2个无机氮源。在第4d,添加尿素和蛋白胨后的黄水COD低于其他2种氮源,这表明前者降解有机物质的速率要高于其他2种氮源添加物。另外,最后一天添加尿素作为氮源的黄水COD低于添加蛋白胨。故综合考虑,选择尿素作为最佳氮源。随后考察添加不同浓度尿素对COD的影响。结果如图2所示,在第5d,当尿素浓度为0.3g/L时,其COD值低于其它浓度。尽管添加氮源种类不同,但在菌丝体生长过程中黄水pH的趋势相同,随着黄水中有机酸被降解,pH值从3.5上升至7.0左右。
2.1.2 无机盐对黄水COD的影响
为考察添加无机盐对黄水COD的影响,在基础培养基中分别添加10mg/L MnSO4、MgSO4、Fe2(SO4)3及ZnSO4这4种无机盐。以不添加无机盐作为对照组。其结果表明添加ZnSO4的黄水最后COD最低,见图3。有资料显示锌离子是多种水解-合成酶的辅助因子,对糖类、蛋白质和核酸的水解有着重要影响[22]。随后选择不同的锌离子浓度作为变量,考察其对黄水的pH值、COD的影响。结果如图4显示,在锌离子浓度为20mg/L时,其黄水COD浓度低于其他浓度。结果表明低浓度的锌离子对米曲霉降解黄水起着促进作用。如图3所示,添加无机盐的黄水其pH变化趋势与添加氮源的趋势类似。
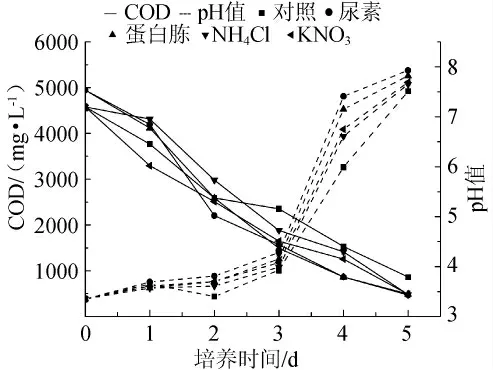
图1 不同氮源对黄水的pH值和COD的影响Fig.1 Effect of nitrogen sources on pH value and COD of vinasse
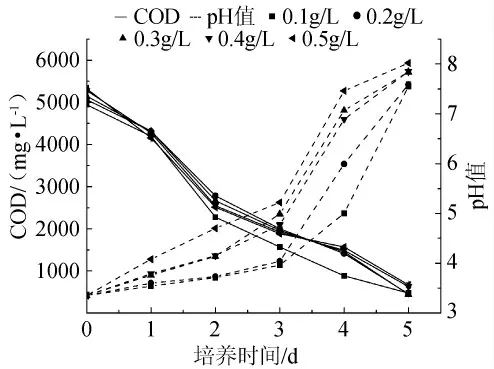
图2 不同浓度尿素对黄水pH值和COD的影响Fig.2 Effect of urea concentrations on pH value and COD of vinasse
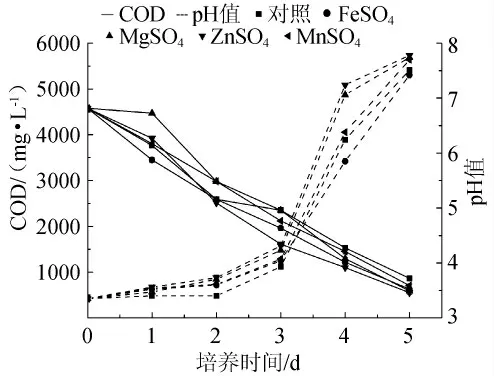
图3 不同无机盐对黄水pH值和COD的影响Fig.3 Effect of inorganic salts on pH and COD of vinasse
2.1.3 维生素对黄水COD的影响
在基础培养基中分别添加10mg/L VB1、VB2、VB6、VC作为不同的生长因子。如图5所示,添加不同维生素后,黄水的COD在第3d~5d明显下降。在选择的4种维生素中,添加VB6后黄水COD最低,降至471mg/L。故选择VB6作为最佳生长因子添加。并进一步考察其不同浓度对黄水COD值和pH值的影响,结果如图6所示,第5d,在VB6为20mg/L时COD最低。
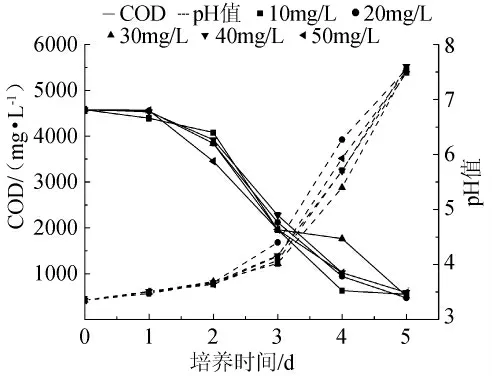
图4 不同浓度ZnSO4对黄水pH值和COD的影响Fig.4 Effect of ZnSO4concentration on pH value and COD of vinasse
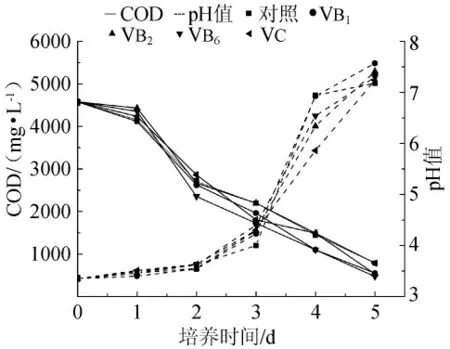
图5 不同维生素对黄水pH值和COD的影响Fig.5 Effect of vitamins on pH and COD of vinasse
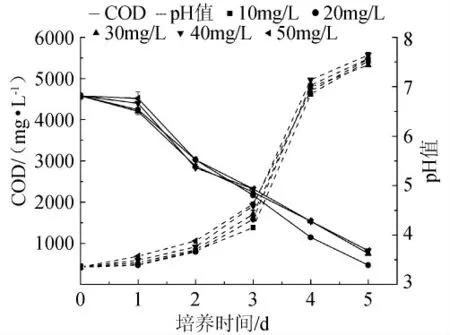
图6 不同浓度VB6对黄水p H值和COD的影响Fig.6 Effect of concentrations of VB6on pH and COD of vinasse
2.2 响应面分析
基于单因素试验结果,根据Box-Behnken的设计原理,选择尿素、ZnSO4和VB6为自变量,以COD为响应值设计了3因素3水平的响应面分析试验。响应面试验设计与结果见表1。
使用Design Expert7.0软件,对实验数据进行回归分析,得到拟合二次多项式回归方程:

表1 Box-Behnken 的设计及结果Table 1 Box-Behnken design and results

由表3方程分析结果表明,该模型效应显著可靠(p=0.0003)。方程中A、B、C、AB影响不显著,AC、BC、A2、B2、C2影响都是显著的。响应面模型的回归系数R2为0.9872,说明该回归方程回归效果较好;R2adj为0.9641,说明可信度较高;失拟误差p为0.3993,不显著,表明该模型对试验拟合情况较好,试验误差小,可以较好地反映各因素和响应值之间的真实关系。
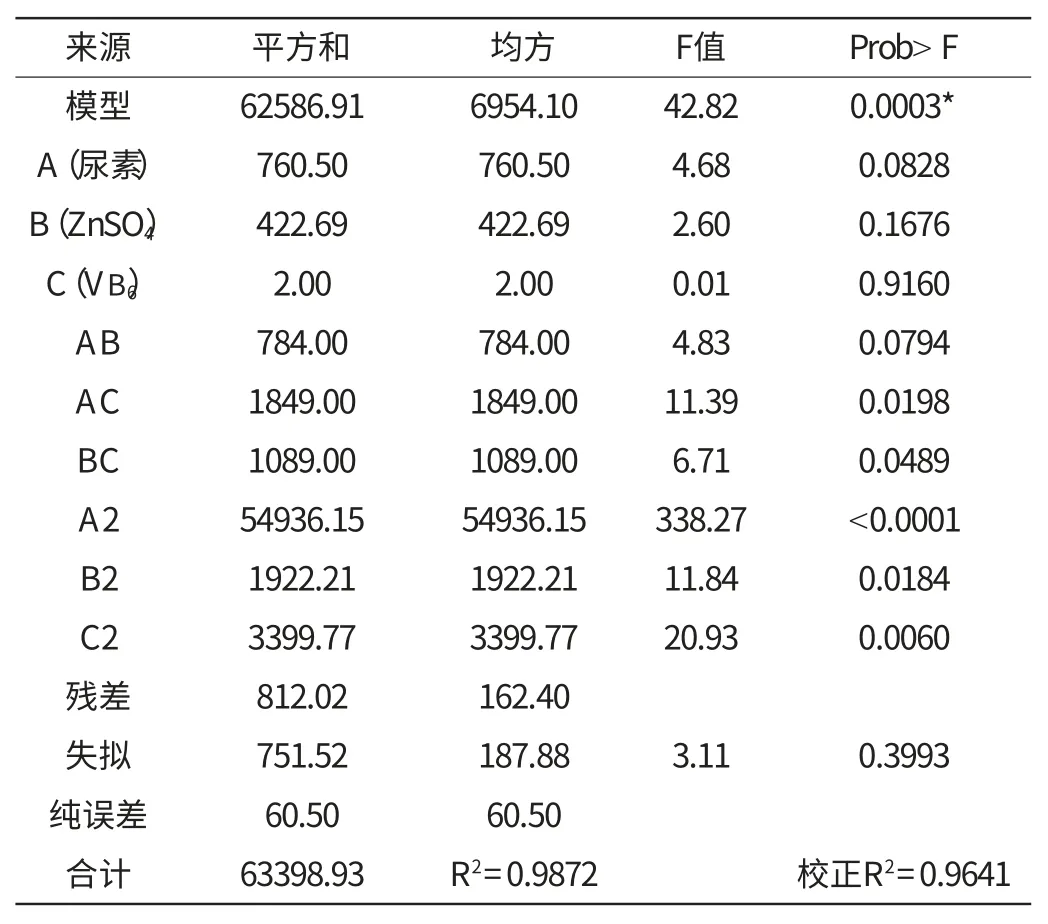
表2 Box-Behnken 试验方差分析Table 2 Regression analysis of Box-Behnken design
根据回归分析分别绘制响应面图,分析各因素间的交互作用。
图7显示了在VB6浓度为20mg/L时,尿素和ZnSO4对黄水COD的交互影响。从图中可看出,在ZnSO4浓度不变的条件下,随着尿素浓度逐渐增加,COD值出现先下降后上升的趋势且变化较显著。而在尿素浓度不变的条件下,随着ZnSO4浓度的增加,COD值也出现了先下降后上升的趋势,但变化不大。
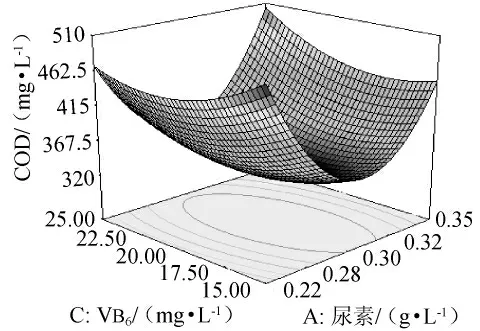
图8 尿素和VB6对黄水COD影响的响应面图Fig.8 Response surface plot for effect of urea and VB6on COD
图8显示在20mg/L ZnSO4下,尿素和VB6对黄水COD的交互影响。尿素浓度在0.25g/L~0.30g/L范围内,随着其浓度的增加,COD逐渐降低,在尿素浓度为0.28g/L~0.32g/L范围内,VB6为15mg/L~25mg/L COD达到最低。结果表明优化后COD去除率提高。

图9 ZnSO4和VB6对黄水COD影响的响应面图Fig.9 Response surface plot for effect of ZnSO4and VB6on COD
图9显示了在尿素0.3g/L下,VB6和ZnSO4对黄水COD的交互影响。在ZnSO4浓度不变的条件下,随着尿素浓度逐渐增加,COD值出现先下降后上升的趋势,变化较显著。在尿素浓度不变的条件下,随着ZnSO4浓度的增加,COD值也出现了先下降后上升的趋势,但变化不大。
3 结论
(1)通过单因素试验确定了影响米曲霉降解黄水效率的最佳浓度的氮源、无机盐、维生素添加物,分别为尿素0.3g/L、ZnSO420mg/L、VB620mg/L。
(2)在单因素试验的基础上,采用Box-Behnken设计,应用响应面法优化米曲霉降解黄水的条件,得到最佳培养基组成为:在10%黄水中添加0.30g/L尿素,20.73mg/L ZnSO4和19.79mg/L VB6。在该条件下,黄水的COD最后降至323mg/L。结果表明优化后COD显著降低。
(3)试验证明米曲霉CGMCC5992能有效降解黄水中的有机物质,从而降低其COD。黄水通过米曲霉处理,随着COD的降低,pH值也有所升高。但米曲霉降解黄水的机制还有待进一步研究。
[1]STRONG P J,BURGESS J E.Fungal and enzymatic remediation of a wine lees and five wine-related distillery wastewaters[J].Bioresource Technol,2008,99(14):6134-6142.
[2]CARVAJAL-ZARRABAL O,NOLASCO-HIPÓLITO C,BARRADASDERMITZ D M,et al.Treatment of vinasse from tequila production using polyglutamic acid[J].J Environ Manage,2012,95(Suppl):66-70.
[3]SATYAWALI Y,BALAKRISHNANET M.Wastewater treatment in molasses-based alcohol distilleriesfor COD and color removal:a review[J].J Environ Manage,2008,86(3):481-497.
[4]PANT D,ADHOLEYA A.Biological approaches for treatment of distillery wastewater:a review[J].Bioresource Technol,2007,98(12):2321-2334.
[5]曹新莉,王明山.白酒生产中黄水和酒尾的应用[J].酿酒科技,2008,172(10):96-99.
[6]谭光讯,李 净.黄水的组分分析及应用研究进展[J].酿酒科技,2010,196(10):90-92.
[7]PANDEY R A,MALHOTRA S,TANKHIWALE A,et al.2003.Treatment of biologically treated distillery effluent-a case study[J].Int J Environ Stud,2003,60(3):263-275.
[8]SANTANA V S,FERNANDESMACHADON RC.2008.Photocatalytic degradation of the vinasse under solar radiation[J].Catal Today,2008,133-135:606-610.
[9]FREITASA C,FERREIRA F,COSTA A M,et al.Biological treatment of the effluent from a bleached kraft pulp mill using basidiomycete and zygomycete fungi[J].Sci Total Environ,2009,407(10):3282-3289.
[10]ZHOU JIANGYA,YU XIAOJUAN,DING CONG,et al.Optimization of phenol degradation byCandidatropicalisZ-04 using Plackett-Burman design and response surface methodology[J].J Environ Sci,2011,3(1):22-30.
[11]孙春华,燕 磊,常维山.不同碳源和氮源对米曲霉产酶影响的研究[J].西南农业学报,2007,20(5):986-989.
[12]赵龙飞,徐亚军.米曲霉的应用研究进展[J].中国酿造,2006,25(3):8-10.
[13]MARUIJ,OHASHI-KUNIHIRO S,ANDO T,et al.Penicillin biosynthesisinAspergillusoryzaeand itsoverproduction by genetic engineering[J].J Biosci Bioeng,2010,110(1):8-11.
[14]MATSUMURA K,OBATA H,HATA Y,et al.Isolation and characterization of a novel gene encodingα-l-arabinofuranosidase fromAspergillusoryzae[J].J Biosci Bioeng,2004,98(2):77-84.
[15]KAMMOUN R,NAILIB,BEJARS.Application of a statistical design to the optimization of parameters and culture medium forα-amylase production byAspergillus oryzaeCBS 819.72 grown on gruel(wheat grinding by-product)[J].Bioresource Technol,2008,99(13):5602-5609.
[16]TUNG T Q,MIYATA N,IWAHORIK.Growth ofAspergillus oryzaeduring treatment of cassavastarch processing wastewater with high content of suspended solids[J].J Biosci Bioeng,2004,97(5):329-335.
[17]BHALERAO T S,PURANIK PR.Microbial degradation of monocrotophosbyAspergillusoryzae[J].Int Biodet Biodegr,2009,63(4):503-508.
[18]CHANGJUAN,CHENGWEI,YIN QINGQIANG,et al.Effect of steam explosion and microbial fermentation on cellulose and lignin degradation of corn stover[J].Bioresource Technol,2012,104:587-592.
[19]PARSHETTIG K,KALME SD,GOMARE SS,et al.Biodegradation of reactive blue-25 byAspergillus ochraceusNCIM-1146[J].Bioresource Technol,2007,98(18):3638-3642.
[20]YANG YUYI,JIN DANFENG,WANG GUAN,et al.Competitive biosorption of acid blue 25 and acid red 337 onto unmodified and CDAB-modified biomass ofAspergillus oryzae[J].Bioresource Technol,2011,102(16):7429-7436.
[21]国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法(第四版)[M].北京:中国环境科学出版社,2002:363.
[22]方一丰,林逢凯,陆 柱.补加营养元素对活性污泥法处理工业废水的优化作用[J].水处理技术,2006,32(10):15-18.
——化工原料、农副产品

