预混胰岛素类似物剂量的选择与优化
中国医学科学院北京协和医学院北京协和医院内分泌科卫生部内分泌重点
实验室 袁涛 邢小平
2型糖尿病概述及预混胰岛素剂型介绍
2型糖尿病是一种进展性疾病,外周组织胰岛素抵抗和B细胞功能异常导致早期餐时胰岛素分泌减少和餐后高血糖。如果未经治疗,很多糖尿病前期糖耐量异常的患者进展为显性糖尿病,B细胞分泌胰岛素能力进一步下降和空腹高血糖。2型糖尿病患者在确诊时B细胞分泌胰岛素的能力已经下降约50%。B细胞功能的持续性进行性丧失也加重了剩余B细胞的负担[1]。因此,2型糖尿病的治疗方案需要定期重新评估和调整以便于与内源性胰岛素分泌功能减退而导致高血糖加重的程度相匹配。使血糖接近正常是减少糖尿病长期血管并发症所必须的。为了达到这样的目标,关键是治疗方案必须兼顾空腹和餐后高血糖,才能更好的降低HbA1c。空腹和餐后血糖对HbA1c的贡献率随着血糖水平的不同而不同。HbA1c轻、中度升高时,餐后血糖(PPG)的贡献率可以达到70%,因此为了使HbA1c达标(<7%),降低餐后血糖尤为重要。当HbA1c进一步升高,尤其是>8.4%时,空腹血糖(FPG)的贡献率更大。越来越多的证据显示餐后血糖峰值与血管病变的病理生理机制相关,甚至是短期的餐后血糖升高也能触发细胞内的一系列反应而导致长期的病理改变。
在糖尿病的治疗中,改善生活方式的同时,口服降糖药(OADs)通常是药物治疗的首选。但是在OADs治疗时,随着B细胞功能的下降必然出现血糖的再次升高,因此,大多数2型糖尿病患者为了更好地控制血糖必然需要胰岛素治疗。在UKPDS研究中,确诊2型糖尿病后9年,80%OADs治疗的患者需要补充胰岛素[2]。2型糖尿病患者胰岛素起始治疗时有很多种方案:基础胰岛素(联合或不联合口服降糖药);餐时胰岛素;预混胰岛素;基础-餐时胰岛素(basalbolus therapy,BBT)方案。临床治疗中经常首选预混胰岛素,既包括基础也包括餐时胰岛素部分(因此被称为双相胰岛素),主要是因为其在控制血糖方面疗效优于单独应用长效或速效胰岛素,比经典的基础-餐时胰岛素治疗方案每日注射的次数更少而且能同时满足餐时和基础的治疗。有趣的是,医生和患者都有相同的需求:认为理想的外源性胰岛素应该是每日注射次数少,同时满足餐时和基础胰岛素需求,模拟生理性药代动力学和药效学特点,提供简洁的强化治疗方案,患者的生活质量相应的也得到了提高。胰岛素类似物的开发代表了糖尿病治疗领域的一个重大进步,为2型糖尿病控制血糖方案增加了更多的选择。速效胰岛素类似物已经被制成预混制剂,包括固定比例的可溶性速效胰岛素类似物(餐时成分),其余的部分为延迟吸收的鱼精蛋白化的类似物(基础部分)。
目前,在国内已经上市的预混胰岛素制剂包括传统的(预混人胰岛素30/70(BHI30),预混人胰岛素50/50(BHI50))和新的预混人胰岛素类似物(双相门冬胰岛素30/70(BIAsp30),预混优泌乐25/75(Mix25/75),预混优泌乐50/50(Mix50/50))(见表1)。与传统的预混人胰岛素相似,预混胰岛素类似物包括固定比例的可溶性速效胰岛素和鱼精蛋白化的类似物部分。但是与传统预混人胰岛素不同的是,预混胰岛素类似物具有更生理性的药代动力学和治疗上更理想的药效学作用特点。因此,在控制餐后血糖方面预混胰岛素类似物要优于预混人胰岛素。在非治疗达标的注册试验中,预混胰岛素类似物降低HbA1c的效果非劣于预混人胰岛素。轻度低血糖事件的发生率在预混胰岛素类似物和预混人胰岛素是相似的,但是严重低血糖事件无论哪种治疗都很罕见。除了低血糖以外其他不良事件的发生率在各种预混胰岛素之间也是相似的。预混胰岛素类似物,优泌乐25和门冬胰岛素30,与速效胰岛素类似物相似,也具有餐时注射时间灵活的特点,因此,与预混人胰岛素相比提高了患者的依从性和生活质量[1]。总体来说,循证医学证据表明预混胰岛素类似物与预混人胰岛素相比在2型糖尿病的治疗中是经济有效的。
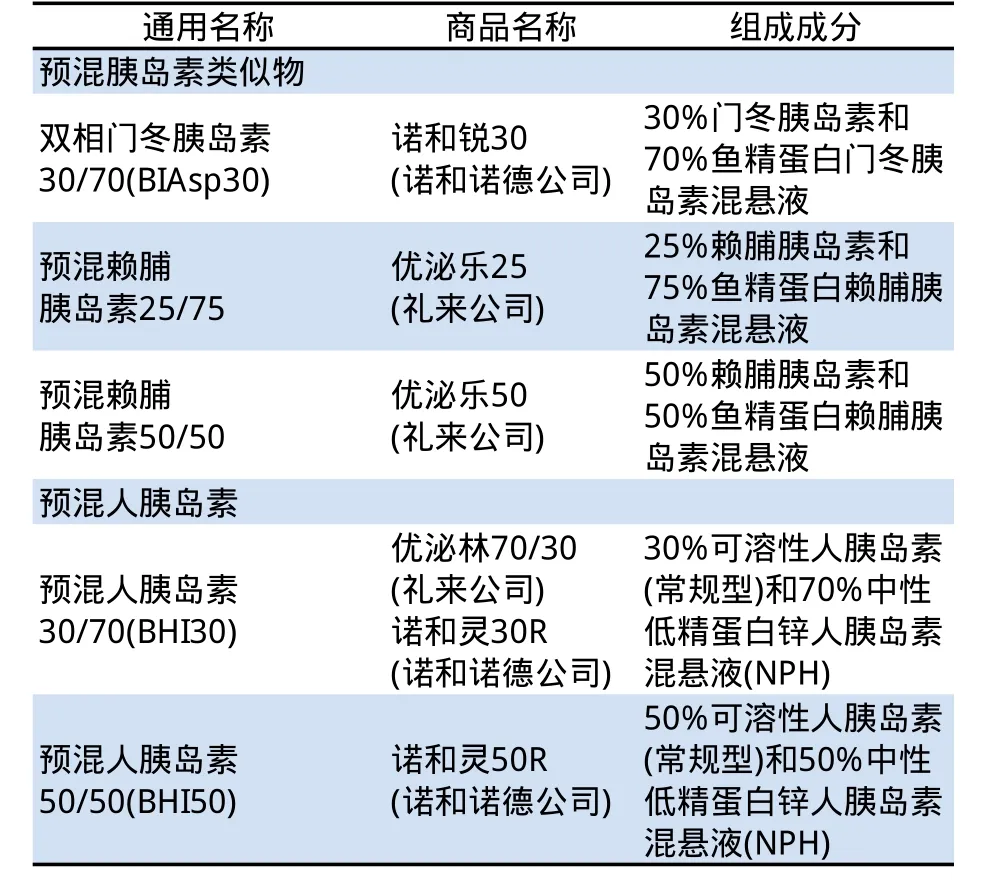
表1 国内已经上市的预混胰岛素制剂
2型糖尿病患者预混胰岛素起始治疗方案的剂量选择
良好的血糖控制可以减少糖尿病微血管和大血管并发症的发生风险。美国糖尿病协会(ADA)推荐的2型糖尿病患者HbA1c达标值为<7%,美国临床内分泌医师协会(AACE)指南推荐更严格的标准HbA1c≤6.5%。但是HbA1c的达标值也应该个体化,以避免不良反应的发生例如低血糖[3]。
因为2型糖尿病胰岛B细胞功能进行性下降,患者在OADs联合饮食控制和运动的情况下血糖仍不能达标时通常需要外源性胰岛素治疗。《ADA/EASD共识》推荐当OADs治疗后HbA1c>8.5%时起始胰岛素治疗。《AACE指南》推荐胰岛素的起始治疗以长效基础胰岛素类似物例如甘精胰岛素或地特胰岛素代替NPH,因为其作用时间更长、吸收更慢、峰值更低、低血糖风险更低而更适用于补充基础胰岛素。基础胰岛素起始治疗可以从睡前小剂量(通常10IU)开始,如果FPG仍未达标则逐渐增加剂量(每2~3d增加1~3IU),或者FPG降低到达标值后减少剂量。胰岛素剂量每增加0.1IU·kg-1·d-1可导致HbA1c快速、线性下降0.5%。在临床实践中,医师通常推荐的基础胰岛素每日总剂量不超过0.5IU/kg体重,因为,大于此剂量的胰岛素可能导致体重显著增加。2012年ADA/EASD关于2型糖尿病患者的高血糖管理立场声明中建议[4]:胰岛素起始治疗(包括基础和预混胰岛素)常从小剂量开始(例如0.1~0.2IU·kg-1·d-1),根据患者的血糖谱再逐渐调整剂量,即使在一些严重高血糖患者可能需要更大剂量的胰岛素(0.3~0.4IU·kg-1·d-1)。我国2型糖尿病防治指南(2010年版)目前推荐预混胰岛素的起始治疗方案如下[5]:预混胰岛素包括预混人胰岛素和预混胰岛素类似物。根据患者的血糖水平,可选择每日1到2次的注射方案。当使用每日2次注射方案时,应停用胰岛素促泌剂:
①每日1次预混胰岛素:起始剂量一般为0.2IU·kg-1·d-1,晚餐前注射。根据患者FPG调整胰岛素用量,每3~5d调整一次,每次调整1~4IU直至FPG达标。
②每日2次预混胰岛素:起始剂量一般为0.4~0.6IU·kg-1·d-1,按1﹕1的比例分配到早餐前和晚餐前。根据FPG、早餐后血糖和晚餐前后血糖分别调整早餐前和晚餐前胰岛素用量,每3~5d调整1次,每次调整1~4IU,直到血糖达标。
预混胰岛素类似物强化治疗的剂量选择的指南与研究实践
随着2型糖尿病的进展和B细胞功能的持续下降,单用基础胰岛素可能不足以控制全天血糖,尤其是PPG。将基础胰岛素日总量增加到>0.5IU/kg体重也不能使总体血糖水平达标时,因为长效胰岛素类似物只降低FPG,此时要考虑加用餐时胰岛素。可以选择在基础胰岛素类似物的基础上加用餐时速效胰岛素类似物或用预混胰岛素类似物代替基础胰岛素。在开始胰岛素强化治疗时,治疗方案应该覆盖FPG和PPG。预混胰岛素每日只需要注射2次,而采用基础-餐时胰岛素治疗方案(BBT)的患者通常需要每日注射4次。
当前,对于使用预混胰岛素类似物强化治疗的国际性的指南是非常有限的[6]。《美国临床内分泌医师协会(AACE)指南》提到两种方案:从长效胰岛素类似物转换为预混胰岛素类似物BID;从预混胰岛素类似物OD转换为BID。在上述两种方案中,推荐的方法如下:(按照1:1的剂量转换基础胰岛素)将每日的总剂量平均分成两份,早餐前注射一半的剂量,另一半剂量晚餐前注射,根据自我血糖监测水平(SMBG)和饮食记录来优化剂量,最大的一餐可能需要更大比例剂量的胰岛素,如果患者发生了低血糖则将总剂量减少20%。但《AACE指南》中并没有包括可能出现的预混胰岛素类似物从BID到TID强化治疗的方案。国际糖尿病联盟(IDF)指南提到了预混胰岛素可能作为强化治疗的选择,但是没有列出特殊的指南。英国的共识推荐2型糖尿病患者从基础胰岛素转换治疗时可以选择预混胰岛素类似物BID(需要时增加至TID强化治疗)。推荐的起始剂量为基础胰岛素治疗达标最后14d内总剂量的80%。但是,这些指南都没有包括剂量如何分配和调整。因此,需要新的国际性的涵盖预混胰岛素类似物强化治疗各个方面的指南。我国2型糖尿病防治指南(2010年版)目前推荐预混胰岛素强化治疗方案如下[5]:胰岛素的强化治疗中预混胰岛素类似物的使用:每日3次预混胰岛素类似物,根据睡前和三餐前血糖水平进行胰岛素剂量调整,每3~5d调整一次,直到血糖达标。
因为糖尿病的全球流行,全科医生也需要治疗越来越多的2型糖尿病患者,所以胰岛素强化治疗的指南应该更简洁、易于理解和执行。同时,对于现有几种预混胰岛素类似物的相关研究也为血糖控制达标时预混胰岛素类似物的注射次数和总剂量的确定提供了一定的循证医学证据。
1.BID的剂量选择
目前已有众多研究对不同比例预混胰岛素类似物BID治疗的剂量选择进行了探讨。以赖脯胰岛素25(优泌乐25)为例,在DURABLE研究[7]中,研究者设定了优泌乐25每日注射2次的剂量调整方案(见表2,每日至少检测2次血糖,早餐前FPG和晚餐前血糖)。
对于门冬胰岛素30的剂量选择也有众多研究论述,从基础胰岛素(类似物或人胰岛素)OD或BID转换为门冬胰岛素30BID的简单流程见图1。当患者从基础胰岛素OD或BID转换为门冬胰岛素30BID时,可以参照以下的建议:日总剂量按1:1转换为门冬胰岛素30,早晚餐前按照50:50比例分配,每周一次调整剂量,停用磺脲类降糖药,保留二甲双胍,根据当地的指南和实践考虑是否停用噻唑烷二酮类药物(TZDs),在餐前应用门冬胰岛素30。
另外,Hirsch等人提供了另一种基于SMPG调整胰岛素剂量的方案。通常预混胰岛素类似物的起始剂量为10IU,每日2次,根据患者的需要及时调整剂量是胰岛素治疗时需要考虑的一个重要因素。
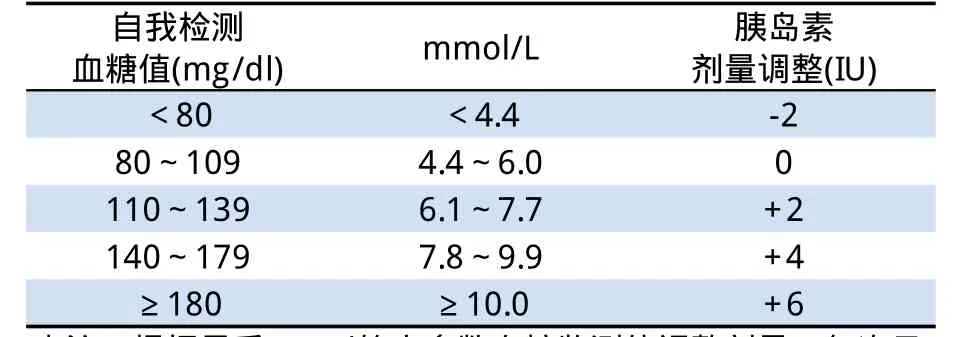
表2 优泌乐25每日注射2次的剂量调整方案
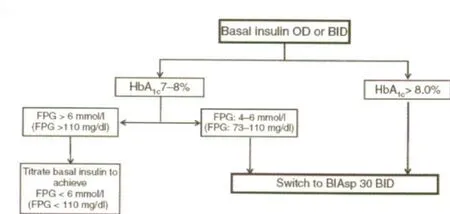
图1 从基础胰岛素(类似物或人胰岛素)每日1次(OD)或每日2次(BID)转换为双相门冬胰岛素30/70(BIAsp30,门冬胰岛素30)BID的简单流程。
2.TID的剂量选择
在一项24周随机、开放标签、活性药物对照、非劣效性临床试验中[8],374例使用OADs联合甘精胰岛素治疗仍未达标的患者转换为优泌乐50每日3次餐前注射或BBT治疗(睡前甘精胰岛素+餐时优泌乐)。根据血糖水平增加胰岛素剂量,虽然在研究开始时两组间胰岛素日总剂量没有显著差异,但是到研究结束时,BBT组胰岛素日总剂量(1.4IU/kg)显著高于优泌乐50组(1.2IU/kg,P=0.002)。在该项为期24周的研究结束时,优泌乐50组有55%的患者因为FPG仍然>110mg/dl而将晚餐前注射的优泌乐50改为优泌乐25。预混优泌乐治疗组平均HbA1c比基线下降-1.87%,BBT组下降-2.09%。虽然两组间ΔHbA1c有显著差异(P=0.021),但是差值只有-0.22%(没有超过FDA关于非劣效性研究定义的-0.3%或-0.4%的标准),两组间不同种类胰岛素的降糖效果相似。严重低血糖或总体低血糖的发生率在两组间没有显著差异。总体低血糖的发生率在优泌乐50组和BBT组分别为51.20/患者/年和48.70/患者/年,相当于每周1次(P=0.619)。研究者注意到在BBT组剂量调整更积极,主要是因为对甘精胰岛素的剂量调整方案掌握更熟练。另外一项纳入484例2型糖尿病患者为期26周的研究[9]报道了相似的低血糖发生率,在每日接受优泌乐50注射1次、2次和3次时低血糖发生率分别为40%、32%和39%。
小 结
本综述的主要内容是关于预混胰岛素类似物的临床应用,因此,没有详细介绍基础胰岛素或在基础胰岛素上加用餐时胰岛素的具体方案。预混胰岛素类似物可以有效的提供基础和餐时胰岛素,虽然有些患者可以通过每日注射1次胰岛素类似物使血糖达标,其他患者可能需要每日注射2次预混胰岛素类似物才能达标,必要时也可以通过增加一种类型的胰岛素而将注射次数增加至3次。医生应该根据SMBG值制定调整剂量的方案,有助于患者自我调整胰岛素剂量。同时需要强调的是接受胰岛素治疗的患者必须要接受剂量优化方案的培训,患者可以按照相应的流程自行调整预混胰岛素类似物的剂量。
[1] Garber AJ, Ligthelm R, Christiansen JS, et al.Premixed insulin treatment for type 2 diabetes:analogue or human.Diabetes Obes Metab.2007.9(5):630-9.
[2] Turner RC, Cull CA, Frighi V, et al.Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus:progressive requirement for multiple therapies (UKPDS 49).UK Prospective Diabetes Study (UKPDS) Group.JAMA.1999.281(21):2005-12.
[3] Tibaldi JM.Intensifying insulin therapy in type 2 diabetes mellitus:dosing options for insulin analogue premixes.Clin Ther.2011.33(11):1630-42.
[4] Inzucchi SE, Bergenstal RM, Buse JB, et al.Management of hyperglycaemia in type 2 diabetes:a patient-centered approach.Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD).Diabetologia.2012.55(6):1577-96.
[5] 中国2型糖尿病防治指南(2010年版).中国糖尿病杂志.2012.(01):81-117.
[6] Unnikrishnan AG, Tibaldi J, Hadley-Brown M, et al.Practical guidance on intensification of insulin therapy with BIAsp 30:a consensus statement.Int J Clin Pract.2009.63(11):1571-7.
[7] Buse JB, Wolffenbuttel BH, Herman WH, et al.DURAbility of basal versus lispro mix 75/25 insulin eff cacy (DURABLE) trial 24-week results:safety and eff cacy of insulin lispro mix 75/25 versus insulin glargine added to oral antihyperglycemic drugs in patients with type 2 diabetes.Diabetes Care.2009.32(6):1007-13.
[8] Rosenstock J, Ahmann AJ, Colon G, et al.Advancing insulin therapy in type 2 diabetes previously treated with glargine plus oral agents:prandial premixed (insulin lispro protamine suspension/lispro) versus basal/bolus (glargine/lispro) therapy.Diabetes Care.2008.31(1):20-5.
[9] Jain SM, Mao X, Escalante-Pulido M, et al.Prandial-basal insulin regimens plus oral antihyperglycaemic agents to improve mealtime glycaemia:initiate and progressively advance insulin therapy in type 2 diabetes.Diabetes Obes Metab.2010.12(11):967-75.