离子液体脱硫性能研究与应用进展
李红海,李 婧,王伟文,李建隆
(青岛科技大学化工学院,山东 青岛 266042)
中国大气污染属煤烟型污染,主要污染物之一是SO2,它给人类健康、地球生态环境以及社会经济都带来严重的影响和破坏。目前已有的烟气脱硫方法,如石灰/石灰石-石膏法、氨法和活性炭吸附法等,各有缺点,主要概括为吸收剂用量高、设备腐蚀性大、操作不稳定、存在二次污染以及硫资源回收利用率差等方面。因此,寻找吸收能力高、选择性能好、化学性能稳定、不易产生二次污染的新型吸收剂,为脱硫提供新途径仍是烟气脱硫领域亟需解决的问题[1]。
近年来,离子液体(ILs)作为环境友好型溶剂,在吸收SO2方面引起人们广泛关注。它具有一般脱硫剂无法比拟的优势:1)熔点低,液程宽,可实现在低温下吸收,高温下解吸SO2;2)蒸汽压低,避免了吸收剂因挥发而造成的损失和污染;3)具有分子可设计性;4)无二次污染;5)吸收剂可循环使用;6)硫资源回收利用率高。利用ILs脱除烟气中的SO2,是继传统干、湿法脱硫以及催化脱硫等常用技术的一次创新[2]。
1 离子液体吸收SO2的基础研究进展
吸收SO2的离子液体按阳离子不同可分为胍类、咪唑类和醇胺类等。目前国内外许多研究都集中于运用实验方法、量子化学计算方法和分子模拟方法选择合适的脱硫离子液体以及对吸收机理的探索。
1.1 离子液体吸收SO2的试验研究
目前,传统的试验尝试法仍是寻找脱硫离子液体的主要途径。首先合成目标离子液体,将其置于模拟烟气或纯SO2气体吸收装置中进行脱硫实验。根据得到的ILs吸收与解吸循环的实验数据,判断该ILs对SO2的吸收效果,通过改变实验条件,运用红外、核磁光谱、拉曼光谱等方法对吸收前后ILs分析推测其反应机理。
运用试验方法的研究已十分广泛。Wu等[3]首次用胍类离子液体[1,1,3,3-四甲基胍乳酸盐(TMGL)]吸收模拟烟气中的SO2,对比吸收SO2前后ILs的红外光谱(FTIR)和核磁共振(NMR)谱图以及元素分析方法,认为低压下该ILs主要通过化学吸收,高压下有物理和化学两种吸收方式。Huang等[4]用氧化丙烯制备阳离子带有羟基烷基链的改性胍类离子液体,研究其脱硫性能,发现该ILs吸收性能更加优越。通过实验和光谱分析研究了阴阳离子对吸收的影响,发现阳离子上游离(键与SO2之间的范德华力对吸收的影响更大。

张锁江等[11-12]合成并研究了一系列醇胺类离子液体对吸收SO2的吸收性能,阴阳离子对吸收影响的顺序为:乳酸>醋酸>甲酸,乙醇胺>三乙醇胺>二乙醇胺。对比吸收前后ILs的红外光谱,作者认为,在醇胺类离子液体的脱硫过程中,同时存在物理吸收和化学吸收,SO2分子与—NH形成N—S键。席俊松[13]合成了一系列环胺甲酸盐和多氮胺甲酸盐,研究了它们对SO2的吸收和解吸性能。结果发现随着阳离子中氮数量的增加,吸收量也相应的增加。此外,对比研究了两种季铵盐AOHNR3和AHNR3脱硫性能,发现与AOHNR3相比,AHNR3对SO2的平衡吸收量更多,循环稳定性更好,因此,不带羟基的AHNR3更有利于SO2的吸收。李学良等[14]对阴离子进行了调整,合成了1种胺的二元羧酸盐,结构见图1所示,式中R1、R2、R3、R5、R6、R7选自C1~C8的羟基或取代羟基或为氢,R4选自CnH2n-2或者CmH2m的羟基或取代羟基,其中n=2~8、m=0~8。用其进行脱硫实验发现,平衡时SO2在该吸收剂中的物质的量比为2∶1,并有极高的选择性。其中,一部分吸收剂在吸收SO2后发生相变,产生固体,易于分离。
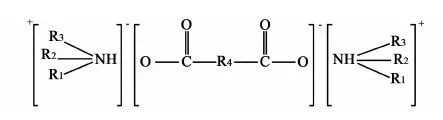
图1 一种胺的二元羧酸盐Fig.1 An amine dicarboxylic salt
1.2 离子液体吸收SO2的模拟研究
量子化学计算和分子模拟为从微观角度研究离子液体的分子结构、内部的相互作用以及与SO2的相互作用,为离子液体吸收SO2的实验研究提供理论指导,它不仅提供了很多实验无法得到的微观结构信息和化学变化过程的细节,也减少了直接通过实验方法研究的盲目性和不确定性。
Wang等[15]用全原子力场分子动力学研究了TMGL与SO2的作用,表明阳离子上的N—H键和阴离子上的氧原子是吸收SO2的主要活性位,而阴离子作用更强。同时,对比研究该ILs与CO2的作用,发现TMGL与SO2的结合力更强,从而解释了该ILs对SO2/CO2体系有很好的选择性。Siqueira等[16]和Ando等[17]分别采用从头计算分子动力学和拉曼光谱分析研究了[BMIM]Br和[BMIM]Br-SO2系统,从分子角度解释了少量SO2气体导致[BMIM]Br相态由晶体状向液态转变,物性黏度降低,导电性增强的现象,认为这是SO2降低[BMIM]Br的长程序列造成的,但未涉及到SO2与阴阳离子之间的关系。Prasad等[18]从分子水平研究了SO2、CO2和N2与ILs的相互作用,发现阴离子与气体之间的相互作用顺序与ILs对气体的吸收能力顺序一致,而阳离子咪唑环上的氢键对气体吸收也有影响,但小于阴离子的影响。
邢旭伟等[19]采用第一密度泛函理论(DFT)计算研究了[PF6]-、[BF6]-和[Tf2N]-3种阴离子对SO2的吸附行为,对吸附能、电荷转移和振动频率分析得知,阴离子主要以物理吸附的方式与SO2作用,吸附能力强弱顺序为[BF6]->[Tf2N]->[PF6]-,因此,SO2在离子液体中的溶解度与SO2和阴离子之间的相互作用强弱有关。李学良等[20]采用密度泛函理论(DFT)研究了羟烷基胺离子液体(HyAA ILs)与SO2的相互作用,通过几何优化、电荷分布和热力学参数计算确定能够有效吸收SO2的官能团,结果表明,在吸收SO2过程中,ILs的分子结构发生改变,标准吉布斯自由能变(△GΘ)主要取决于阳离子的结构和分子质量。王勇等[21]运用量子化学和分子动力学模拟方法对TMGL的空间几何结构、离子对的相互作用模式及阴阳离子和SO2分子之间的作用模式进行了系统的研究,发现乳酸根(LAC)阴离子中的氧原子与SO2分子中的硫原子之间存在着非常强的相互作用,可能是SO2在TMGL离子液体中有较好溶解性能的关键因素。同时,SO2气体的溶解对离子液体结构没有产生明显的影响,可能是由于气体分子主要存在于胍类离子液体间的空隙中。
2 离子液体吸收SO2应用研究进展
一些离子液体对SO2具有很好的选择性吸收/吸附作用,这为SO2的分离与纯化提供了新的途径。然而其较高的黏度、昂贵的价格限制了工业应用。因此,人们在研究合成新的具有高脱硫能力的功能化离子液体的同时,也在对其应用形式进行探索。目前离子液体脱硫的应用形式主要有循环吸收法、合成离子液体聚合物、膜接触器、离子液体支撑液膜以及硅胶负载等。
2.1 离子液体循环吸收技术
一些离子液体在常温下对SO2具有很高的吸收能力,高温下可以解吸实现离子液体再生,从而达到循环脱除和回收SO2的目的。目前,国内外关于实验室条件下对离子液体循环吸收SO2性能的研究很多。吕芳[22]采用鼓泡反应器对醇胺类离子液体脱硫性能进行了研究,考察了吸收温度、吸收时间、气体流速以及离子液体使用次数对离子液体脱硫性能的影响,同时也对离子液体再生性能进行了研究。结果发现在相同气体流速下,降低温度对脱硫有利,离子液体循环使用5次后脱硫效率直线下降。Kim等[23]提出了一种可循环操作的方法(见图2),实现用离子液体在特殊条件下从混合气体[ω(SO2)=40%~80%,ω(O2)=20%~60%]中分离和回收纯的SO2气体。吸收温度为20~50 ℃,解吸温度为120~150 ℃条件下。SO2的循环吸收率在85%~95%之间。
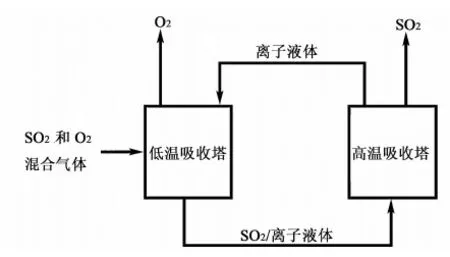
图2 离子液体循环吸收分离二氧化硫简图Fig.2 Schematic diagram of continuous absorption and separation process
离子液体循环吸收法脱硫工艺主要由烟气预洗涤系统、SO2吸收系统、离子液再生系统、离子液净化系统和SO2制酸等部分组成,工艺流程见图3[24]。
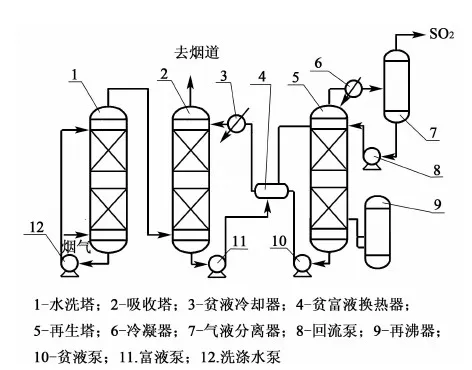
图3 脱除SO2工艺流程示意图Fig.3 Process flow diagram of removal of SO2
该工艺工程化试验已经开始,然而,目前工业应用仍处于起步阶段。2007年在攀钢173.6 m2烧结机上,离子液体循环吸收烟气脱硫技术首次在国内进行现场试验和工程化应用尝试,试验连续3 d的在线监测数据表明3 d平均脱硫效率都超过了99%。2008年7月和12月,在内蒙紫金锌业公司和攀钢173.6 m2烧结机上,各有1套处理能力分别为88 000和550 000 Nm3/h的离子液体循环吸收烟气脱硫装置建成投产。从运行及停机后的检查情况来看,系统运行连续稳定、脱硫效率较高、离子液体物化性能稳定。然而,存在离子液体稀释、能源消耗量大、设备腐蚀、堵塞和酸雾等问题需要解决[25]。
2.2 离子液体聚合物
固态聚合物脱硫剂在实际应用方面有优势,将可聚合基团引入到离子液体结构中,可得到离子液体聚合物。安东等[26]设计并由1,1,3,3-四甲基胍丙烯酸盐通过自由基(共)聚合反应合成了可聚合的新型离子液体,即线性和交联离子聚合物-聚(丙烯酸1,1,3,3-四甲基胍)(PTMGA)(如图4)及其交联的PTMGA-CL共聚物颗粒,研究了它们对SO2的吸收/解吸特性以及吸收机理。
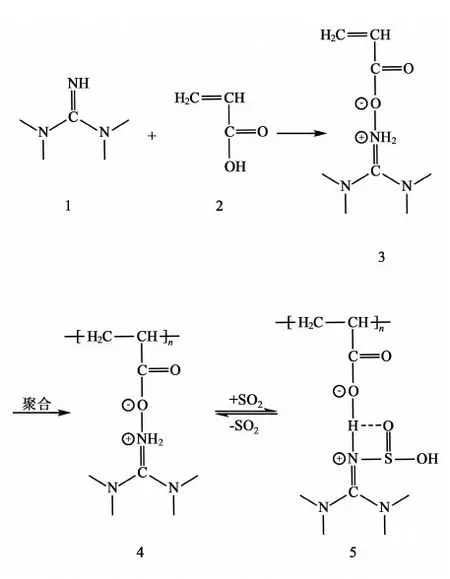
图4 TMGA和PTMGA的合成以及PTMGA可能的化学吸收机理Fig.4 Synthesis of TMGA and PTMGA and possible chemical absorption mechanism of PTMGA
试验发现,PTMGA对SO2的吸收能力、吸收速率以及选择性都比相应液态单体高,在真空和高温条件下可以有效解吸,实现可循环操作。为克服可溶于水的PTMGA在脱硫过程中体积缩减的缺点,作者采用反相悬浮聚合方法制得了交联的PTMGA-CL共聚物多孔颗粒。PTMGA-CL不仅具有与PTMGA相似的脱硫能力,而且不溶于水,在脱硫过程中可以保持颗粒的形态。同时,对比分析脱硫前后聚合物的光谱,发现聚合物对SO2的吸收既有物理过程又有化学过程。
2.3 离子液体膜接触器技术
膜接触器由中空纤维膜组件构成,气体通过壳程,离子液体通过管程,气体扩散通过膜被离子液体吸收。使用膜接触器不仅实现了气、液流速独立控制,而且避免了气液直接接触产生拖曳现象而造成溶剂的损失。
Luis等[27]用N,N-二甲基苯胺(DMA)和1-乙基-3-甲基咪唑硫酸二乙酯(EMISE)在陶瓷中空纤维膜接触器中进行脱硫试验,并研究了CO2对SO2吸收的影响。结果表明由于DMA对SO2吸收具有高选择性,CO2的影响可以忽略,不论混合气中是否有CO2,脱硫效率都在50%左右,质量传递系数大约为1.10×105m/s。然而采用EMISE作为吸收剂时,CO2和SO2在吸收过程中产生竞争,CO2对脱硫效率和质量传递系数都产生影响,加入CO2后脱硫效率由14%减少至10%,质量传递系数由0.338×105m/s减少至0.253×105m/s,可见该离子液体脱硫效率不高,其质量传递系数低于DMA,然而,它却避免了吸收剂因挥发而造成的损失。此外,将试验所得的质量传递系数与膜孔不润湿和全润湿的操作模型计算值进行对比,建立了膜孔部分润湿的质量传递操作模型。采用DMA和EMISE作为吸收剂时,由于黏度等因素,膜孔润湿率分别为74%和4%,这说明EMISE不易润湿膜孔。然而,过程的强化仍需考虑膜长期应用的稳定性以及选择更有效的离子液体或者离子液体混合物吸收剂来验证。
2.4 离子液体支撑液膜技术
使用离子液体支撑液膜(SILM)对SO2进行选择性分离具有稳定性高、选择性好以及吸收剂用量少3个优点。这种结合不仅克服了SILM上溶剂易挥发/分散到毗邻相的缺点,也为ILs吸收SO2提供了新的应用形式。
江滢滢[28-29]将[EMIM][BF4]、[BMIM][BF4]、[BMIM][PF6]、[HMIM][BF4]、[BMIM][Tf2N]和[EMIM][CF3SO3]6种咪唑类离子液体负载在聚醚砜微孔膜上形成离子液体支撑膜(SILM),研究了SO2在SILM的渗透性和选择性,发现SO2在SILM上的渗透性与ILs对SO2的吸收能力、气体分压、吸收温度、ILs的结构及黏度、密度和水含量等因素有关。在其它因素相似或相同的条件下,渗透性随着ILs黏度的增加而减少,随着温度和操作分压的增大而非线性增加。通过试验对比,作者认为SO2的渗透率仅取决于SO2在ILs中的扩散,而影响扩散的主要因素是ILs的黏度。此外,阳离子对气体渗透率影响极小,而阴离子影响较大。在阳离子不变条件下,[Tf2N]-提高了N2、CH4和CO2的渗透率,[CF3SO3]-促进了SO2的渗透率而[PF6]-减少了其渗透率。这与[CF3SO3]-具有更强的水蒸气吸收能力有关,水的存在可能会对酸性气体在SILM中的传递起促进作用。另外,作者用溶解-扩散模型定性分析了SO2在SILM上的渗透率。在SO2/N2、SO2/CH4和SO2/CO2的选择性研究中,可以发现SO2/N2和SO2/CH4的选择度可以达到144~223,SO2/CO2的选择度也可达到10~20。与渗透性相比,选择性的影响因素更为复杂,例如膜间压差、离子液体物性、操作温度和压力等需要进一步探讨。
Luis[30]研究了由[MIM][ace]、[BIM][ace]和亲水性、疏水性聚偏氟乙烯膜(PVDF)构成的离子液体支撑膜的脱硫性能。研究发现,亲水性PVDF膜负载ILs量更多,SO2和CO2在[BIM][ace]亲水性SILM中的渗透率最大,CO2的渗透率为204.1×10-11m2/s,SO2-Air [(SO2)=10%]中SO2的渗透率为33.6×10-11m2/s;[MIM][ace]亲水性SILM的选择性最好,CO2/Air的选择度为37.0,SO2-Air [x(SO2)=10%]/Air的选择度为10.8。然而,作者未解释膜的亲水性对酸性气体选择渗透的影响。
2.5 离子液体负载化
负载化离子液体颗粒兼具离子液体和多孔颗粒的特性,在脱硫方面更具优势,主要表现为:1)力学性能高;2)使用温度高;3)孔隙率和比表面积大;4)载体成本低、负载量大。另外可以将离子液体的黏度较高的缺点转化为离子液体与载体之间强附着力的优点。
Zhang等[31]通过浸渍-提取方法将TMGL负载在硅胶颗粒上进行吸收SO2试验,与单独使用TMGL和硅胶颗粒脱硫的试验结果对比发现,吸收SO2能力排序为,TMGL-SiO2≈TMGL>SiO2,但解吸时TMGL-SiO2中有SO2残余,而单独的SiO2可以完全解吸,这表明SO2与TMGL的作用力强于与SiO2的作用力。另外,对比不同负载比例[m(TMGL)∶m(SiO2)]下硅胶颗粒的脱硫性能发现,负载后硅胶颗粒吸收SO2能力明显提高,然而随着负载比例的增加,吸收量减少。作者认为主要原因是随着负载比例的增加,颗粒中纳米结构孔的表面积减少,从而吸收量也减少。在选择性方面,相对于单独的TMGL,TMGL-SiO2对SO2的吸收能力没有改变[平衡时n(SO2)∶n(TMGL)为2.8∶1.0],然后对CO2、N2和H2的吸收能力均减少,因而选择性有了明显提高。此外,作者研究了对比负载TMGL前后硅胶颗粒孔结构发现负载后颗粒中空域体积、特殊表面积和多孔性都减少,但是增加了平均孔半径和表观密度。
3 结论和展望
量子化学计算和分子动力学模拟从微观角度加深对离子液体结构及与SO2作用机理的理论认识,可以充分发挥离子液体可设计性优点,为实验研究提供理论指导。膜接触器、支撑液膜、离子液体聚合物和离子液体负载化等方法对离子液体的需求量使用量少,脱硫效果好,使用方便且稳定好,并可以克服离子液体成本高,黏度大等缺点,是很有潜力的工业化应用形式。
参考文献:
[1]韩志飞,芮玉兰.功能化离子液体吸收SO2研究进展[J].化工生产与技术,2009,16(5):29-32
[2]张春艳,潘志彦.离子液体在环境保护中的应用及潜在危害[J].现代化工,2009,29(3):88-90
[3]WU W,HAN B,GAO H,etal.Desulfurization of flue gas:SO2absorption by an ionic liquid[J].Angew Chem Int Edit,2004,43(18):2 415-2 417
[4]RASMUSSEN S B,HUANG J,RIISAGER A,etal.Flue gas cleaning with alternative processes and reaction media[J].ECS Transaction,2007,3(35):49-59
[5]ANDERSON J L,DIXON J K,MAGINN E J,etal.Measurement of SO2solubility in ionic liquids[J].J Phys Chem B,2006,110(31):15 059-15 062
[6]周丹桂,华一新.离子液体对气体的溶解性研究进展[J].化学工业与工程技术,2009,30(5):34-39
[7]HUANG J,RIISAGER A,WASSERSCHEID P,etal.Reversible physical absorption of SO2by ionic liquids[J].Chem Commun,2006:4 027-4 029
[8]BARROSSE-ANTLE L E,HARDACRE C,COMPTON R G.SO2saturation of the room temperature ionic liquid[C2mim][NTf2] much reduces the activation energy for diffusion[J].J Phys Chem B,2009(113):1 007-1 011
[9]LEE K Y,KIM H S,KIM C S,etal.Behaviors of SO2absorption in BMIM OAC as an absorbent to recover SO2in thermochemical processes to produce hydrogen[J].International Journal of hydrogen energy,2010(35):10 173-10 178
[10]LUIS P,AFONSO C A M,COELHOSO I M,etal.Ionic liquids as efficient solvents for sulfur dioxide recovery[C]∥Proceeding of the 23rd European Symposium on Applied Thermodynamics,2008(ISBN:2-9052 67-59-3)
[11]YUAN X,ZHANG S,LU X.Hydroxyl ammonium ionic liquids: Synthesis, properties and solubility of SO2[J].J Chem Eng Data,2007(52):596-599
[12]何川,钟秦,杜红彩,等.微波法合成醇胺类离子液体及其吸收SO2研究[J].化学工程,2009,37(2):8-11
[13]席俊松.可循环使用的离子液体型脱硫剂的合成与研究[D].合肥:合肥工业大学,2009.
[14]李学良,席俊松,罗梅,等.一种绿色高效可循环的SO2气体吸收剂及其制备方法:中国,101264414A[P].2008-09-17
[15]WANG Y,PAN H,LI H,etal.Force field of the TMGL ionic liquid and the solubility of SO2and CO2in the TMGL from molecular dynamics simulation[J].J Phys Chem B,2007,111(35):10 461-10 467
[16]SIQUEIRA L J A,ANDO R A,BAZITO F F C,etal.Shielding of ionic interactions by sulfur dioxide in an ionic liquid[J].J Phys Chem B,2008(112):6 430-6 435
[17]ANDO R A,SIQUEIRA L J A,BAZITO F C,etal.The sulfur dioxide-1-butyl-3-methylimidazolium bromide interaction:Drastic changes in structural and physical properties[J].J Phys Chem B,2007,111(30):8 717-8 719
[18]PRASAD B R,SENAPATI S.Explaining the differential solubility of flue gas components in ionic liquids from first-principle calculations[J].J Phys Chem B,2009(113):4 739-4 743
[19]邢旭伟,姚淑娟,周成刚,等.几种常见离子液体阴离子吸附SO2行为的DFT计算[J].武汉大学学报:理学版,2008,54(2):162-166
[20]李学良,陈洁洁,罗梅,等.羟烷基胺功能化离子液体吸收SO2的量子化学计算[J].物理化学学报,2010,26(5):1 364-1 372
[21]王勇.离子液体的结构及其相互作用研究[D].浙江:浙江大学,2007
[22]吕芳.碱性离子液体的制备和脱硫性能的研究[D].河北:河北科技大学,2009
[23]CHANG S K,GYEONG T G,KYE S Y,etal.Method for separation and recycle of pure sulfur dioxide from a gaseous mixture in is cycle with ionic liquids:US,7749475B2[P].2010-07-06
[24]王姣,岳焕玲,孟昭华.离子液循环吸收法有色冶炼烟气脱硫新技术[J].有色设备,2008(3):5-7
[25]王睿,裴家伟.离子液循环吸收烟气脱硫技术及其应用前景[J].烧结球团,2009,34(2):5-10
[26]AN D,WU L,LI B,etal.Synthesis and SO2absorption/desorption properties of poly(1, 1, 3, 3-tetramethylguanidine acrylate)[J].Macromolecules,2007,40(9):3 388-3 393
[27]LUIS P,GAREA A,IRABIEN A.Zero solvent emission process for sulfur dioxide recovery using a membrane contactor and ionic liquids[J].Journal of Membrane Science,2009(330):80-89
[28]JIANG Y,ZHOU Z,JIAO Z,etal.SO2gas separation using supported ionic liquid membranes[J].J Phys Chem B,2007,111(19):5 058-5 061
[29]JIANG Y,WU Y,WANG W,etal.Permeability and selectivity of sulfur dioxide and carbon dioxide in supported ionic liquid membranes[J].Chin J Chem Eng,2009,17(4):594-601
[30]LUIS P,NEVES L A,AFONSO C A M,etal.Facilitated transport of CO2and SO2through supported ionic liquid membranes(SILMs)[J].Desalination,2009(245):485-493
[31]ZHANG Z,WU L,DONG J,etal.Preparation and SO2sorption/desorption behavior of an ionic liquid supported on porous silica particles[J].Ind Eng Chem Res,2009,48(4):2 142-2 148

