鞘内移植神经干细胞对慢性缩窄性损伤模型大鼠脊髓背角和背根神经节胶质细胞源性神经营养因子表达的影响
张民皓,张红,胡玉萍,刘清珍,李伟伟,胡益民,李伟彦
0 引言
NSC作为一种神经组织特异性前体细胞,来源丰富,增殖、分化能力强,能整合于宿主细胞,易于基因修饰,极低或无免疫源性,无致瘤性等,是中枢神经系统基因治疗的理想载体[1]。NSC分泌的多种神经营养因子(neurotrophic factors,NF)对神经系统的生长发育和成熟有重要的影响,如神经元存活、轴突生长、突触可塑性和神经传递等,其中GDNF可能参与了神经损伤后修复过程并发挥重要作用[2]。有研究提示,移植到体内的NSC可以向病灶处迁移并促进中枢神经系统损伤动物的神经功能恢复[3]。一般治疗病理性疼痛方法很多,如某些药物[4-5]、补体活化途径[6]等,但通过移植NSC治疗神经病理性疼痛的研究还罕见报道。本研究通过观察鞘内移植NSC后坐骨神经CCI大鼠痛阈及脊髓背角、DRG GDNF的蛋白和mRNA表达变化,探讨NSC对大鼠神经病理性疼痛的作用。
1 材料与方法
1.1 NSC的制备、培养和鉴定出生1 d的SD乳鼠(由南京军区南京总医院比较医学科提供)按照无菌条件下取出全脑,眼科镊取海马,用胶头滴管吹打成细胞悬液,用DMEM/F12(1∶1)的无血清培养基[内含碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)20 μg/L,表皮生长因子(epidermal growth factor,EGF)20 μg/L,B27 20μl/L,L-谷氨酰胺2mmol/L,青霉素(1×105U/L)和链霉素1×105μg/ml]重悬细胞,置37℃、5%CO2孵育箱中培养。至第3代神经细胞球形成时,行神经上皮干细胞蛋白(Neuoepithelial Stem Cell Protein,Nestin)免疫荧光染色,同时用含10%胎牛血清的DMEM/F12培养液对神经细胞球进行诱导分化,然后以神经元和胶质细胞的特异性标记物神经丝微管蛋白(tubulin)及神经胶质酸性蛋白(GFAP)进行免疫细胞化学染色。
1.2 动物模型的建立及分组72只4~5周雄性SD大鼠,体重100~150g,饲养环境:清洁级、温度23℃、湿度50%、给予充足的食物和水源、12h明暗交替,术前禁食12h,不禁水,由南京军区南京总医院比较医学科提供,许可证号:(军)2007-012,使用许可证:SYXK(军)2007-029。随机均分为3组,A组(假手术+细胞培养液)、B组(CCI+细胞培养液)和C组(CCI+NSC),然后各组再随机分为:A1、B1和C1组(CCI后3d鞘内移植组)和A2、B2和C2组(CCI后10d鞘内移植组)。B、C组参照Bennett和Xie[7]的方法制作CCI模型,A组仅暴露坐骨神经,不结扎。
1.3 鞘内移植模型和细胞移植将第3代悬浮培养的NSC悬液,调整细胞浓度为1×106/30 μl,参照Mestre等人所建立的方法[8],采用微量进样器,分别于术后第3天、第10天,实验组注入30 μl的细胞悬液,空白组和对照组注入30 μl的细胞培养液。
1.4 机械痛阈和热痛阈的测定大鼠分别与术前1 d和术后1、3、7、14、21 d以机械测痛仪(Model 2390CE,ⅡTC Life Science Inc,美国)和热痛仪(Model 390,ⅡTC Life Science Inc,美国)测定MWT和TWL。
1.5 免疫组化染色大鼠在术后第7、14和21天测痛阈后,戊巴比妥腹腔注射麻醉,4%多聚甲醛灌注固定后,取右侧腰膨大脊髓背角及L5 DRG,常规固定,石蜡包埋。以ABC法作GDNF免疫组织化学染色,0.5%H2O2甲醛避光封闭15 min,PBS冲洗,抗原修复后加10%正常羊血清封闭30 min;鼠抗GDNF兔抗血清(1∶1000),湿盒内孵育1h,4℃过夜;生物素化IgG(1∶200)及ABC复合物(1∶100)湿盒内孵育各1 h;行DAB显色。400倍光镜下观察。
1.6 Real-time PCR检测
1.6.1 总RNA的抽取术后第7、14、21天在戊巴比妥麻醉下,取右侧脊髓及L5DRG,-70℃冻存。用总RNA抽提试剂盒(Invitrogen life technologies,美国)提取L5DRG总RNA,分光光度法对RNA的质和量鉴定。
1.6.2 逆转录合成cDNA反应总体积20 μl。退火混合物15.5 μl,包括RNA 2 μg,0.5 μg/μl Oligo dT 1 μl,dNTPs 1 μl,加无RNA酶的H2O至总体积15.5 μl;RT反应液4.5 μl包括10×RT缓冲液2 μl,DTT 1 μl,RNA酶抑制剂0.5 μl,莫洛尼鼠白血病病毒(Moloney murine leukemia virus,MMLV)反转录酶1μl。加4.5μl的RT反应液到15.5μl退火混合物中,37℃水浴60 min,70℃保温15 min,得到的RT终溶液即为cDNA溶液。
1.6.3 实时定量PCR扩增25 μl反应体系包括2×Rtmix 12.5 μl,模板(cDNA稀释10倍)1 μl,5μmol/L的PCR上下游特异引物1 μl,加水至总体积25μl,以梯度稀释标准模板作为标准曲线,在Rotor-Gene3000 Realtime PCR仪中扩增。引物用Primer 5.0软件设计,GDNF上游引物5′-AAATCGGGGGTGCGTCTTAACT-3′,下游引物5′-AACATGCCTGGCCTACCTTGTC-3′,PCR产物长度194bp;β-Actin上游引物5′-GCAGAAGGAGATCACAGCCCT-3′,下游引物5′-GCTGATCCACATCTGCTGGAA-3′,PCR长度136bp。反应条件:β-Actin:95℃,5 min;40个PCR循环(95℃,30s;60℃,30s;72℃,30s;72℃10min)。GDNF:95℃,5min;40个PCR循环(95℃,30s;60℃,30s;72℃,30s;72℃10min)。电泳图证实PCR扩增的特异性,经分析软件得到样品的Ct值和相应的拷贝数。
1.7 统计学分析应用SPSS 13.0统计软件处理数据。计量资料用均数±标准差(x±s)表示,各组MWT值、TWL值和GDNF mRNA和蛋白表达的组间比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 NSC培养及鉴定结果原代培养第3代的神经球,细胞形态规则,折光性强。取第3代的NSC行nestin检测,85%以上均成阳性反应,经胎牛血清诱导分化后,能够向胶质细胞及神经元方向分化。见图1。

图1 NSC培养及鉴定结果(×100)Figure 1 Results of cultivation and identification of NSCs(×100)
2.2 痛阈值的变化与A1组比较,B1、B2、C1、C2组大鼠术前1 d、术后1 d和21 d MWT和TWL值差异无统计学意义,术后3、7、14 d MWT和TWL均降低,其中7 d阈值最低(P<0.01)。与B1组比较,C1组术后7 d、14 d MWT和TWL明显上升(P<0.01)。与B2组比较,C2组术后14 d MWT和TWL明显上升(P<0.01)。与C1组比较,术后7、14 d C2组MWT和TWL较低(P<0.01),见表1。
2.3 免疫组化分析免疫组化结果显示,术后7 d、14 d、21 d GDNF在A组和B组大鼠脊髓和DRG中阳性细胞较少,移植NSC后C组阳性细胞表达明显增多,之后随时间推移逐渐减少。见图2、3。
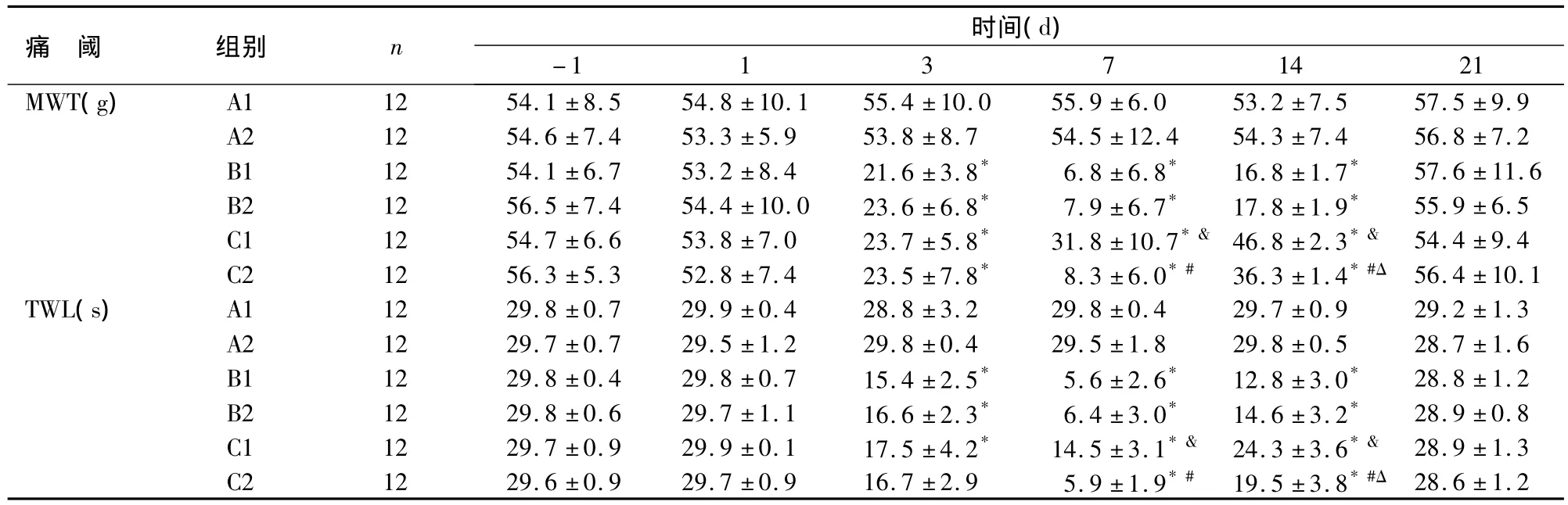
表1 大鼠MWT和TWL的变化(x±s)Table 1 Changes of MWT and TWL in rats(x±s)
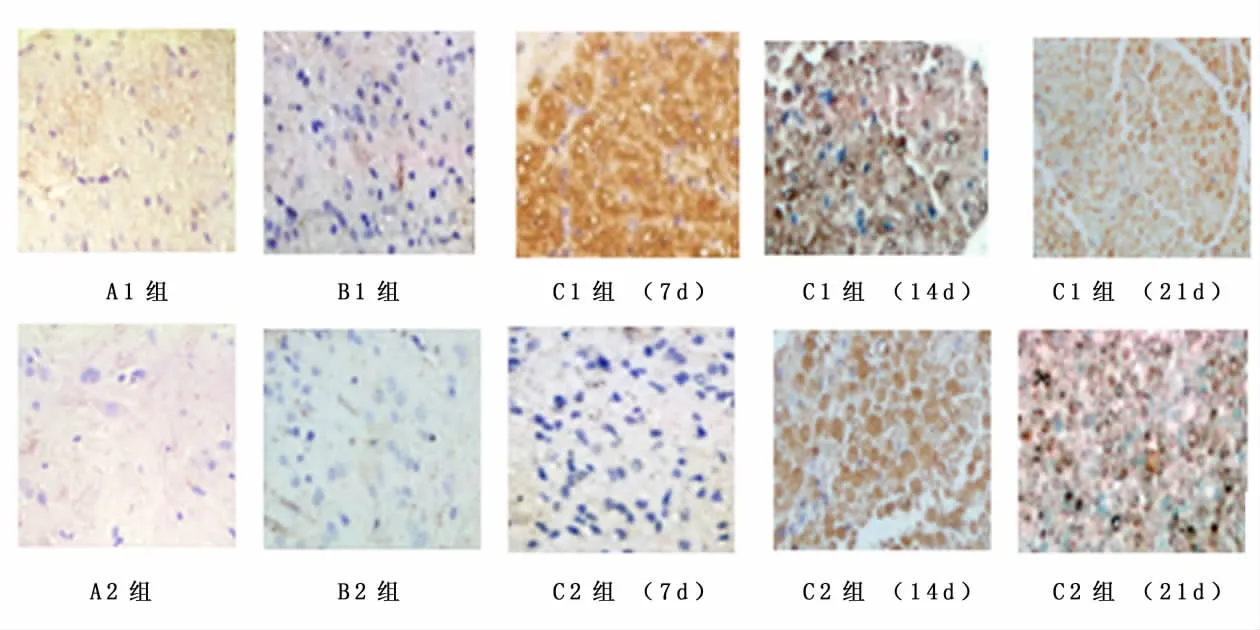
图2 术后7 d、14 d和21 d各组大鼠脊髓背角GDNF的蛋白表达(免疫组化法×400)Figure 2 Expressions of GDNF protein in the cornu dorsal medullae spinalis in different groups rats at 7,14 and 21d postoperatively(immunohistochemical stain×400)
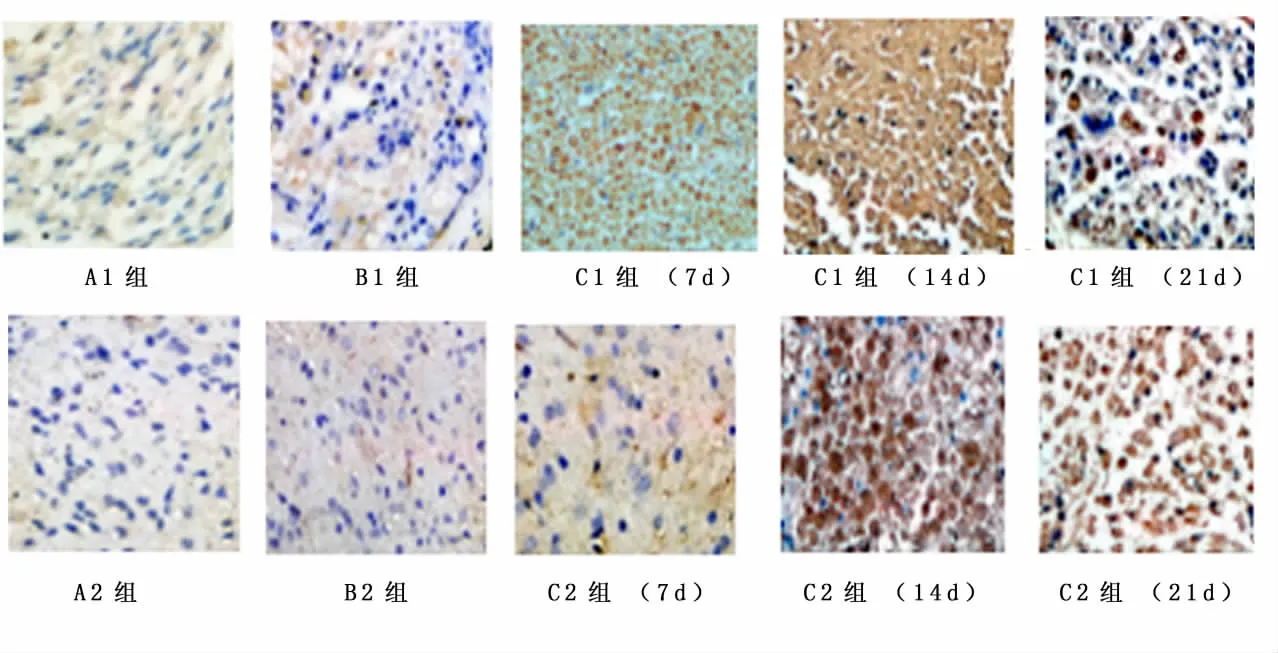
图3 术后7 d、14 d和21 d各组大鼠DRG GDNF的蛋白表达(免疫组化×400)Figure 3 Expressions of GDNF protein in the DRG in different groups rats at 7,14 and 21d post-operatively(immunohistochemical stain×400)
2.4 GDNF mRNA的表达变化GDNF和β-actin的PCR扩增产物的融解曲线显示两者都是单一峰型的曲线,无引物二聚体产生(图4、图5);证明扩增的PCR产物为特异性目的基因。扩增曲线呈明显的“S”型,说明用此引物通过荧光定量RT-PCR测定大鼠GDNF敏感性好(图6)。与B组比较,A组术后7、14 d和21 d各组大鼠脊髓背角、背根神经节GDNF的表达呈低水平(P<0.05);术后7 d,C1组脊髓背角和DRG中GDNF的表达量较B1组明显升高(P<0.05);术后14 d和21 d,C1、C2组脊髓背角和DRG中GDNF的表达量高于B1、B2组(P<0.05),见图7。

图4 GDNF溶解曲线Figure 4 GDNF solubility curve
图6 GDNF荧光定量扩增曲线Figure 6 Fluorescent quantitative amplification curve
3 讨论
CCI模型可测试伤害性的热刺激和机械刺激所引发的痛觉过敏及冷和触觉的痛觉异常,神经结扎后3~5d开始出现痛反应,7~10d达高峰,持续21d左右疼痛反应表现逐渐减退[9]。本实验在术后3 d和10 d进行鞘内移植NSC,意在探讨NSC在预防和治疗神经病理性疼痛中所起的作用。
本实验观察到与A组比较,B、C组术前1 d、术后1 d无明显改变,而术后第3 d开始出现显著的MWT和TWL的下降,痛觉增敏,持续至术后14、21 d后恢复正常,与以往的研究结果一致[13],说明模型稳定可靠。与B1组比较,C1组术后7、14 dMWT和TWL明显上升。与B2组比较,C2组术后14d MWT和TWL明显上升。与C1组比较,术后7、14 d C2组MWT和TWL较低。以上结果表明,在大鼠神经损伤的前后时间点给予NSC进行防治,效果显著,说明鞘内移植NSC可以明显抑制疼痛的发生和发展。
图5 β-actin溶解曲线Figure 5 β-actin solubility curve

图7 GDNF在DRG和脊髓背角的表达Figure 7 Expression of GDNF in the DRG and cornu dorsale medullae spinalisA1、C1组与B1组比较,#P<0.05;A2、C2与B2组比较,*P<0.05
多项研究已证实,NSC可有效促进损伤动物的神经功能恢复,然而其确切机制仍不甚明确,目前有2种主要假说,即替代学说和营养学说。替代学说认为,移植的NSC在病灶处分化为神经元或胶质细胞,替代原有坏死的神经细胞,从而促进神经功能恢复,但缺乏有力的证据证明移植的NSC可整合入宿主神经网络,因此单纯的替代学说尚不能解释NSC的修复机制。营养学说目前受到研究者的普遍关注,认为移植的NSC通过分泌或调节某种或几种NIF来促进损伤后神经功能的修复。本实验中,通过RT-PCR反应观察GDNF的mRNA表达变化,发现B、C组各数值普遍升高,且C组较B组升高明显;免疫组化结果显示,GDNF在A组和B组大鼠脊髓和DRG中阳性细胞较少,移植NSC后C组阳性细胞表达明显增多,之后随时间推移逐渐减少。GDNF是转化生长因子-B超家族的一员[10],对神经细胞的生存、增殖及分化具有重要作用的神经营养因子[11]。GDNF通过其特异的高亲和力受体GFRα-1和Ret依赖性信号通路及Ret非依赖性信号通路介导跨膜信号转导发挥生物学效应,在痛觉信号传导和调制中起重要作用,促进损伤神经元存活的同时,降低其异位放电率,阻止神经病理性疼痛的产生;有学者报导GDNF可能在痛觉信号传导和调制中起重要作用,外源性给予GDNF能够减轻疼痛,减少痛敏的发生[12-13]。
我们推测:GDNF参与了坐骨神经损伤引起的脊髓损伤再生增强过程,有效的促进了神经损伤的修复。本实验中,C组大鼠术后出现痛阈下降,同时DRG和脊髓背根中GDNF的表达增高,提示鞘内移植的NSC通过分泌或调节显著提高GDNF的表达,从而抑制了周围神经损伤产生的神经病理性疼痛的发生发展。
[1]Martino G,Pluchino S.The therapeutic potential of neural stem cells[J].Nat Rev Neurosci,2006,7(5):395-406.
[2]Cairns K,Finklestein SP.Growth factors and stem cells as treatments for stroke recovery[J].Phys Med Rehabil Clin N Am(S1047-9651),2003,14(Suppl1):135-142.
[3]Gao J,Prough DS,McAdoo DJ,et al.Transplantation of primed human fetal neural stem cells improves cognitive function in rats after traumatic brain injury[J].Exp Neurol(S0014-4886),2006,201(2):281-292.
[4]刘健,朱娟,管忍,等.己酮可可碱能减轻神经病理性疼痛大鼠痛觉过敏的发展[J].医学研究生学报,2009,22(1):24-27.
[5]杨建军,沈锦春,刘红军,等.加巴喷丁治疗大鼠腰5神经结扎后神经病理性疼痛的疗效及可能机制[J].医学研究生学报,2010,23(5):26-31.
[6]王金宝,聂发传,易斌,等.眼镜蛇毒因子对神经病理性疼痛干预效应的实验研究[J].医学研究生学报,2008,21(2):129-133.
[7]Bennett GJ,Xie YK.A peripheral mono neuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[8]Mestre C,Pelissier T,Fialip J,et al.A method to perform direct transcutaneous intrathecal injection in rats[J].J Pharmacol Toxicol Methods,1994,32(4):197-200.
[9]周秋雯,徐建国.慢性疼痛动物模型的研究进展[J].医学研究生学报,2008,21(6):638-641.
[10]Lin LF,Doherty DH,Lile JD,et al.GDNF:a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons[J].Science,1993,260(5111):1130-1132.
[11]Elder GA,de Gasperi R,Gamasosa MA.Research update:Neurogenesis in adult brain and neuropsychiatric disorders[J].Mt Sinai J Med(S0027-2507),2006,73(7):931-940.
[12]Boucher TJ,Okuse K,Bennett DLH,et al.Potent analgesic effects of GDNF in neuropathic pain states[J].Science,2000,290(5489):124-127.
[13]胡玉萍,胡益民,王昱,等.坐骨神经结扎大鼠脊髓背根神经节GDNF和NCAM表达的变化[J].临床麻醉学杂志,2010,26(5):427-429.

