PAX2小干扰RNA在UUO大鼠体内的筛选与鉴定
李 丽,王长山,吴玉斌
0 引 言
肾间质纤维化是各种慢性肾病发展至终末期肾功能衰竭的共同通路和重要原因[1]。迄今为止,许多学者通过体内外实验对肾小管间质纤维化虽进行了大量的研究,但对其发生、发展的机制尚未完全阐明。目前认为肾小管上皮-间充质细胞转化(epithelial-mesenchymal transition,EMT)在该过程中发挥重要作用[2]。UUO引起的肾梗阻是诱导肾纤维化最经典的模型[3]。
PAX2(Paired Box2)基因编码核转录因子,是肾胚胎发育过程中诱导间质-上皮转化(mesenchymal epithelial transition,MET)的关键性基因,参与胚胎肾发育各个阶段的调控[4]。近来发现,PAX2在病理肾中重新表达[5]。Cohen等[6]研究发现PAX2在小鼠UUO模型肾集合管再表达,并与集合管的细胞凋亡有关。我们前期的工作证实PAX2在大鼠UUO模型肾小管上皮细胞存在重新表达,与肾间质纤维化程度呈正相关,PAX2基因通过哪些途径作用于EMT,而促进肾间质纤维化的机制尚不明确[7]。因此,设想通过抑制PAX2的转录活性及其功能来探讨其与肾间质纤维化的联系是我们研究的焦点。
RNAi是在生物体内由外源性或内源性小分子双链(RNA double stranded RNA,dsRNA)引起同源性mRNA特异性降解,从而引起转录后基因沉默的一种现象[8]。RNAi技术具有高度特异性、高效性及低毒性等特点,目前,已有应用PAX2 siRNA治疗肾细胞癌的研究[9],但关于大鼠PAX2的RNAi在纤维化方面研究未见报道。由于针对同一靶基因的不同位点siRNA往往具有不同的沉默效率,因此,需进行靶位点的选择和优化,通常需设计至少3~4对siRNA,在其中筛选出效率最高的片段[10]。本研究采用RNAi方法,进行体内实验,为了防止siRNA被降解,本实验将利用UUO术后3 d模型,设计、筛选和鉴定出针对PAX2基因的沉默效果最佳siRNA,特异性抑制大鼠UUO模型中PAX2基因及其蛋白的表达,为深入研究肾纤维化的发病机制提供新的手段,为肾纤维化基因治疗开辟新的途径。
1 材料与方法
1.1 材料雄性SPF级4~6周Wistar大鼠60只,体重120~150 g,购自中国医科大学附属盛京医院实验动物中心,实验动物合格证号:SYXK(辽)2003-0019。Trizol总RNA提取液购于Invitrogen公司。PAX2兔抗大鼠单克隆抗体(一抗)购于美国Zymed公司。β-actin一抗和HRP标记羊抗兔IgG二抗均购于美国Santa Cruz。Real time quantitive PCR引物由TaKaRa大连宝生物工程有限公司设计合成。PrimeScriptTMRT Reagent Kit和Real time quantitive PCR(SYBRRPremix Ex TaqTM)试剂盒购于TaKaRa大连宝生物工程有限公司。蛋白裂解液购于上海吉凯基因化学技术有限公司。2'F修饰siRNA,由上海吉玛公司化学修饰合成。in vivo-jetPEI购于PolyPlus Transfection公司。脱脂奶粉购于完达山乳业股份有限公司。
1.2 方法
1.2.1 siRNA设计合成首先从NCBI数据库中获取大鼠PAX2基因编码序列全长(GeneID:293992,mRNA:NM_001106361),上海吉玛公司利用siRNA设计软件设计4对干涉靶点和随机的不靶向任何基因的阴性对照,同时合成1对FAM标记阴性对照,通过NCBI上的BLAST将潜在的siRNA靶位点序列和基因组数据库进行比较,确保与其他基因没有同源性,为增强稳定性和特异性,选择2'F修饰长度为21 bp、3'端2个碱基突出的siRNA,由上海吉玛公司化学修饰合成。siRNA序列见表1。
1.2.2 制作UUO动物模型20只Wistar大鼠分为假手术组(sham组)和模型组(UUO组),每组10只。UUO组以10%的水合氯醛(300 mg/kg)腹腔注射麻醉后,行左侧耻骨上切口,沿左肾下极寻找到左输尿管,用4-0号丝线上下结扎2处,从中剪断输尿管以防逆行感染,分层缝合关闭腹腔。sham组分离输尿管不结扎,随即缝合腹腔。大鼠于术后3 d处死,取左侧肾,置于4%多聚甲醛中固定,石蜡包埋,待做病理形态学检测。
1.2.3 病理形态学检测及鉴定①肾小管间质损伤程度判定:常规HE染色,光镜下观察肾间质纤维化、蛋白管型、肾小管扩张和肾间质炎细胞浸润程度判定肾小管间质损伤的程度。每个参数分为4个等级:0分为正常,1分为轻度受损,2分为中度受损,3分为重度受损,每个样本肾小管间质损伤评分总分为0~9分[11]。②肾间质纤维化定量分析:常规Masson染色,借助Image Proplus多媒体彩色病理图像软件定量分析肾间质纤维化程度。根据文献方法[12],每例切片取10个不重复的400倍视野,以蓝色胶原沉积为阳性,计算蓝染面积占整个视野的百分比,得出肾间质胶原面积与视野内肾小管间质总面积(去除肾小管管腔)的比值,取其平均值为每例切片的肾间质相对面积。

表1 siRNA序列Table 1 siRNA sequences
1.2.4 体内转染PAX2-siRNA(4个沉默点和FAM标记、未标记的阴性对照)与in vivo jetPEITM(N/P=5)复合物的配制严格按照操作说明进行,终体积均为200μl。将80μg siRNA粉末离心后加入5%葡萄糖100μl,充分混合;取8μl in vivo-jetPEITM加入5%葡萄糖92μl,充分混合;100μl in vivo-jet-PEITM立刻加入到100μl siRNA液体中(注意次序不能颠倒);室温孵育15 min;在制作模型后,立即将装有200μl PAX2-siRNA-invivo jetPEI复合物的微量注射器分别沿肾外缘上下极和肾两侧的中央4个注射点(每点50μl)注入肾被膜下,分层缝合关闭腹腔。根据siRNA的位点不同分为5组(siRNA1、siRNA2、siRNA3、siRNA4和阴性对照组,每组8只,大鼠于注射3 d后处死,取左侧肾,分离肾皮质和髓质,待进一步检测。
1.2.5 PAX2-siRNA-PEI肾内转染的鉴定PAX2-FAM-siRNA-PEI和PAX2-NC-siRNA-PEI肾内转染3 d后立即取左肾,OTC包埋,制作厚度为5μm冰冻切片(冷冻切片机LEICA,德国),采用荧光显微镜(OLYMPUS,日本)观察绿色荧光在肾的分布情况。
1.2.6 Real-time PCR检测PAX2 m RNA表达取5组大鼠肾皮质100 mg,采用Trizol(Invitrogen试剂公司提供)试剂,按说明书进行操作。用紫外分光光度计测260 nm/280 nm的吸光度比值及样本浓度,检测提取的RNA产量及质量。RNA逆转录反应体系,经37℃15 min,85℃5 s,逆转录合成cDNA,以此为模板用PAX2(mRNA:NM_001106361)引物经PCR方法进行扩增。引物序列见表2。
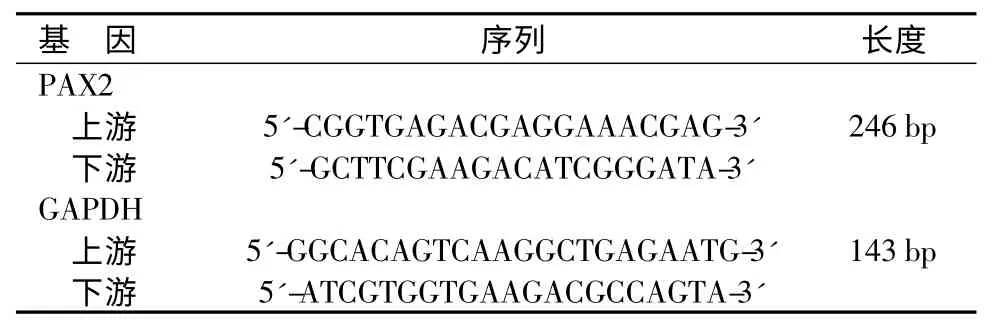
表2 引物序列Table 2 Primer sequences
扩增条件为:95℃10 s,95℃5 s,60℃34 s,共40个循环。融解曲线条件(ABI7500机器自行设定):95℃15 s,60℃1 min,95℃15 s。每个基因以预实验中Ct值最大的样品作为其标准品,用EAZY Dilution依次稀释成4个梯度,与样品同时扩增。应用ABI 7500 real-time PCR system(美国应用生物系统公司)荧光定量PCR仪根据标准曲线自动分析并显示结果,用△△CT法[13]进行计算。
1.2.7 W estern blot检测PAX2蛋白表达取5组大鼠肾皮质100 mg,加入裂解液500μl研磨,取出置EP管中,12000 r/min 4℃离心10 min,取上清液用BCA法检测样品蛋白质含量。50μg蛋白于SDS-聚丙烯酰胺凝胶中电泳,电转至PVDF膜。5%脱脂牛奶封闭4℃过夜,加PAX2(1∶500)以及内参β-actin(1∶500)37℃2 h;TBST洗膜3次,每次10 min;加HRP标记羊抗兔IgG(1∶2000,美国Santa Cruz提供),37℃2 h,洗膜;将适量DAB显色液平铺在二抗杂交后的膜上,室温避光放置,约3 min后可出现明显的棕褐色蛋白显色带。半定量方法分析肾皮质PAX2表达,将膜上条带扫描存入电脑,应用Quantity One-4.4.0凝胶成像分析软件分析,记录每条带的灰度值,结果用β-actin校正。
1.2.8 统计学分析定量数据采用均数±标准差(±s)表示,采用SPSS13.0软件进行分析,两独立组间均数比较采用t检验,2组方差不齐(P<0.10)时用校正t检验,P≤0.05为差异有统计学意义。
2 结 果
2.1 肾组织形态学改变
2.1.1 肾大体观察UUO组大鼠肾体积增大,灰白色、无光泽,表面不光滑,颗粒感明显,肾盂扩张,明显肾积水,肾盏乳头受压;sham组大鼠肾呈深红色,表面光滑,包膜完整,与肾实质不粘连,切面皮髓分界清晰。见图1。
2.1.2 光镜下肾病理改变采用HE染色观察,UUO组可见肾间质水肿,肾小管扩张,小管间质区域出现单核细胞、淋巴细胞浸润;肾小球未见明显病变;sham组大鼠肾小管结构正常、排列紧密整齐,间质未见增宽,无炎性细胞浸润,小管基膜光滑完整;2组肾小管损伤程度评分比较有统计学差异(P<0.05)。见图2、表3。
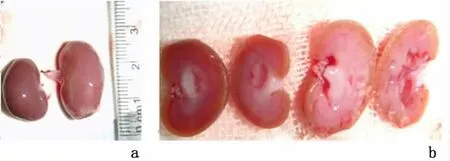
图1 肾组织的大体观察Figure 1 M acroscopic observation of the rat kidneys in the sham-operation and UUO groups
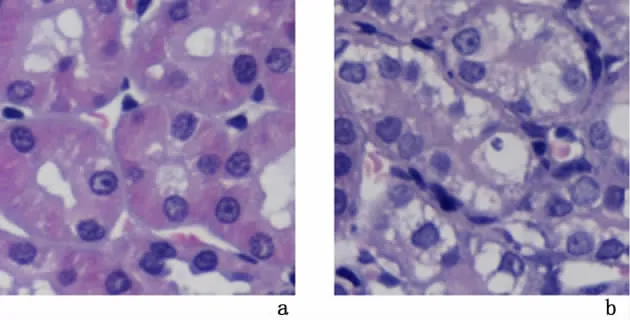
图2 光镜下肾病理改变(HE×400)Figure 2 Pathological changes of the rat kidneys in the sham-operation and UUO groups under the light m icroscope(HE×400)
2.1.3 肾间质纤维化改变采用Masson染色观察,UUO组可见肾间质增宽,胶原沉积,间质细胞及细胞外基质成分增多;sham组肾胶原染色主要位于小管基膜、肾小囊、系膜区和肾小管间的毛细血管周围,而小管周围间质染色较少。UUO组肾间质相对面积较sham组增高(P<0.05)。见图3、表3。

图3 肾间质纤维化改变(M asson×400)Figure 3 Renal interstitial fibrosis changes in the sham-operation and UUO groups(M asson×400)
表3 各组大鼠肾小管损伤程度和肾间质相对面积比较(±s)Table 3 Renal tubular injury and relative area of renal interstitia in the sham-operation and UUO groups(±s)

表3 各组大鼠肾小管损伤程度和肾间质相对面积比较(±s)Table 3 Renal tubular injury and relative area of renal interstitia in the sham-operation and UUO groups(±s)
与sham组比,*P<0.05
组 别 n 肾小管损伤评分(分)肾间质相对面积(%)sham组10 0.11±0.03 1.77±0.23 UUO组 10 2.50±0.27* 7.31±1.03*
2.2 PAX2-siRNA-PEI在肾组织内转染情况FAM-siRNA-PEI和NC-siRNA-PEI注射体内3 d后取肾,立即制作冰冻切片,放置于荧光显微镜下观察,注射FAM-siRNA-PEI的肾内可见肾小管周围存在绿色荧光(图4b),注射NC-siRNA-PEI的肾未见荧光(图4a)。

图4 荧光显微镜观察肾组织冰冻切片(×400)Figure 4 Fluorescence microscopy of the rat renal tissues(×400)
2.3 Real-time PCR检 测PAX2-siRNA-PEI对PAX2 mRNA的抑制效果同等剂量的4对化学合成的PAX2-siRNA(siRNA1、siRNA2、siRNA3、siRNA4)和阴性对照siRNA与in vivo jetPEI复合物转染UUO鼠体内3 d后取肾皮质,进行Real-time PCR检测。PAX2和GAPDH溶解曲线的溶解温度一致,说明产物特异,无引物二聚体和其他非特异性产物;通过扩增曲线与标准曲线所得的CT值,用2-△△CT法计算,结果转染后4对PAX2-siRNA-PEI肾皮质PAX2 mRNA的表达均有不同程度的抑制作用,分别为siRNA126%、siRNA248%、siRNA355%、siRNA445%。其中PAX2-siRNA3位点抑制效果最明显,说明PAX2-siRNA3是抑制PAX2 mRNA水平表达的最佳位点。见表4、图5。
表4 不同沉默位点siRNA对PAX2 m RNA和蛋白表达的影响(±s)Table 4 Expressions of PAX2 mRNA and protein inhibited by siRNA interference sequences(±s)

表4 不同沉默位点siRNA对PAX2 m RNA和蛋白表达的影响(±s)Table 4 Expressions of PAX2 mRNA and protein inhibited by siRNA interference sequences(±s)
mRNA/protein n NC siRNA4 siRNA3 siRNA2 siRNA 1 2-△△CT 8 1 0.55±0.037 0.45±0.031 0.52±0.045 0.74±0.051 PAX2/β-actin 8 1 0.505±0.031 0.19±0.023 0.92±0.0 35 0.93±0.037
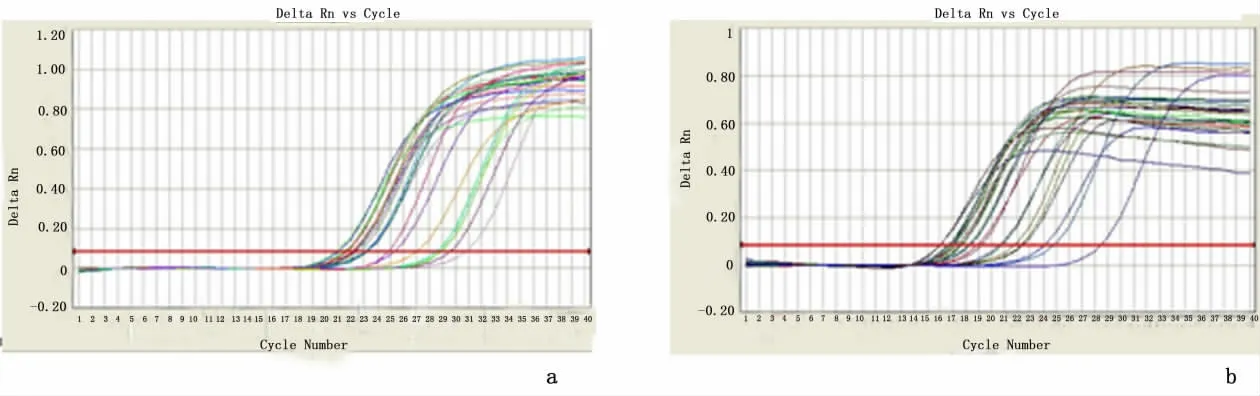
图5 实时荧光定量PCR法检测PAX2 m RNA的表达Figure 5 Real-time quantitative PCR analysis of the PAX2 m RNA expression
2.4 W estern blot检测PAX2-siRNA-PEI对PAX2蛋白的抑制效果免疫印迹法杂交结果显示,5条泳道均在43 000和46 000处各出现一条带,与预期的内对照β-actin和PAX2蛋白产物相吻合,说明两者均为特异性蛋白条带。其中β-actin条带的亮度相似,而PAX2条带的亮度各不相同,以阴性对照组PAX2蛋白相对表达量为100%,siRNA3组蛋白相对表达量减少了81%,抑制效果明显(P<0.01),这与Real-time PCR检测结果一致。见表4、图6。

图6 Western blot检测不同沉默位点siRNA对PAX2蛋白表达的影响Figure 6 W estern blot analysis of the expressions of PAX2 andβ-actin proteins in the model rats transfected w ith different PAX2-siRNAs
3 讨 论
RNAi作为一种新的基因阻断技术,具有高度特异性、高效性,高稳定性、低毒性等优点,已经成为研究基因功能的重要工具[15]。RNAi是通过双链RNA在细胞内特异性的诱导与之同源互补的mRNA降解而高效地阻断基因表达,从而引发基因转录后水平沉默的现象[14]。研究发现,长度为21 bp并且3'端有2个碱基突出的siRNA可以有效且特异性地引起哺乳动物的基因沉默[16]。体外化学合成的siRNA是应用最早、也是最经典的合成方法,其具有操作简便、实验时间短、得到的siRNA纯度和质量高、易标记以追踪其在体内的活动状况、对细胞的或者组织的毒副作用小、可大规模制备等优点。未经修饰的裸siRNA在体内容易被降解,半衰期短,无法维持有效药物浓度,为此需对其进行化学修饰。通过化学修饰的siRNA,可以提高活性和稳定性[17]、减少副作用和“脱靶”效应[18],同时增强对血清RNA酶的抵抗性[19]。本实验采用化学合成法选择长度为21 bp、3'端有2个碱基突出,同时2'F修饰的PAX2-siRNA,既增强siRNA体内稳定性,又保证了作用的特异性,增加RNAi在动物体内的干扰效果。
近几年RNAi已经广泛应用于哺乳细胞体外研究,随着研究的深入,如何把siRNA导入试验动物或是人体内研究却遇到一定困难,其中一个主要的挑战就是如何将siRNA安全而高效地递送到体内特定的靶器官或靶细胞[20]。目前用于基因治疗的载体可以分为2类:病毒性载体和非病毒性载体[21]。病毒性载体包括腺病毒载体、腺相关病毒、逆转录病毒载体、慢病毒载体等,病毒载体具有潜在毒性,如免疫原性可以诱导机体产生某种程度的免疫反应[22]、病毒基因产物对宿主细胞有一定的毒性、病毒基因组可能会随机整合入宿主基因从而使宿主基因表达异常等[23];并且病毒载体制备复杂、生产困难、不适于体内重复应用;另外病毒具有自我复制的功能,故人们对使用病毒的安全性存在顾虑。为了避免病毒载体的种种不利之处,人们开始致力于非病毒性载体的研究[24]。相对来说,非病毒载体无传染性及免疫原性、易于构建、可大量制备、稳定性好、安全性较高、使用方法简单易行等优点。在非病毒性载体中,阳离子聚合物多聚乙酰亚胺(polyethylenimine,PEI)是公认的体内外有效的传递基因和RNAi的转运工具[25-27],已被广泛用于多种器官[28-29],同时PEI具有相当高效的转染率[30]。此外,Bolcato-Bellemin研究显示在体内外PEI可有效的凝集、稳定传递化学修饰的siRNA[31]。本实验选用in vivo jetPEI体内转染试剂与化学修饰siRNA形成复合物,以增加转染率。为了有效的观察转染效果,选择FAM标记的siRNA与in vivo jetPEI结合注射到UUO大鼠肾被膜下,通过荧光显微镜已观察到在肾小管周围绿色荧光,说明采用大鼠肾被膜下注射PAX2-siRNA-PEI复合物可到达肾实质,从而为RNAi在动物肾的研究提供实验依据。
UUO模型具有制作简单、重复性好、成功率高、肾间质纤维化发生迅速的优点,是诱导肾纤维化最经典的模型,在梗阻3 d时即出现纤维化改变[3]。在本研究中,通过HE和Masson染色观察到尿路梗阻后肾纤维化表现:肾间质弥漫性巨噬细胞、淋巴细胞浸润,肾小管扩张,肾间质增宽、胶原纤维的沉积等。证明本实验UUO模型造模成功。
目前siRNA的设计多采用软件设计或从既有文献中获得。大鼠PAX2的RNAi方面研究尚未见文献报道。Yoshinari等[32]研究认为siRNA的序列起始位置错后1个或2个碱基,其抑制效果也大大降低,因此设计有效的siRNA是实验成功的一个关键因素。在没有一个权威性的siRNA“基因文库”给出经过验证的准确序列时,至少需要设计3~5对候选序列,平行实验筛选出最佳靶点,才能确保有效、特异的沉默效能。本实验设计合成4对PAX2-siRNA、并经2'F进行化学修饰,应用in vivo jetPEI体内转染试剂将4对siRNA转染大鼠肾被膜下,通过实时荧光定量PCR检测PAX2 mRNA抑制水平,结果4个沉默位点mRNA均有不同程度的抑制效果,其中PAX2-siRNA3位点抑制效果最明显;应用Western印迹法检测PAX2蛋白抑制水平,结果显示各位点蛋白均受到抑制,但PAX2-siRNA3位点蛋白表达量最低。结合以上结果,可充分验证siRNA3位点的设计最为理想,对PAX2干扰效果最强。因此,本实验成功筛选鉴定出1对有效抑制UUO大鼠肾小管上皮细胞PAX2表达PAX2-siRNA3。为了进一步研究PAX2蛋白在UUO中的表达及阻断PAX2表达对UUO进程的影响,进而明确PAX2在肾小管间质纤维化中的作用提供新的手段。
[1]Boffa JJ,Ronco P.Strategies to reverse fibrotic lesions of the kidney[J].Presse Med,2007,36(12 Pt 2):1857-1864.
[2]Chevalier RL.Chronic partial ureteral obstruction and the developing kidney[J].Pediatr Radiol,2008,38(Suppl 1):S35-40
[3]Picard N,Baum O,Vogetseder A,et al.Origin of renal myofibroblasts in the model of unilateral ureter obstruction in the rat[J].Histochem Cell Biol,2008,130(1):141-155.
[4]Narlis M,Grote D,Gaitan Y,et al.PAX2 and Pax8 Regulate Branching Morphogenesis and Nephron Differentiation in the Developing Kidney[J].J Am Soc Nephrol,2007,18(4):1121-1129.
[5]Lindoso RS,Verdoorn KS,Einicker-Lamas M.Renal recovery after injury:the role of Pax-2[J].Nephrol Dial Transplant,2009,24(9):2628-2633.
[6]Cohen T,Loutochin O,Amin M,et al.PAX2 is reactivated in urinary tract obstruction and partially protects collecting duct cells from programmed cell death[J].Am J Physiol Renal Physiol,2007,292(4):F1267-F1273.
[7]Li L,Wu Y,Zhang W.PAX2 re-expression in renal tubular epithelial cells and correlation with renal interstitial fibrosis of rats with obstructive nephropathy[J].Ren Fail,2010,32(5):603-611.
[8]Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[9]Hueber PA,Waters P,Clark P,et al.PAX2 inactivation enhances cisplatin-induced apoptosis in renal carcinoma cells[J].Kidney Int,2006,69(7):1139-1145.
[10]陈芳芳,李晓军,庞小娟,等.人分化抑制因子3基因靶向微小分子RNA表达载体的构建及筛选[J].医学研究生学报,2011,23(4):372-376.
[11]Taal MW,Zandi-Nejad K,Weening B,et al.Proinflammatory gene expression and macrophage recruitment in the rat remnant kidney[J].Kidney Int,2000,58(4):1664-1676.
[12]Mizuguchi Y,Miyajima A,Kosaka T,et al.Atrovastatin ameliorates renal tissue damage in unilateral ureteral obstruction[J].J Urol,2004,172(6 Pt 1):2456-2459.
[13]Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method[J].Nat Protoc,2008,3(6):1101-1108.
[14]Moffat J,Sabatini DM.Building mammalian signalling pathways with RNAi screens[J].Nat Rev Mol Cell Biol,2006,7(3):177-187.
[15]Kumar LD,Clarke AR.Gene manipulation through the use of small interfering RNA(siRNA):from in vitro to in vivo applications[J].Advanced Drug Delivery Reviews,2007,59(2-3):87-100.
[16]Yuen MF,Lai CL.Treatment of chronic hepatitis B[J].Lancel Infect Dis,2001,1(4):232-241.
[17]Bramsen JB,Laursen MB,Nielsen AF,et al.A large-scale chemical modification screen identifies design rules to generate siRNAs with high activity,high stability and low toxicity[J].Nucleic Acids Res,2009,37(9):2867-2881.
[18]Ui-Tei K,Naito Y,Zenno S,et al.Functional dissection of siRNA sequence by systematic DNA substitution:modified siRNA with a DNA seed arm is a powerful tool for mammalian gene silencing with significantly reduced off-target effect[J].Nucleic Acids Res,2008,36(7):2136-2151.
[19]Choung S,Kim YJ,Kim S,et al.Chemical modification of siRNAs to improve serum stability without loss of efficacy[J].Biochem Biophys Res Commun,2006,342(3):919-927.
[20]Pecot CV,Calin GA,Coleman RL,et al.RNA interference in the clinic:challenges and future directions[J].Nat Rev Cancer,2011,11(1):59-67.
[21]Liu F,Huang L.Development of non-viral vectors for systemic gene delivery[J].J Control Release,2002,78(1-3):259-266.
[22]Zaiss AK,Muruve DA.Immune responses to adeno-associated virus vectors[J].Curr Gene Ther,2005,5(3):323-331.
[23]Zhang S,Xu Y,Wang B,et al.Cationic compounds used in lipoplexes and polyplexes for gene delivery[J].J Control Release,2004,100(2):165-180.
[24]Behlke MA.Progress towards in vivo use of siRNAs[J].Mol Ther,2006,13(4):644-670.
[25]朱 役,贾绍昌,蔡 凯,等.靶向血管内皮生长因子的纳米颗粒制备及其对大肠癌细胞株SW620的作用[J].医学研究生学报,2011,24(10):1019-1022.
[26]Nimesh S,Chandra R.Polyethylenimine nanoparticles as an efficient in vitro siRNA delivery system[J].Eur J Pharm Biopharm,2009,73(1):43-49.
[27]Jere D,Jiang HL,Arote R,et al.Degradable polyethylenimines as DNA and small interfering RNA carriers[J].Expert Opin Drug Deliv,2009,6(8):827-834.
[28]Hassani Z,Francois JC,Alfama G,et al.A hybrid CMV-H1 construct improves efficiency of PEI-delivered shRNA in the mouse brain[J].Nucleic Acids Res,2007,35(9):e65.
[29]Liao HW,Yau KW.In vivo gene delivery in the retina using polyethylenimine[J].Biotechniques,2007,42(3):285-286,288.
[30]Akinc A,Thomas M,Klibanov AM,et al.Exploring polyethylenimine-mediated DNA transfection and the proton sponge hypothesis[J].J Gene Med,2005,7(5):657-663.
[31]Bolcato-Bellemin AL,Bonnet ME,Creusat G,et al.Sticky overhangs enhance siRNA-mediated gene silencing[J].Proc Natl Acad Sci USA,2007,104(41):16050-16055.
[32]Yoshinari K,Miyagishi M,Taira K.Effects on RNAi of the tight structure,sequence and position of the targeted region[J].Nucleic Acids Res,2004,32(2):691-699.
