水杨酸对中国红豆杉内生真菌代谢产紫杉醇的影响
陈文强 ,彭 浩 ,邓百万 ,解修超 , 刘开辉 ,丁小维 ,兰阿峰
(1.陕西理工学院 生物科学与工程学院,陕西 汉中723001;2.陕西省食药用菌工程技术研究中心,陕西 汉中 723001)
红豆杉(Taxaceae),俗称紫杉、赤柏松,为紫杉科紫杉属长绿针叶乔木,起源于古老的第三纪、第四纪冰川时期,曾广泛分布于北半球,现今其分布范围大大缩小。20世纪90年代以来,随着抗癌新药紫杉醇的开发利用,红豆杉原料供需矛盾日益突出,1999年我国将红豆杉属物种列入一级保护植物。目前,全世界共有11种,我国有5种,即东北红豆杉(Taxus cuspidata)、中国红 豆杉(Taxus chinensis)、南方红豆杉(Taxus chinensis var.mairei)、云南红豆杉(Taxus yunnanensis)、西藏红豆杉(Taxus wallichiana)。从红豆杉中提取的紫杉醇具有治疗恶性肿瘤、防治移植动脉硬化、抗瘢痕形成、抗血管生成、抗癌等作用[1-3]。由于红豆杉中紫杉醇含量非常低,加之红豆杉资源匮乏。因此,对紫杉醇的生产及其提高紫杉醇产量的研究有着重要的意义。
紫杉醇(paclitaxel,商品名Taxol)是仅存在于红豆杉科(Taxaceae)红豆杉属(Taxus)和澳洲红豆杉属(Austrotaxus)植物中的一种四环二菇酞胺类化合物[4-7]。它是一种新型的天然抗癌药物,以其高效、独特的抗癌机制受到了重视。但红豆杉内生真菌在正常生理条件下很难大量合成紫杉醇,药源严重短缺,加之市场对紫杉醇需求的日益增加,仅靠从红豆杉树皮中直接提取已不能满足需要,同时也对野生资源造成极大的破坏。因此,利用生物技术提高内生真菌代谢产紫杉醇是生产紫杉醇的有效途径之一。
真菌发酵液中添加合成紫杉醇的前体物质可提高产量。浆果赤霉素Ⅲ (BaccatinⅢ)、醋酸盐(Acetate)、 苯基丙氨酸 (Phenylalanine)、 苯甲酸(Benzoic acid)和亮氨酸(Leucine)是红豆杉内生真菌产生紫杉醇的有效前体物质,但是苯甲酸和亮氨酸不是合成紫杉醇的直接前体物质,苯甲酸(0.01 mmol/L)是产生紫杉醇的最佳激活剂[8-10],这说明了红豆杉与内生真菌产生紫杉醇的途径可能不同。
在真菌不同的发酵时期加入不同的糖类,同样可提高紫杉醇的产量。依据内生真菌的生长条件,根据不同的真菌选择合适的培养基,寻找最佳发酵条件。研究不同产紫杉醇真菌的生长条件,以提高紫杉醇的产量已成为目前重要的研究内容。水杨酸是植物体内普遍存在的一种酚类物质,作为植物抗病反应的重要信号分子,被认为是一种新的植物激素,可激活多种与抗病相关的植物防御机制[11-15],涉及并参与植物过敏反应 (hypersensitive response,HR)和系统获得抗性 (systemic acquire resistance,SAR)反应,在植物的抗病反应中起重要的作用。水杨酸在诱导子处理细胞以提高次生代谢物的研究中对细胞具有保护作用,一定程度上能够提高红豆杉细胞紫杉醇的产量[16-17]。目前,不同剂量的水杨酸(SA)在不同培养阶段添加对中国红豆杉内生真菌代谢产紫杉醇的影响尚无报道。因此,对秦巴山区中国红豆杉(Taxus chinensis)内生真菌在不同培养阶段,添加水杨酸的时间和剂量进行研究其代谢产紫杉醇的影响有着重要的意义。
1 材料与方法
1.1 材料
1.1.1 菌株 中国红豆杉内生真菌代谢产紫杉醇的菌株:陕西理工学院陕西省食药用菌工程技术研究中心提供。
1.1.2 固体斜面培养基 PDA培养基:马铃薯200.0 g,C6H12O615.0 g, 琼 脂 20.0 g,H2O 1000.0 mL。
1.1.3 液体发酵培养基 葡萄糖30.0 g,蛋白胨10.0 g, MgSO47H2O 3.0 g,维生素 B110 mg,KH2PO45.0 g,H2O 1000.0 mL。
1.1.4 培养条件 以液体发酵培养基为基本培养基,乙醇为助溶剂,配制不同浓度的水杨酸母液,采用过滤除菌方式加入培养液中,使最终加入到340.0 mL培养液中的水杨酸质量浓度分别为5.0、10.0、20.0、50.0 mg/L。
1.1.5 紫杉醇标准样 购自上海融禾医药科技有限公司,纯度>98.0%,批号 080309,规格 20.0 mg。
1.1.6 主要仪器与设备 ZHWY-B2112B型恒温培养振荡器:上海智城分析仪器制造有限公司;LSB50L型立式圆形压力蒸气灭菌器:上海医用核子仪器厂制造;RV10旋转蒸发仪:德国IKA;SHB-3型真空泵抽滤机:郑州杜甫仪器厂;TB-214型电子天平:北京赛多利斯仪器系统有限公司;LRH-250-GS型人工气候箱:广东省医疗器械厂;HP-1100高效液相色谱仪:美国安捷伦公司。
1.2 方法
1.2.1 内生真菌的活化 取冰箱中保存的原菌株,置于室温2~4 h,然后转接到PDA斜面培养基上,28℃恒温培养4~5 d使菌种活化。
1.2.2 内生真菌菌丝干重的测定 将发酵液用真空泵抽滤,并用无菌水洗涤菌丝后置于烘箱中,40℃烘干至恒重、电子天平精密称重。
1.2.3 内生真菌的生长曲线 将活化的菌种接种到液体发酵培养基中(50.0 mL培养液/250 mL三角瓶)进行培养,3 d后,取5.0 mL液体种子菌转入发酵培养基(340.0 mL培养液/500 mL三角瓶)中进行培养。培养条件为28℃、200 r/min,定期测定菌丝干重和紫杉醇质量浓度,并绘制内生真菌的生长曲线。
1.2.4 水杨酸的过滤除菌 用聚丙烯材料制成的孔径0.22 μm的水溶性微孔滤膜过滤[18]。
1.2.5 水杨酸添加试验 采用单因子试验,用5.0 mg/L的水杨酸分别在0 d、对数期初期、稳定期初期加入培养液中,进行最佳诱导时间试验。然后,分别将水杨酸以 0、5.0、15.0、25.0、35.0、45.0 mg/L 的质量浓度在同一时期添加到培养液中,进行最佳水杨酸添加质量浓度试验。
1.2.6 紫杉醇提取与纯化 取菌丝1.0 g均质5 min后甲醇抽提,抽提液离心,收集上层液用旋转蒸发器蒸干,加入等体积水和二氯甲烷抽提,弃水相,收集有机相,再次蒸干,所得粉末溶于少量甲醇中,上80~100目硅胶柱进一步分离纯化。将发酵液4 000 r/min离心,取上清液于60℃旋转蒸发至1/10体积后,加入等体积的乙酸乙酯超声振荡萃取1 h,收集乙酸乙酯相,并于 50℃旋转蒸发至干,加入适量氯仿溶解洗涤固体物,并于70℃旋转蒸发至干,再加入适量甲醇溶解,最后合并含紫杉醇的甲醇溶液。
1.2.7 紫杉醇的HPLC测定及SA影响的测定 色谱条件以甲醇-乙腈-纯水(体积比 35∶32∶33)为流动相,流速为1.0 mL/min,检测波长为228 nm,进样量10 μL。色谱柱为美国安捷伦公司生产的pn799160D-554型 Spherisorb C18。
准确称取25.0 mg紫杉醇标品,用甲醇溶解并定容至25.0 mL,精密称取紫杉醇标准品25.0 mg,甲醇定容至25.0 mL,得母液质量浓度为1.0 mg/mL。将母液依次稀释成质量浓度梯度为0.2,0.4,0.6,0.8 mg/mL,吸取 10 μL 进样(n=4),建立标准曲线。 发酵液中紫杉醇含量的转换公式:

其中:M为每升发酵液中紫杉醇的质量浓度(μg/L);M0为每毫升甲醇定容液中紫杉醇的质量浓度(mg/L);V1为用甲醇定容的容量瓶的大小 (mL);V2为每瓶发酵液的总量(mL)。
在本实验中,V1值和V2值是定值,V1为 10.0 mL,V2为 34.0 mL。
最后将各试验组所得的紫杉醇质量浓度与对照组进行比较,可得出水杨酸对内生真菌发酵产紫杉醇是否有影响,以及水杨酸的最佳添加时间及添加剂量。
2 结果与分析
2.1 不同质量浓度下紫杉醇标品峰面积的测定及标准曲线的绘制
依次吸取 10 μL 质量浓度为 0.2、0.4、0.6、0.8、1.0 mg/mL的紫杉醇标品溶液进样(n=4),得到其峰面积,见表1。并利用面积归一法求得其回归方程为S=1 684.4+27 604.999 9C (S代表峰面积,C代表质量浓度),相关系数R=0.995。再利用紫杉醇质量浓度转换公式求得每升发酵液中紫杉醇的质量浓度,见图1。
在实验HPLC色谱条件下,得到紫杉醇标准溶液的HPLC色谱图,见图2。其保留时间约为5.7 min。通过对紫杉醇标准品的HPLC分析及其标准曲线的绘制,可知紫杉醇的保留时间,并以此确定样品中紫杉醇的质量浓度。

图1 紫杉醇标品HPLC图谱Fig.1 HPLC chromatograms of the reference Taxol

图2 样品HPLC图谱Fig.2 HPLC chromatograms of extracts of the fungi
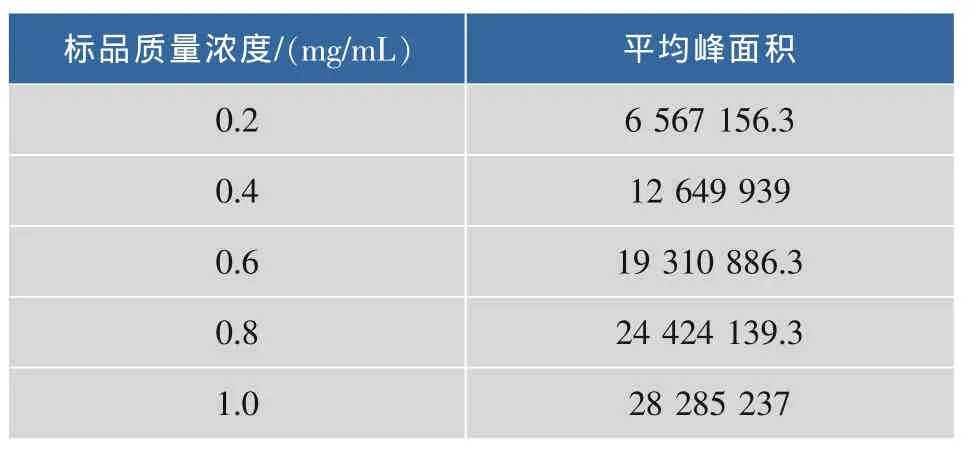
表1 不同浓度下标品紫杉醇峰面积的测定Tab.1 Peak area of standard goods taxol under different concentrations
2.2 菌丝体及其产紫杉醇质量的分析
为研究内生真菌菌丝体的生长和产紫杉醇的情况,在一个月时间内每隔2 d测一次红豆杉内生真菌菌丝体的质量。同时,测定其紫杉醇质量。由此绘出该菌种的生长曲线,从中得出该菌种的延滞期、对数生长期、稳定期和衰退期。
内生真菌菌丝体生长曲线见图3。随培养时间的延长,菌丝体质量不断增加,13 d时达最大值5.5 g,继续延长培养时间则菌丝体质量开始缓慢下降。因此,从图3可以确定,1~4 d为内生真菌的延滞期,5~12 d为对数生长期,平稳期时间较短,为13~16 d,质量保持在 5.4 g左右,衰退期为 17~28 d,菌丝体质量大幅度降低。

图3 内生真菌菌丝体生长曲线Fig.3 Growth curve of endophytic fungi
内生真菌产紫杉醇质量浓度曲线见图4。随着培养时间的延长,内生真菌代谢产紫杉醇的质量浓度不断增加,且在12~18 d时增长幅度较大,19 d时质量浓度达最大值,为582.0 μg/L。其后随培养时间的继续延长,内生真菌产紫杉醇的质量浓度迅速下降。其下降的原因可能是紫杉醇的合成量小于分解量。紫杉醇是一种极不稳定的物质,自然状况下就能分解,温度和光照会加速其分解。

图4 内生真菌产紫杉醇质量浓度曲线Fig.4 Taxol content curve of endophytic fungi
2.3 水杨酸(SA)添加时间对菌丝体生长及紫杉醇质量浓度的影响
水杨酸(SA 5.0 mg/L)添加时间对内生真菌菌丝体生长及产紫杉醇质量浓度的影响见图5,图6。
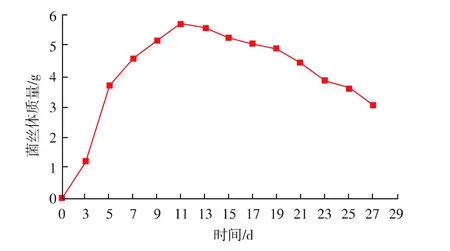
图5 SA添加时间对菌丝体生长的影响Fig.5 Effect of SA add time on growth of endophyte mycelium

图6 SA添加时间对紫杉醇质量浓度的影响Fig.6 Effect of SA add time on taxol content
结果表明,随着内生真菌培养时间和水杨酸同步添加时间的延长,内生真菌菌丝体的质量不断增加且较未添加水杨酸时快,在11 d时质量达5.7 g。添加的水杨酸与内生真菌细胞接触面最大,影响范围最广,刺激作用最强。同时,紫杉醇含量在9~15 d时增长幅度较大,此时菌丝体细胞对合成紫杉醇的各种酶和前体物的需求量也大,恰好水杨酸能够刺激内生真菌细胞,并增强与其次生代谢有关的酶和前体物,加入水杨酸刚好能满足细胞的需求并合成大量次级代谢产物——紫杉醇。因此,内生真菌菌丝体稳定期的15 d为水杨酸的最佳添加时间。此时,内生真菌代谢产紫杉醇的质量浓度为604.0 μg/L。
2.4 水杨酸(SA)添加质量浓度对菌丝体生长及产紫杉醇质量浓度的影响
在内生真菌菌丝体生长稳定期初期向液体发酵培养基中分别添加 0、5.0、15.0、25.0、35.0、45.0 mg/L的水杨酸,28℃、200 r/min培养15 d,分别测定内生真菌菌丝体及紫杉醇质量浓度,见图7、8。

图7 SA添加质量浓度对菌丝体生长的影响Fig.7 Effect of SA in different concentrations on growth of endophyte mycelium
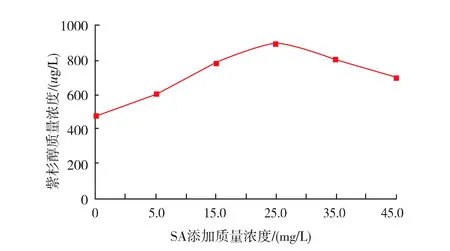
图8 SA添加质量浓度对紫杉醇质量浓度的影响Fig.8 Effect of SA in different concentrations on Taxol content
图7结果表明,随着水杨酸添加质量浓度的增加,内生真菌菌丝质量略呈缓慢下降趋势,其原因有待进一步研究。图8结果表明,不同质量浓度水杨酸在一定程度均能提高紫杉醇的质量浓度,随着水杨酸质量浓度的不断增大,内生真菌产紫杉醇的质量浓度也逐步增大。当水杨酸浓度为25.0 mg/L时,紫杉醇质量浓度达到最大值890.0 μg/L;但当水杨酸质量浓度增至45.0 mg/L时,紫杉醇质量浓度却下降为695.0 μg/L。这表明水杨酸质量浓度过低,不能充分诱导内生真菌细胞产生过敏反应,提高与次生代谢物合成相关的酶的活性,从而影响紫杉醇质量浓度的积累。但过高质量浓度的水杨酸会严重影响内生真菌菌丝体的生长,反而使紫杉醇的质量浓度下降。其中以25.0 mg/L水杨酸对紫杉醇合成的促进效果最为明显,紫杉醇质量浓度达890.0 μg/L,是未添加水杨酸的1.8倍左右。
3 结语
水杨酸的主要作用是提高内生真菌细胞内次生代谢所需的各种关键酶或其前体物,从而增强其次生代谢水平,有利于次生代谢物的积累。紫杉醇是一种次生代谢物,真菌细胞在正常状况下不会大量合成,通过水杨酸对真菌细胞的刺激作用,使真菌细胞产生过敏反应,提高与次生代谢物合成相关的酶的活性,从而促进紫杉醇积累[13,19-21]。
不同质量浓度的SA均可提高紫杉醇的质量浓度,水杨酸质量浓度过低对真菌细胞的刺激作用不明显,但过高质量浓度的水杨酸会严重影响内生真菌菌丝体的生长,反而使紫杉醇的质量浓度下降。因而,需选择最佳的水杨酸添加时间和添加剂量。作者通过实验得出,25.0 mg/L为SA的最佳添加质量浓度,紫杉醇产量可达890.0 μg/L,是未添加SA的1.8倍左右。同时,发现在菌丝稳定期初期15 d时为水杨酸的最佳添加时间,可最大限度提高内生真菌代谢产紫杉醇的质量浓度。
水杨酸的单独作用有时并不能有效地诱导内生真菌的防御反应,但可极大地增强其它诱导子的诱导效应。因而,利用水杨酸和其它诱导子的协同作用提高内生真菌代谢产紫杉醇的质量浓度有待进一步研究。
[1]李媛,李振宇.天然抗癌药物-紫杉醇[J].中山大学研究生学刊:自然科学、医学版,2006,27(4):58-60.LI Yuan, LI Zhen-yu.A natural anticancer agent: paclitaxel[J].Journal of the Graduates Sun Yat-Sen University:Natural Sciences、Medicine,2006, 27 (4):58-60.(in Chinese)
[2]叶水英.红豆杉的生物学特性及开发利用[J].生物学教学,2006,31(4):3-5.YE Shui-ying.Biological characteristics and applications of the plants belonging to the genus Taxus[J].Biology Teaching,2006,31(4):3-5.(in Chinese)
[3]孔建强,王伟,朱平,等.紫杉醇生物合成的研究进展[J].药学学报,2007,42(4):358-363.KONG Jian-qiang, WANG Wei, ZHU Ping, et al.Recent advances in the biosynthesis of taxol[J].Pharmaceutica Sinica,2007,42(4):358-363.(in Chinese)
[4]何颖,谈锋,谢建平.红豆杉内生真菌产紫杉醇研究进展[J].天然产物研究与开发,2006,(18):519-523.HE Ying, TAN Feng, XIE Jian-ping.Studies on endophytic fungus from taxus synthesizing taxol[J].Natural Product Research and Development, 2006,(18):519-523.(in Chinese)
[5]王伟,贺雄雷,钟英长.南方红豆杉内生菌及紫杉烷类产物的初步鉴定[J].中山大学学报:自然科学版,1999,38(3):116-118.WANG Wei, HE Xiong-lei, ZHONG Ying-chang.Isolation of endophytic fungi from Taxus chinensis1 var mairei and preliminary identification of taxane products[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,1999, 38(3):116-118.(in Chinese)
[6]WANG Jian-feng, LI Gui-ling, LU Hua-ying, et al.Taxol from Tubercularia sp.strain TF5,an endophytic fungus of Taxus Mairei[J].FEMS Microbiology Letters, 2000, 193: 249-253.(in Chinese)
[7]李先良,赵志常.紫杉醇生产方法的研究[J].荆门职业技术学院学报,2006,21(3):91-96.LI Xian-liang, ZHAO Zhi-chang.Studies on the methods of producing taxol[J].Journal of Jingmen Technical College,2006,21(3) :91-96.(in Chinese)
[8]林福呈,刘小红,王洪凯,等.紫杉醇及其产生菌的研究现状与展望[J].微生物学报,2003,(43):535-537.LIN Fu-cheng, LIU Xiao-hong, WANG Hong-kai, et al.Recent research and prospect on Taxol and its producing fungi[J].Acta Microbiologica Sinica, 2003,(43):535-537.(in Chinese)
[9]刘晓兰,周东坡,孙剑秋,等.树状多节孢发酵生产紫杉醇工艺条件的初步研究[J].菌物系统,2002,21(2):246-247.LIU Xiao-Lan, ZHOU Dong-po, SUN Jian-qiu, et al.A study on fermentation process for production of Taxol by Nodulisporium sylviforme[J].Mycosystema, 2002,21(2):246-247.(in Chinese)
[10]陈建华,臧巩固,李育君,等.产紫杉醇内生真菌的筛选研究[J].中国麻业,2002,(24):42-43.CHEN Jian-hua, ZANG Gong-gu, LI Yu-jun, et al.Studies on the screening of taxol-producing endophytic fungi[J].China’s Fiber Crops, 2002,(24):42-43.(in Chinese)
[11]庞欣,章光明,张瑞萍,等.固相萃取—高效液相色谱法测定真菌产紫杉醇[J].色谱,2004,22(2):185.PANG Xin, ZHANG Guang-ming, ZHANG Rui-ping, et al.Determination of taxol from fungus fermentation by SPE/HPLC[J].Chinese Journal of Chromatography, 2002,(24):42-43.(in Chinese)
[12]王建锋,吕华鹰,苏文金.植物内生真菌产紫杉醇的研究[J].微生物学通报,2000,27(1):58-60.WANG Jian-feng, LU Hua-ying, SU Wen-jin.Study on taxol-producing endophtic fungi[J].Microbiology China, 2000,27(1):58-60.(in Chinese)
[13]张长平,李春,元英进.真菌诱导子对悬浮培养南方红豆杉细胞次生代谢的影响[J].化工学报,2002,53(5):498-502.ZHANG Chang-ping, LI Chun, Yuan Ying-jin.Effects of fungal elicitor on secondary metabolism of cell suspension culture of Taxus chinensis var.mairei[J].Journal of Chemical Industry and Engineering, 2002,53(5):498-502.(in Chinese)
[14]陈文强,邓百万,彭浩,等.一株产紫杉醇内生真菌的原生质体制备与再生[J].江苏农业科学,2011,39(2):100-102.CHEN Wen-qiang, DENG Bai-wan, PENG Hao.et al.Study on the preparation and regeneration of protoplast from taxolproducing fungus[J].Jiangsu Agricultural Sciences, 2011,39(2):100-102.(in Chinese)
[15]乔建军,赵红,葛志强,等.水杨酸作用下东北红豆杉细胞的二维凝胶电泳分析[J].生物工程学报,2003,19(1):92-96.QIAO Jian-jun, ZHAO Hong, HE Zhi-qiang, et al.2-Dimensional gel electrophoresis on protein patterns from suspension cultures of taxus cuspidate induced by SA[J].Chinese Journal of Biotechnology,2003, 19(1):92-96.(in Chinese)
[16]李娟花,陈文强,邓百万,等.植物生长调节剂对内生真菌生物合成紫杉醇的影响[J].食品与生物技术学报,2011,30(6):879-883.LI Juan-hua, CHEN Wen-qiang, DENG Bai-wan, et al.Effects of plant growth regulators on taxol biosynthesis by an endophytic fungus[J].Journal of Food Science and Biotechnology, 2011,30(6): 879-883.(in Chinese)
[17]李恒赫,杨冲.诱导子对红豆杉培养细胞紫杉醇产量的影响[J].生物学通报,2006,41(6):55-57.LI Heng-he, YANG Chong.Effects of elicitor on Taxol-producing of cell culture of Taxus chinensis[J].Bulletin of Biology,2006,41(6):55-57.(in Chinese)
[18]任峰,刘太奇.过滤除菌用净化材料的研究与应用[J].化学世界,2005,(2):123.REN Feng, LIU Tai-qi.Investigation and application of material used to filtrate pathogen[J].Chemical World, 2005,(2):123.(in Chinese)
[19]彭浩,邓百万,陈文强,等.虎杖内生真菌产白藜芦醇苷菌株的分离鉴定[J].微生物学通报,2011,38(6):889-894.PENG Hao, DENG Bai-wan, CHEN Wen-qiang, et al.Isolation and identification of the endophytic fungus producing polydatin in Polygonum cuspidatum[J].Microbiology China, 2011,38(6):889-894.(in Chinese)
[20]刘开辉,丁小维,邓百万,等.一株喜树内生真菌的分离及其产喜树碱的初步分析[J].食品与发酵工业,2010,36(2):30-32.LIU Kai-hui, DING Xiao-wei, DENG Bai-wan, et al.Isolation of an endophytic fungus from Camptotheca acuminata and its preliminary analysis of camptothecin production[J].Food and Fermentation Industries, 2010,36(2):30-32.(in Chinese)
[21]WANG Yan-dong, YUAN Ying-Jin, WU Jin-chuan.Induction studies of methyl jasmonate and salicylic acid on taxane production in suspension cultures of Taxus chinensis var.mairei[J].Biochemical Engineering Journal,2004(19):259-265.

