黑曲霉β-葡萄糖苷酶基因克隆及在毕赤酵母中分泌表达
朱龙宝,汤 斌,陶玉贵,葛 飞,魏胜华,陈 涛,李婉珍
(安徽工程大学 生化学院,安徽 芜湖 241000)
纤维素是重要的可再生生物质资源,在解决能源和环境问题中起到重要作用。纤维素酶高效水解纤维仍然是生物法生产燃料乙醇的一个技术瓶颈[1]。纤维素被降解为葡萄糖至少需要3种纤维素酶,分别是β-1,4-葡聚糖甘内切酶、纤维二糖水解酶和β-葡萄糖苷酶,在前两种酶的作用下生成纤维二糖,纤维二糖最终在β-葡萄糖苷酶的作用下水解成葡萄糖[2]。纤维二糖和纤维寡糖是纤维素酶系的抑制剂,为了解除其抑制作用,其中的β-葡萄糖苷酶活性成为纤维素高效降解的关键因素。虽然β-葡萄糖苷酶也受到自身产物葡萄糖的抑制,但可以通过控制糖化和发酵过程解决[3]。β-葡萄糖苷酶对纤维素糖化水解具有关键性作用,但微生物所产纤维素酶系中β-葡萄糖苷酶所占比例不足1%,这使得β-葡萄糖苷酶成为纤维素降解成单糖的关键因素[4],工业上通过往纤维素酶水解系统中添加β-葡萄糖苷酶来提高纤维的水解效率[5]。
微生物中β-葡萄糖苷酶酶活高的菌种主要是霉菌,A.niger是优良的产β-葡萄糖苷酶的菌,国内目前对β-葡萄糖苷酶的研究还主要在β-葡萄糖苷酶的生产菌种选育和在大肠杆菌中表达,产酶水平低,难以提取纯化[6-7]。酵母表达系统兼有大肠杆菌表达系统的优势:便于培养,基因操作,成本低,繁殖快,又可对真核基因产物进行翻译后加工,得到有活性的蛋白质。其中选用表达载体pPIC9K含有分泌型信号肽,利于胞外表达。通过抗生素浓度梯度筛选得到高拷贝数的基因整合到染色体DNA上,在提高表达量的基础上也保证后代的遗传稳定性。唐德芳[8]在筛选出一株黑曲霉的基础上,进一步构建酵母工程菌,经诱导表达,β-葡萄糖苷酶比活力达7.85 U/mg,但未报导其发酵产酶水平。陈士华[9]采用pPICZaA载体构建的重组菌在诱导培养72 h后,发酵液的酶活力可达到0.78 U/mL,还不能满足工业化生产要求。为进一步提高产酶水平,作者拟构建酵母工程,实现高效分泌表达β-葡萄糖苷酶,为解决β-葡萄糖苷酶产量低、成本高等问题提供实验依据。
1 材料与方法
1.1 菌种和质粒
黑曲霉(Aspergillus niger):购自工业微生物菌种保藏中心;毕赤酵母Pichia pastoris GS115、大肠杆 菌 E.coli JM109、BL21、pMD-18T 和 pPIC9K 载体:均购自美国invitrogen公司。
1.2 培养基与主要试剂
pfu DNA聚合酶、T4DNA连接酶、M-MLV逆转录酶试剂盒、DNA凝胶回收试剂盒、质粒提取试剂盒、RNA 提取试剂盒、pNPG、DNA marker、G418、琼脂糖、氨苄青霉素、IPTG、X-gal:均购自上海生工;各种限制性内切酶:购自 NEB公司;LB、YPD、BMGY、BMMY培养基:参照Invitrogen公司产品使用手册。
1.3 方法
1.3.1 基因克隆 将黑曲霉样品液氮速冻后立即研磨,用Trizol试剂提取总RNA,反转录后进行PCR 扩增,步骤如下:将 50 μL 体系的反应液(3 μg RNA,1 μL oligodT)65 ℃变性 5 min, 冰上冷却 5 min。 再加入 5 μL 10×buffer, 1 μL M-MLV 逆转录酶,0.5 μL逆转录酶抑制剂,37℃反应1 h,70℃变性10 min。根据NCBI数据库中Aspergillus niger的bgl基因序列(GI:159034137),采用 Premier5 软件设计 引 物 :Primer1:5-CGGTAC GATGAGGTTCA CTTTGATCGA-3;primer2:5′-CGGCGGCCGCTTAG TGAACAGTAGGCA GAG-3′。
PCR反应条件:94℃预变性3 min,94℃变性1 min,58℃退火 30 s,72 ℃延伸 3 min,25个循环,PCR产物割胶回收,克隆到pMD-18T载体,构建pMD-18T-bgl,转化 E.coli Jm109,在含有氨苄抗性的LB平板挑转化子,送上海生工测序。
1.3.2 重组表达载体pPIC9K-bgl的构建 用SnaBⅠ和 NotⅠ分别双酶切pMD-18T-bgl和空载体pPIC9K,胶回收纯化后于16℃连接过夜,转化E.coli JM109,在含有氨苄(50 μg/mL)抗性的 LB 平板挑转化子,提取重组质粒酶切验证,阳性克隆即pPIC9K-bgl。
1.3.3 毕赤酵母电击转化、筛选 用BglII线性化重组质粒pPIC9K-bgl,电转化100 μL感受态毕赤酵母细胞,对照为BglII线性化pPIC9K空载体,使用MD培养基和MM培养基对转化子进行初筛,30℃培养至长出单菌落。为获得多拷贝bgl基因的菌株,挑取阳性转化子接种于YPD/G418平板上,30℃培养至长出单菌落,G418质量浓度梯度依次为0.5、1、2、4 mg/mL,最后采用PCR扩增进行验证。
1.3.4 重组毕赤酵母的培养 将鉴定的阳性克隆单菌落接种至10 mL YPD培养基,30℃培养24 h,1 mL培养液接入50 mL BMGY,30℃培养24 h,离心收集菌体,用25 mL BMMY培养基重悬培养,1%甲醇诱导表达。分别于 24、48、72、96、120 h 取样,离心收集上清液,用 25 mmol/L Tris-HCl(pH 7.0)缓冲液在透析袋中过夜透析后测定酶活性。
1.3.5 重组β-葡萄糖苷酶的SDS-PAGE 将重组毕赤酵母诱导培养于50 mL的YPD培养基中,30℃、200 r/min培养72 h。发酵液于4℃离心,8 000 r/min 离心 4 min,取上清液 40 μL 于 10 μL 5×上样缓冲液混合均匀,水中煮沸2 min,取 20 μL进行SDS-PAGE。
1.3.6 温度和pH值对重组β-葡萄糖苷酶的影响将重组β-葡萄糖苷酶酶液在不同pH缓冲液中(pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0)50 ℃保温 30 min;在不同温度下 (30、40、50、60、70、80 ℃) 保温 30 min后加入100 μL三氯乙酸终止反应,检测酶活力。
1.3.7 β-葡萄糖苷酶酶活测定 pNPG为底物测定β-葡萄糖苷酶活性,最适反应条件下每分钟催化底物水解产生1 μmol对硝基苯酚的酶量为1 U[10]。
2 结果与分析
2.1 总RNA提取及RT-PCR结果
将提取的总RNA上琼脂糖凝胶电泳检测 (图1A), 可以看到 rRNA 清晰的 3 条带:28S,18S,5S,RNA样品的OD260/OD280比值在2.0左右,RNA质量较好,能满足RT-PCR实验要求。使用目的基因特异性引物,进行RT-PCR,得到2.5 kb左右的一条DNA 条带(图 1B)。
2.2 pMD-18T-bgl重组子筛选与检测
重组质粒pMD-18T-bgl转化到感受态E.coli JM109后用蓝白斑的方法进行筛选,随机挑取3个白斑培养,提取质粒电泳检测,见图2。根据相对分子质量的大小,其中有2个可能是阳性克隆子。将这2种质粒进行PCR验证,得到了约2.5 kb左右的条带,与目的基因条带一致,初步表明RT-PCR产物TA克隆成功。测序结果表明:该基因的cDNA阅读框2583 bp,将cDNA序列在NCBI数据库中进行Blast比对分析。通过同源性比较可知,该cDNA与GenBank中已公布的黑曲霉Aspergillus niger CBS513.88 β-葡萄糖苷酶基因的核苷酸序列同源性高达99%[11],证明该cDNA全序列是黑曲霉β-葡萄糖苷酶基因。

图1 总RNA电泳图片(A)和 RT-PCR产物电泳图(B)Fig.1 Agarose gel electrophoresis of total RNA extracted from Aspergillus niger(A)and RT-PCR production of bgl gene(B)

图2 重组质粒PCR验证结果Fig.2 PCR production of pMD-18T-bgl plasmid
2.3 pPIC9K-bgl分泌表达载体的构建
用SnaBⅠ和NotⅠ分别双酶切pMD18-T-bgl和pPIC9K表达载体,连接后转化大肠杆菌E.coli JM109。筛选氨苄抗性的重组克隆提取质粒,用SnaBⅠ和NotⅠ双酶切验证重组克隆中含有β-葡萄糖苷酶基因bgl,结果见图3。重组表达质粒pPIC9K-bgl可以用于毕赤酵母的转化。
2.4 毕赤酵母转化子的筛选与PCR验证
通过G418抗菌素平板上筛选出的阳性重组子,在MD、MM平板上,30℃培养观察其生长情况。选择其中表型为His+Muts进行进一步验证和酶活测定分析。挑取3个阳性克隆至YPD培养基中,30℃、150 r/min,培养36 h,提取基因组DNA,以primer1和primer2为引物进行PCR,电泳结果见图4。阳性转化子均含有β-葡萄糖苷酶基因片段。

图3 SnaBⅠ和NotⅠ双酶切验证重组质粒pPIC9K-bglFig.3 Restriction analysis of recombinant plasmid pPIC9K-bgl

图4 重组表达载体PCR产物Fig.4 PCR production of pPIC9k-bgl plasmid from P.pastoris GS115
2.5 表达产物的SDS-PAGE分析
酵母转化子经甲醇诱导培养后,上清液进行SDS-PAGE。图5聚丙烯酰胺凝胶电泳图表明,β-葡萄糖苷酶基因在毕赤酵母GS115中得到表达,重组子诱导培养后,上清液SDS-PAGE上出现明显的条带,对照菌株毕赤酵母(pPIC9K)无此条带。
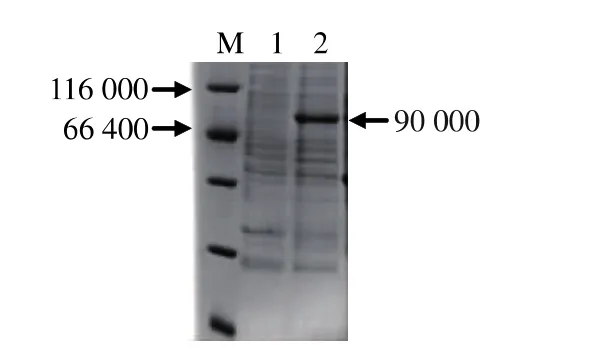
图5 表达产物的SDS-PAGE电泳图Fig.5 SDS-PAGE of expressing product
2.6 不同发酵时间内重组β-葡萄糖苷酶的酶活
挑选酶活最高的重组酵母再进行诱导培养,每隔24 h测定一次酶活,其产酶曲线见图6。可以看出,其β-葡萄糖苷酶酶活在连续诱导的前72小时一直呈增长趋势,72 h以后便不再增长,呈缓慢下降趋势。
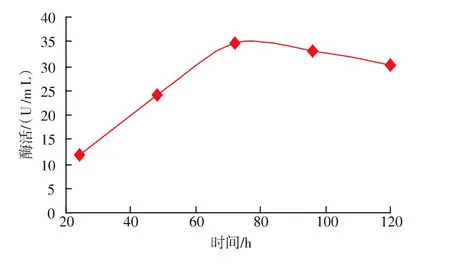
图6 P.pastoris GS115 β-葡萄糖苷酶酶活测定曲线Fig.6 Curve of P.pastoris GS115 β-glucosidase activity
2.7 温度和pH值对重组β-葡萄糖苷酶的影响
将重组酵母诱导培养72 h后,在不同pH值反应条件下测得酶活力。以pH值为横坐标,酶活力为纵坐标,作出pH曲线,见图7。从图7可以看出,β-葡萄糖苷酶的最适pH为5.5。在pH 4.0~7.0的范围内,β-葡萄糖苷酶均有活性。在最适pH值条件下,分别在30~80℃温度条件下测定重组β-葡萄糖苷酶的活力,该酶最适反应温度为50℃,在30~70℃之间均有酶活性。
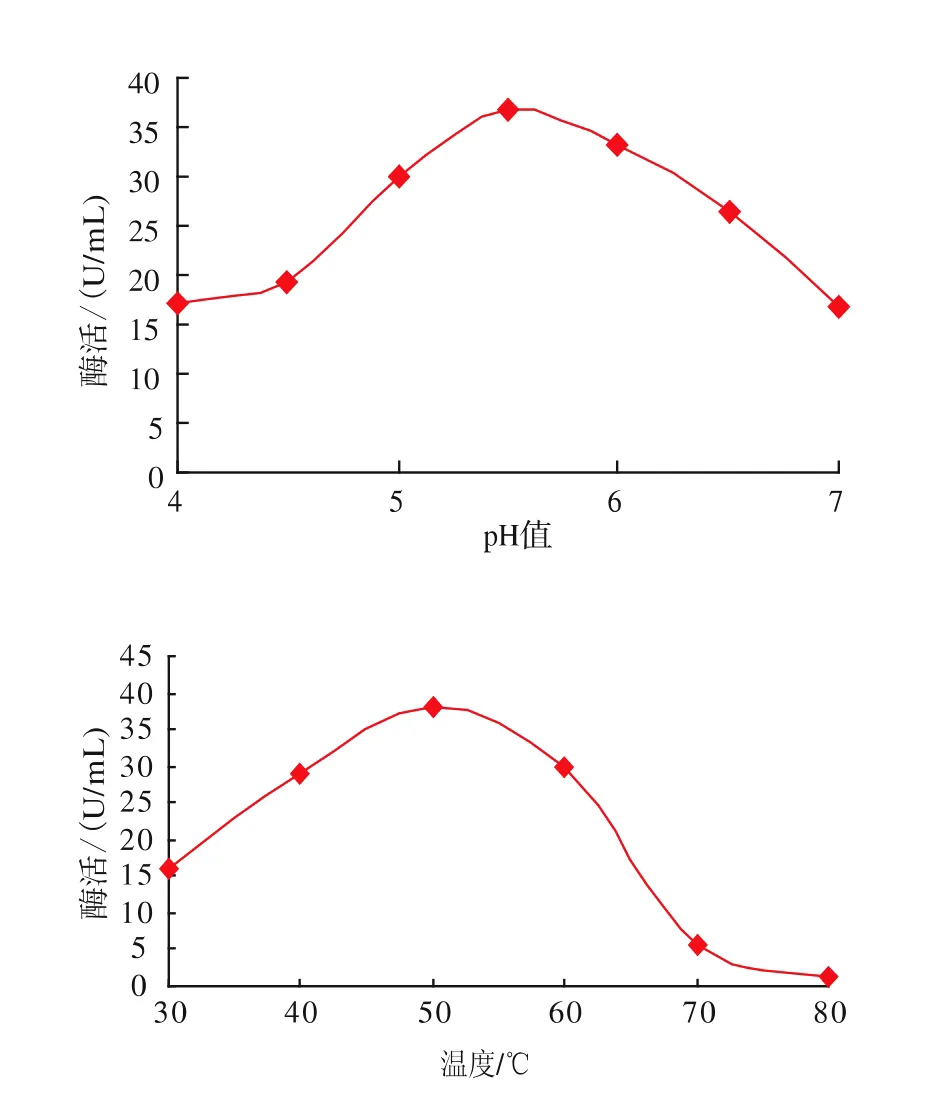
图7 温度和pH值对重组β-葡萄糖苷酶的影响Fig.7 Effect of temperature and pH on the activity of recombinant β-glucosidase
3 结语
β-葡萄糖苷酶在医药、食品、饲料、造纸、印染、纺织、石油开采及生物技术研究等多方面得到了广泛的应用,构建的工程酵母来高效表达β-葡萄糖苷酶,以解决目前β-葡萄糖苷酶产量低、成本高等问题。由于酿酒酵母细胞膜上缺少通透酶,使得纤维二糖不能进入胞内,因此需使编码β-葡萄糖苷酶的外源基因带有信号肽能够被分泌到胞外,从而增加工程酵母菌株降解纤维素的能力,以便更好利用纤维素及纤维二糖来生产乙醇,为纤维素高效降解、生产燃料乙醇提供有效的解决途径。采用RT-PCR技术成功扩增出β-葡萄糖苷酶全长基因bgl,构建克隆载体pMD-18T-bgl。测序结果表明:bgl全长2 583 bp,可编码一个860个氨基酸的蛋白质,与β-葡萄糖苷酶基因(XM001398779.1)核苷酸序列同源性为99%,氨基酸序列同源性为99%,属于β-葡萄糖苷。将重组pMD-18T-bgl中的bgl插入酵母分泌表达载体pPIC9K中,构建了表达载体pPIC9K-bgl,成功实现在Pichia pastoris GS115高效表达,获得与预期大小相一致的重组蛋白质。陈士华采用pPICZaA载体构建的重组菌在诱导培养72 h后,发酵液的酶活力可达到0.78 U/mL。作者所构建的工程菌发酵上清液中β-葡萄糖苷酶的最高酶活达到38 U/mL,提高近50倍。发酵上清液中蛋白质主要是酶蛋白,杂蛋白质较少,后续的分离纯化过程就相对简单,分离步骤较少,为后续的发酵放大提供实验依据。
[1]Van Maris A J A, Annott D T, Bellissimi E, et al.Alcoholic fermentation of carbon sources in biomass hydrolysates by Saccharomyces cerevisiae:current status[J].Antonie Van Leeuwenhoek, 2006, 90 (4):391-418.
[2]Kim K H,Brown K M,Harris P V,et al.A proteomics strategy to discover beta-glucosidases from Aspergillus fumigatus with two dimensional page in gel activity assay and tandem mass spectrometry[J].Journal of Proteome Research, 2007,6(12):4749-4757.
[3]Leontina G I,Álvaro L ,Julio P ,Julia M N.Fermentation of cellobiose to ethanol by industrial Saccharomyces strains carrying the β-glucosidase gene (BGL1) from Saccharomycopsis fibuligera[J].Bioresource Technology, 2011,102:5229-5236.
[4]石彩蕊,王义强,陈介南.产β-葡萄糖苷酶微生物育种研究进展[J].生物技术通报,2011,3:59-65.SHI Cai-rui,WANG Yi-qiang,CHEN Jie-nan.Research progress of breeding for β-glucosidase strain[J].Biotechnology Bulletin,2011,3:59-65.(in Chinese)
[5]Lynd L R,Weimer P J,Van Zyl W H,et al.Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews, 2002, 66:506-577.
[6]朱婧,覃拥灵,陈桂光,等.葡萄糖苷酶高产菌株的选育及酶法转化葡萄糖生产龙胆低聚糖[J].食品与发酵工业,2010,36(4):21-24.ZHU Jing,QIN Yong-ling,CHEN Gui-guang,et al.Selection of the high β-glucosidase mutant and production of gentiooligosaccharid[J].Food and Fermentation Industries,2010,36(4):21-24.(in Chinese)
[7]张益波,王娟,何欢,韩微,等.β-葡萄糖苷酶新型高产菌株筛选及其液态发酵培养基的优化[J].微生物学通报,2011,38(6):809-815.ZHANG Yi-Bo,WANG Juan,HE Huan,HAN Wei,et al.Production of β-glucosidase by a novel isolated strain Tolypocladium cylindrosporum syzx4 and statistical optimization of fermentation media[J].Microbiology,2011,38(6):809-815.(in Chinese)
[8]唐德芳,裴小琼,李晓璐,等.黑曲霉β-葡萄糖苷酶的筛选、克隆及表达[J].应用与环境生物学报,2009,15(3):423-426.TANG De-fang,PEI Xiao-qiong,LI Xiao-lu,et al.Screening,cloning and expression of Aspergillus niger β-glucosidase[J].Journal of Applied&Environmental Biology,2009,15(3):423-426.(in Chinese)
[9]陈士华,耿瑞凡,薛珍,等.黑曲霉bgl基因在毕赤酵母中的表达研究[J].河南工业大学学报:自然科学版,2010,31(5):42-45.HEN Shi-hua,GENG Rui-fan,XUE Zhen,et al.Research on the expression of bgl gene of Aspergillus niger in Pichia pastoris[J].Journal of Henan University of Technology,2010,31(5):42-45.(in Chinese)
[10]李华,高丽.β-葡萄糖苷酶活性测定方法的研究进展[J].食品与生物技术学报,2007,26(2):107-112.LI Hua,GAO Li.Research advance on methods of determining β-glucosidase activity[J].Journal of Food Science and Biotechnology[J].2007,26(2):107-112.(in Chinese)
[11]Pel H J,Winde J H,Archer D B.Genome sequencing and analysis of the versatile cell factory Aspergillus niger CBS 513.88[J].Nature Biotechnology, 2007,25(2),221-231.

