波纹唇鱼mtDNA D-loop序列变异分析
胡 静,齐兴柱,尹绍武,,骆 剑,朱晓平,祝 斐,胡亚丽
(1.海南大学 海洋学院,海南大学热带生物资源教育部重点实验室,海南 海口 570228;2.南京师范大学生命科学学院,江苏 南京 210046)
波纹唇鱼(Cheilinus undulatus),俗称苏眉,曲纹唇鱼,隶属鲈形目(Perciformes)、隆头鱼科(Labridae)、唇鱼属(Cheilinus),分布于大洋洲、太平洋西部热带海域、大堡礁、印度洋西北部及红海[1]。在中国分布于南海与东海的南部海域[2],海南的万宁、陵水、三亚等海域以及台湾、香港。波纹唇鱼肉质细嫩而爽滑,味甚鲜美,营养价值高,深受亚洲人喜爱,需求的剧增和巨额的利润吸引人们大量捕杀波纹唇鱼,加之环境污染、珊瑚礁栖息地的破坏等因素,自然海区的波纹唇鱼数量越来越少,目前已经濒临绝种。因此,有关波纹唇鱼的的遗传资源调查、资源保护、人工繁殖等工作亟待加强。
对于波纹唇鱼,国内的研究及公开报道很少,仅在食用中毒及中毒后急救护理和形态学两方面有少许报道[3]。目前已有一些繁殖和生理特性方面的研究[4-5],国外对波纹唇鱼的生物学等方面报道较多[6-7],但仍未见关于波纹唇鱼线粒体控制区的研究报道。近年来,随着mtDNA的研究不断深入,同时因为其具有分子小、结构简单、演化速度快、母系遗传等优点而作为有效的分子标记广泛应用于物种系统进化研究[8],而mtDNA的控制区或D-loop区是最有意义的区域,也是线粒体基因组进化最快的部分[9]。本研究对海南近海海域波纹唇鱼种群 mtDNA D-loop区进行扩增、克隆及测序,旨在研究波纹唇鱼控制区的序列变异情况,分析其序列多态性,以获得相关数据,为该种群遗传多样性和保护生物学的研究提供科学资料。
1 材料与方法
1.1 材料
25尾波纹唇鱼样品于2009年采自海南三亚海域,平均质量约350 g,长约30cm,均为1龄鱼。取其肌肉于超低温冰箱中储存(-80℃)备用。
1.2 方法
1.2.1 总DNA提取
分别取25尾个体(编号为1~25)0.1 g肌肉组织以提取总DNA。总DNA的提取按常规的“酚-氯仿”方法进行[10],DNA经异丙醇沉淀、70%(体积分数)乙醇洗涤并干燥后,用50μLTE溶解,-20℃保存备用。
1.2.2 PCR扩增
采用PCR扩增mtDNA D-loop区靠近Cyt b基因的苏氨酸 tRNA基因和脯氨酸 tRNA基因及其后的D-loop序列。采用PCR类别为巢式PCR,通过引物设计所得巢式PCR正链引物和反链引物见表1。
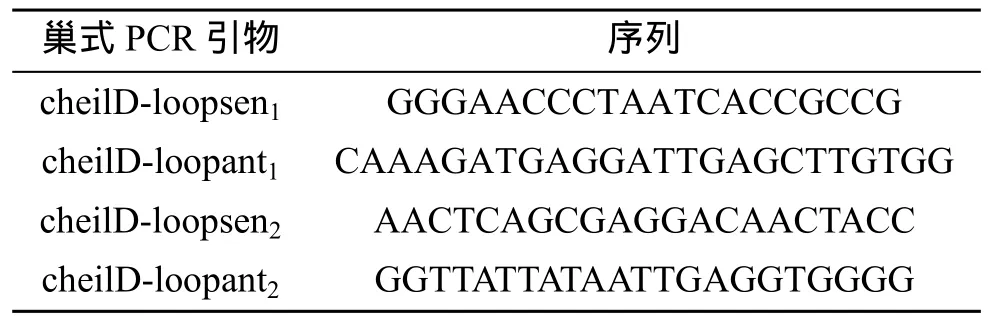
表1 引物序列Tab.1 The sequences of primer
巢式PCR分步进行两次,每个 PCR的总体积为25 μL,其中模板 1 μL,PCRmix12.5 μL(天根生化科技有限公司);去离子双蒸水 8.9 μL;正、反链引物各1.3 μL,两步引物分别为 cheilD-loopsen1、cheilD-loopant1和 cheilD-loopsen2、cheilD-loopant2。第一步PCR程序:94℃预变性4 min,然后进行30个热循环(94℃、30 s,54℃、30 s,72℃、2 min),72℃延伸 10 min;10℃保温。第二步PCR的模板为第一次反应产物,其退火温度为51℃,其他程序与以上相同。
1.2.3 PCR产物克隆
扩增产物用DNA纯化试剂盒纯化。将目的片段与pMDTM18-T Vector*1(宝生物工程有限公司)连接。连接产物与 DH5ɑ感受态细胞[11]充分混匀转化。挑取目的单克隆菌落于含有氨苄的液体培养基中扩大培养,后菌液PCR。测序工作由天根生化科技(北京)有限公司操作。
1.2.4 数据分析
测序结果在 BLAST上进行比对分析;在ClustalX软件上对比以剪切所有序列为相近长度;整理后的序列在MEGA软件上计算个体间的遗传距离,并构建UPGMA和NJ系统树;DNASP软件上计算遗传多样性参数,及碱基含量、突变位点等。
2 结果
2.1 目的片段的序列特征及群体内的序列变异
本实验共测定了波纹唇鱼 25尾个体的 mtDNA D-loop序列片段,在对比除去部分端部序列后,碱基序列长度共出现 4种情况:1141bp、1142bp、1143bp、1144bp,即 25个序列中存在碱基缺失或插入的情况。利用 BLAST软件将 25个序列与 NCBI上波纹唇鱼线粒体全序列(序列号:GU296101)的D-loop序列区域进行对比,结果表明两者同源性很高,均为97%~99%。A、T、C、G 4个碱基在25尾个体中的平均含量分别为 27.6%、24.9%、28.4%、19.1%(表2),且 AT 含量(52.5%)高于 CG 含量(47.5%)。

表2 25尾波纹唇鱼线粒体D-loop序列碱基含量(%)Tab.2 Nucleotide compositions of mtDNA D-loop sequences in 25 C.undulatus(%)
波纹唇鱼D-loop序列变异位点如表3所示。25尾个体中共检出66个变异位点,其中包括0个碱基缺失,4个碱基插入,59个转换位点,2个颠换位点及1个转换和颠换同时存在的位点。结果可以看出,在所有核苷酸序列中变异位点主要分布在 200bp~1 000bp。
2.2 群体内遗传多样性
2.2.1 遗传多样性参数
由DNASP软件计算出这25尾个体的遗传多样
性参数[12],单倍型数目h为25,单倍型多样性Hd为1,多态位点数(S)为62,核苷酸多样性(Pi)为0.00606,平均核苷酸差异数(K)为6.907。

表3 变异位点在25尾波纹唇鱼D-loop序列中的分布Tab.3 Distribution of D-loop variable sites in 25 C.undulatus
2.2.2 个体间的遗传关系
应用MEGA5.0软件,根据D-loop序列计算出了25尾个体间的 Kumar遗传距离(表4)。从表4可以看出,25尾个体任何两个个体间的遗传距离不为零,即任何 2个个体的核苷酸序列不完全相同,故共有25个单倍型;个体10和个体11之间的遗传距离最大(0.015),个体13及个体个体22分别与个体17之间的遗传距离最小(0.001)。由此可以看出个体间的差异很小。
以25尾个体的D-loop序列构建的NJ系统树分别如图1所示。从图中可见,25尾个体形成了2大分支。线粒体DNA属于母系遗传,可推断该群体的25个个体可能来源于2个不同母系祖先[13]。
3 讨论
3.1 目的片段序列特征及变异分析
A、T、C、G 4个碱基在25尾个体中的平均含量为27.6%、24.9%、28.4%、19.1%(表2),且AT含量(52.5%)高于CG含量(47.5%)。结果表明波纹唇鱼mtDNA D-loop基因的 AT含量与稀有白甲鱼(Onychostoma rara)D-loop基因的AT含量(66.1%)非常接近[14],这也符合脊椎动物mtDNA D-loop区域碱基组成的特点[15]。
3.2 遗传多样性以及个体间的遗传关系分析
由DNASP软件计算出这25尾个体的遗传多样性参数,单倍型数目h为25,单倍型多样性Hd为1,多态位点数(S)为 62,核苷酸多样性(Pi)为 0.00606,平均核苷酸差异数(K)为 6.907,从表4可以看出 25尾波纹唇鱼个体间的遗传距离很小,即个体间的差异很小。
鱼类线粒体DNA D环是mtDNA中不编码多肽链的核苷酸片段,无修复系统,不受选择压力的影响,因而积累了较多的变异[16]。mtDNA母系遗传特性使得相对较少个体即可代表该群体的有效样本,因此,这些参数已经能代表该群体的 D环序列的变异水平。
波纹唇鱼个体间的差异很小其原因可能是波纹唇鱼群体由一个较小的有效群体迅速增长形成,虽然通过变异产生了单倍型多态性,但还未能积累相对较丰富的核苷酸序列的多样性[17]。
由实验结果得出,波纹唇鱼单倍型多样性程度较高而个体差异较低。由于有限的群体会导致近交频繁发生进而加剧遗传多样性的减少[18],而过度捕捞也会降低个体核苷酸序列一致的几率,故波纹唇鱼的以上遗传变异情况可能受其分布地域小和过度捕捞影响严重。目前波纹唇鱼的野生资源有限,波纹唇鱼分布较窄,有利于个体间产生基因交流,而基因交流会进一步地减少个体间的差异,使得遗传多样性降低。此外,由于需求增加和利润吸引,波纹唇鱼的渔业捕捞强度日益加大,群体数量剧烈减少,小群体产生的基因丢失某种程度上会降低该群体的遗传多样性,故捕捞过度必然导致遗传多样性的降低。

图1 由D-loop 序列得到的NJ系统树(无其他序列作参照)Fig.1 NJ phylogenetic tree based on D-loop sequences Bootstrap (500 replicateseed=64238)

Pi值是衡量群体多态程度和群体遗传分化的重要指标之一,Pi值越大表示群体多态程度越高,反之亦然。本研究所得的波纹唇鱼遗传多样性参数Pi较黑鲷的 D-loop数值(Pi=0.00903)[19]和稀有白甲鱼的D-loop数值(Pi=0.0107)[14]低。这种现象可能与种类差异和栖息地及活动范围狭窄有关,因为波纹唇鱼为珊瑚礁栖息类鱼,而珊瑚礁正大面积的污染,甚至面临濒临消失的险境。此外,作为近几年的增养殖鱼类,波纹唇鱼的遗传多样性在一定程度上也受到了由于人工苗种培育而导致的近郊等方面的影响。
本研究基于线粒体D-loop序列变异对海南近海海域的波纹唇鱼进行了遗传多样性研究,有关结果尚不能肯定人为因素对其遗传多样性影响的程度,但仍不能忽视对波纹唇鱼的必要保护和管理;也不能完全反映所有波纹唇鱼群体遗传多样性水平和群体分化程度,但为后续的波纹唇鱼研究积累了遗传多样性参考资料。
[1]区又君,齐旭东,李加儿.波纹唇鱼不同组织 5种同工酶表达的差异[J].南方水产,2009,5(2):51-55.
[2]Donadson T J,Sadovy Y.Threatened fishes of the world:Cheilinnus undulatusRǘppell,1835 (Labridae)[J].Environ Biol Fish,2001,62:428.
[3]李桂英,马晓华.32例苏眉中毒患者的急救与护理[J].现代护理,2005,11:10.
[4]王永波,陈国华,骆剑,等.波纹唇鱼消化系统的形态解剖与肠道上皮的扫描电镜观察[J].海洋通报,2010(2):199-205.
[5]陈国华,王永波,王珺,等.波纹唇鱼消化系统的组织学[J].水生生物学报,2010,34(4):685-693.
[6]Olivier Chateau,Laurent Wantiez.Site fidelity and activity patterns of a humphead wrasse,Cheilinus undulatus(Labridae),as determined by acoustic telemetry[J].Environ Biol Fish,2007,80:503-508.
[7]Sadovy Y,Kulbicki M,Labrosse P.Synopsis of a threatened and poorly known giant coral reef fish[J].Reviews in Fish Biology and Fisheries,2003,13:327-364.
[8]郭新红,刘少军,刘巧,等.鱼类线粒体DNA研究新进展[J].遗传学报,2004,31(9):983-1000.
[10]萨姆布鲁克J,弗里奇 E F,曼尼阿蒂斯T.分子克隆实验指南(第二版) [M].北京:科学出版社,1995:464-467.
[11]霍蕊.波纹唇鱼的核型和线粒体全基因组结构分析[D].海口:海南大学,2008:33-34.
[12]刘若余,夏先林,雷初朝,等.贵州黄牛mtDNA D-loop遗传多样性研究[J].遗传,2006,28(3):279-284.
[13]石拓,孔杰,刘萍,等.中国对虾遗传多样性的RAPD分析——朝鲜半岛西海岸群体的DNA多态性[J].海洋与湖沼,1999,30(6):609-615.
[14]彭珊,代应贵.濒危鱼类稀有白甲鱼清水江种群mtDNA D-loop序列多态性[J].中国水产科学,2007,14(3):352-360.
[15]Meyer A.DNA technology and phylogeny of fish[M].London:Chapman and Hall.1994:219-249.
[16]钱亚屏,诸嘉佑,初正韬,等.应用线粒体 DNA D-LOOP区遗传多样性分析云南4个少数民族的遗传关系[J].遗传学报,2001,28(4):291-300.
[17]Avise J C.Phylogeography the History and Formation of Species[M].Cambridge,Massachusetts London,England:Harvard University Press.2000:447-448.
[18]李娜,陈少波,谢起浪,等.闽浙地区香鱼线粒体Cyt b基因和D-loop区遗传多态性分析[J].遗传学报,2008,30(7):919-925.
[19]龚金波,苏天凤,夏军红,等.中国近海黑鲷线粒体DNA控制区序列多态性分析[J].南方水产,2006,2(4):24-30.

