2010年中国东海夏季游离态2-苯基乙胺、腐胺、亚精胺和精胺的分布
李彩艳,赵卫红,苗 辉
(1.中国科学院 海洋研究所 海洋生态与环境科学重点实验室,山东 青岛 266071;2.中国科学院 研究生院,北京 100049)
多胺是生物生长的调节因子,广泛的存在于动物[1]、植物[2]、浮游生物[3-4]和海藻中[5]。内源性多胺可以与DNA、RNA和蛋白质结合,对生物的生长和发育起着重要作用[1,6-9]。外源性多胺可刺激植物细胞[10]和藻细胞的分裂增殖[11-12]。常见的多胺有腐胺、亚精胺,精胺和2-苯基乙胺。
多胺还被认为可以刺激和调控赤潮[11-13]。外源多胺可以刺激赤潮藻的生长,内源多胺对藻细胞的分裂增殖等有调节作用。腐胺和初级生产力存在正相关性也有报道,揭示了多胺在海洋氮循环中发挥着重要作用[14]。另外,多胺还可以加强藻毒素的毒性[15-16]。研究显示多胺是赤潮发生的一个重要调控因子,但由于海水中多胺浓度较低以及测定方法的限制,我国还没有海水中多胺浓度的报道。近年来,东海赤潮频发,成为我国赤潮的高发区[17],东海赤潮的发生机制成为广大海洋科学工作者研究的热点。本文采用高效液相色谱法测定了2010年6月东海海水中的游离态多胺含量及分布,为探究多胺在东海赤潮中的作用提供科学依据和参数。
1 材料与方法
1.1 海水样品的采集
于2010年6月8日到6月22日在长江口以及东海陆架(122.17°E~125.02°E,26.8°N~32.0°N)设置7个断面 (图1)。现场使用采水器分别采集表层、中层、底层水样,表层为水面下约1 m,中层为叶绿素最大层,底层为距海底 0~3 m海水样品经 GF/F膜(450℃灼烧4 h)过滤后储存在棕色玻璃瓶中(450℃灼烧4 h),于-20℃冷冻保存水样。
1.2 仪器和试剂
腐胺(putrescine,≥98%)、亚精胺(spermindine,≥98%)、精胺(spermine,≥97%)和丹磺酰氯(dansyl chloride,≥99%)均购自美国 Sigma公司;乙腈和丙酮为进口色谱纯试剂(Honeywell,Burdick&Jackson公司);1,6-己二胺(1,6-diaminohexane)、碳酸钠、氢氧化钠、硼酸钠、氨水、乙醚均为国产分析纯;实验用水为Milli-Q水(≥18.2MΩ)。采用Waters e2695高效液相色谱仪和Waters e2475荧光检测器进行测定。
1.3 海水样品游离态多胺的测定及分析方法
样品测定前解冻,取 1 mL的海水样品,加入70%的高氯酸,使其浓度达到 5%,4℃冰箱放置30 min。再加入 80 µL 2 mol/L 的 NaOH 溶液和 70 µL pH 9.18的硼酸,此时pH约为9,加入1mL丹磺酰氯(6 g/L丙酮)衍生剂,涡旋混匀30 s,40℃水浴避光反应45 min。加入40 µL 25%的浓氨水中止反应,静置30 min。再加入60 µL乙腈,用0.22 µm有机针头微孔滤膜过滤,最后采用高效液相色谱进样分析[18]。
图1 采样站位图Fig.1 Location of sampling stations
色谱柱为C18(150 mm×4.6 mm i.d.,5µm particle size,Agilent);荧光检测激发波长(Ex)340 nm,发射波长(Em)515 nm;柱温40℃;流动相A为乙腈,B为0.1 mol/L的醋酸铵(0.45 µm玻璃纤维滤膜过滤)。采用梯度洗脱,程序如下:0 min:A 35%,B 65%;0~10 min:A 35%~60%,B 65%~40%;10~15 min:A 60%~80%,B 40%~20%;15~20 min:A 80%~100%,B 20%~0;20~30 min:A 100%~35%,B 0~65%;30~35 min:A 35%,B 65%。衍生物进样量为10 µL,流速1.0 mL/min。在该实验条件下,2-苯基乙胺,腐胺、亚精胺、精胺得到了较好的分离,且三种胺工作曲线的相关系数都达到 0.999以上,检测限分别为 9.3×10-11、9.6×10-11、2.8×10-10、1×10-10mol/L。
对测定后的样品浓度采用sas9.1进行统计分析。
2 结果与分析
2.1 游离态多胺的浓度
由表1可以看出,主要的游离态多胺为腐胺和2-苯基乙胺,占总组成的比例为62%±15%和19%±11%,其次为精胺,所占比例分别为 14%±12%,亚精胺的含量最低,仅占总组成的比例的 6%±5%。不同的站位多胺的浓度变化较大。从各层总平均值看,除腐胺外,2-苯基乙胺、亚精胺和精胺在中层浓度最高。

表1 海水中游离态多胺的浓度Tab.1 Concentrations of free polyamines in East China Sea
2.2 游离态多胺的大面分布
由图2可以看出,2-苯基乙胺表层在长江口附近浓度较高,其次为杭州湾附近,各断面浓度由高到低为 Dh1、Dh3、Dh4、Dha、Dh2、Dh5、Dh6;中层在杭州湾附近浓度较高,各断面浓度由高到低为Dha、Dh3、Dh1、Dh4、Dh2、Dh6、Dh5;底层浓度较低,分布也较均匀,在调查区域的中东部出现高值,各断面浓度由高到低为Dh4、Dha、Dh3、Dh1、Dh6、Dh5、Dh2。
由图3可以看出,腐胺表层在长江口附近断面的浓度较高,Dh2断面浓度和其他断面浓度差异达到显著水平(P=0.0445),各断面浓度由高到低依次为Dh2、Dha、Dh4、Dh5、Dh1、Dh3、Dh6;中层在长江口附近和杭州湾附近断面浓度也较高,Dh2断面浓度和其他断面浓度差异达到显著水(P=0.031),各断面浓度由高到低依次为Dh2、Dha、Dh1、Dh6、Dh5、Dh4、Dh3;底层浓度最高,可能与生物尸体腐烂,蛋白质降解产生腐胺有关,各断面浓度由高到低依次为 Dh2、Dha、Dh4、Dh3、Dh5、Dh1、Dh6。

图2 2-苯基乙胺的大面分布(nmol/L)Fig.2 Distribution of free Pea (nmol/L)
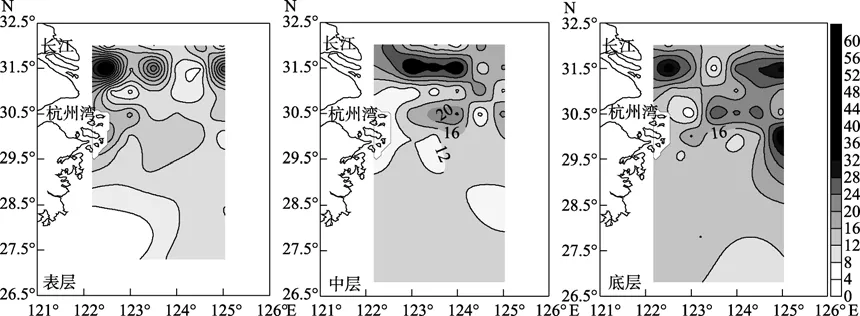
图3 腐胺的大面分布(nmol/L)Fig.3 Distribution of free Put( nmol/L)
亚精胺的浓度在四种胺中含量最低,表层在杭州湾附近南部和长江口附近断面的中部形成高值区,各断面浓度由高到低依次为Dh1、Dh3、Dh5、Dh2、Dh6、Dha、Dh4;中层和底层均在杭州湾附近区域出现高值区(图4),中层各断面浓度由高到低依次为Dha、Dh3、Dh1、Dh4、Dh2、Dh6、Dh5,底层各断面浓度由高到低依次为Dh2、Dha、Dh4、Dh3、Dh5、Dh1、Dh6。

图4 亚精胺的大面分布(nmol/L)Fig.4 Distribution of free Spd (nmol/L)
精胺表层在调查区域的西南部出现高值区,而长江口近岸附近浓度较低(图5),各断面浓度由高到低依次为 Dh6、Dh1、Dh5、Dh4、Dh3、Dh2、Dha;中层长江口附近浓度较低,而在调查区域的东部浓度较高,各断面浓度由高到低依次为 Dh5、Dh1、Dh6、Dh3、Dh2、Dha、Dh4;底层分布和中层较为相似,在调查区域的东南部出现高值,各断面浓度由高到低依次为 Dh5、Dh6、Dha、Dh3、Dh1、Dh4、Dh2。
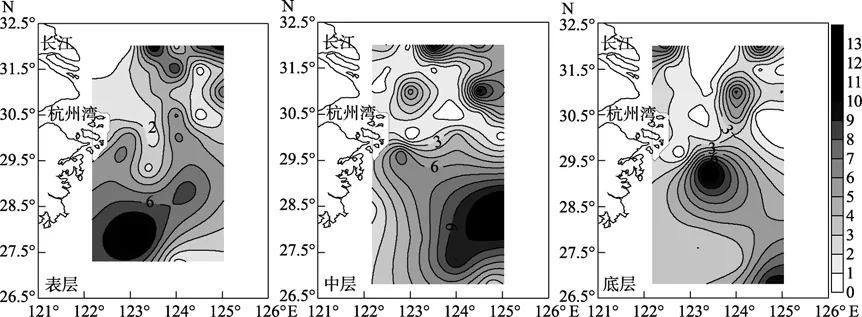
图5 精胺的大面分布(nmol/L)Fig.5 Distribution of free Spm (nmol/L)
2.3 游离态多胺在各断面的垂直分布
由表2可以看出,2-苯基乙胺在Dh2和Dh3断面的垂直分布形式为中层>表层>底层;Dha和Dh6的分布形式为中层>底层>表层;Dh4和 Dh5的分布形式均为底层>中层;除Dh4和Dh5外,2-苯基乙胺在其他断面的中层浓度均高于底层浓度。各断面浓度的总体平均值由高到低依次为Dha、Dh3、Dh4、Dh1、Dh2、Dh6、Dh5。
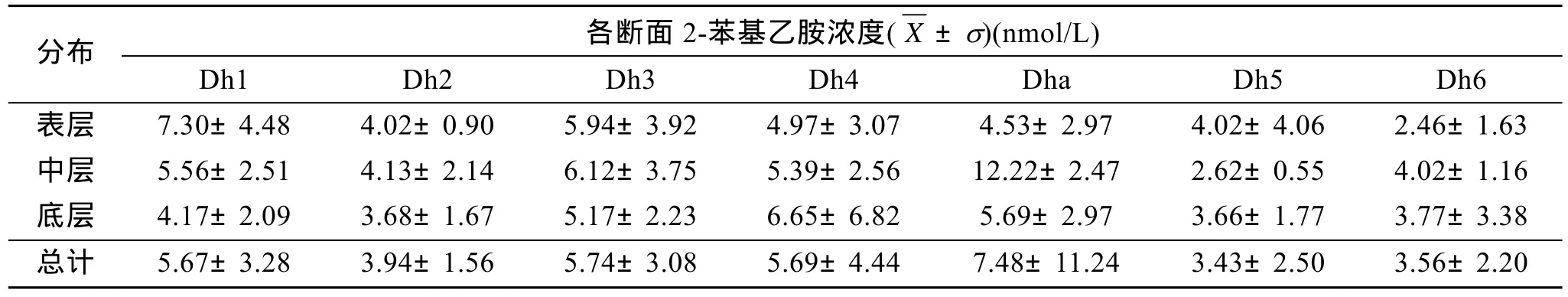
表2 2-苯基乙胺在各断面垂直分布Tab.2 The vertical distribution of Pea in 7 sections
由表3可以看出,腐胺在Dh3和Dha断面的垂直分布形式为底层>中层>表层;Dh4和 Dh5的垂直分布形式为底层>表层>中层;Dh1、Dh2和Dh6的垂直分布形式为中层>底层。除Dh1和Dh2外,腐胺大多数断面的底层浓度高于表层浓度。Dh2断面的腐胺浓度平均值可达27.37 nmol/L±14.22 nmol/L,显著高于其他断面(p<0.001),各断面浓度的总体平均值由高到低依次为 Dh2、Dha、Dh4、Dh1、Dh5、Dh3、Dh6。
由表4可以看出,亚精胺在Dh1、Dh3、Dh5断面的垂直分布均为表层>中层>底层;Dh4和 Dh6的垂直分布均为底层>中层>表层;除 Dh4和 Dh6外,亚精胺大多数断面的中层浓度高于底层。各断面浓度的总体平均值由高到低依次为 Dha、Dh3、Dh1、Dh5、Dh6、Dh4、Dh2。
由表5可以看出,精胺在Dh1和Dha断面的垂直分布为中层>表层>底层;Dh2、Dh4、Dh6断面的垂直分布为表层>中层>底层;Dh3和 Dh5的垂直分布为中层>底层>表层;精胺在所有断面的中层浓度都高于底层。各断面浓度的总体平均值由高到低依次为 Dh5、Dh6、Dh1、Dh3、Dh4、Dh2、Dha。
3 讨论
6月份海水中游离态腐胺的浓度最高,亚精胺的浓度最低。Nishibori发现日本濑户内海以亚精胺和腐胺为主,浓度分别为 0~4.4 nmol/L和 0~2.8 nmol/L[19]。Badini等[20]在研究亚得里亚海时发现海水中腐胺和亚精胺的浓度分别为 0~0.57 μmol/L和0~0.92 μmol/L,精胺为 0~0.02 μmol/L。2010 年4、5月份东海海水中主要的游离态多胺为精胺,由此可见,不同的海水样品多胺的浓度差异较大,同一区域海水在不同季节多胺浓度的差异也较大。
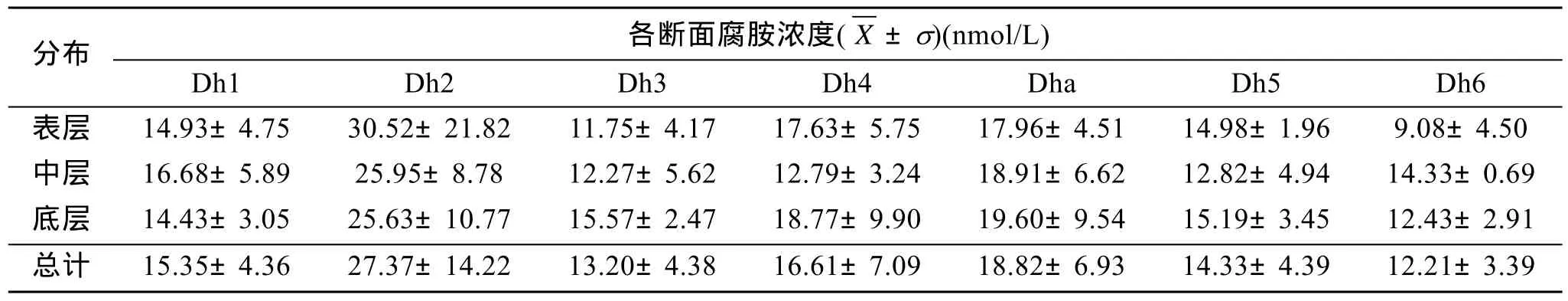
表3 腐胺在各断面的垂直分布Tab.3 The vertical distribution of Put in 7 sections

表4 亚精胺在各断面的垂直分布Tab.4 The vertical distribution of Spd in 7 sections
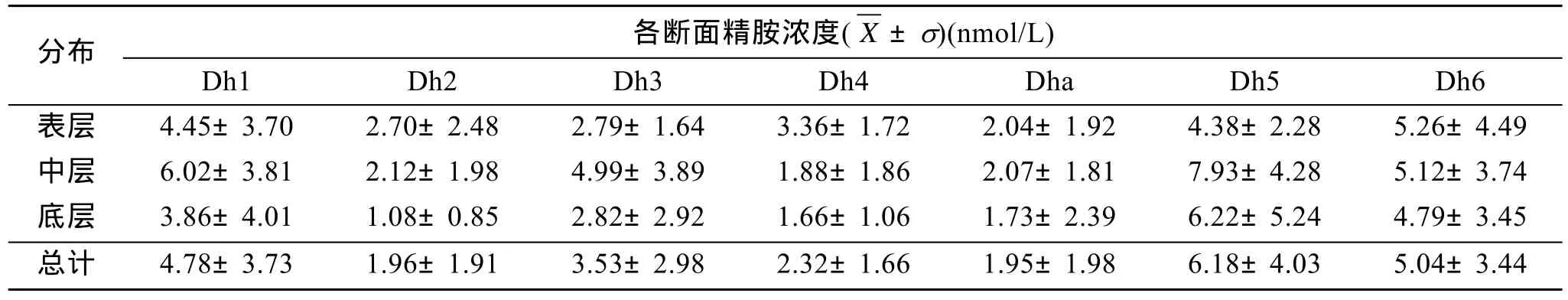
表5 精胺在各断面的垂直分布Tab.5 The vertical distribution of Spm in 7 sections
航次调查期间在 Dh1-3站位出现夜光藻赤潮,该站位亚精胺表层浓度达到 4.87 nmol/L,精胺表层和中层浓度分别为8.58 nmol/L 和11.98 nmol/L,远高于总体平均值。对4、5月份东海赤潮高发区的调查显示,2010年东海春季赤潮爆发区域的多胺的浓度大都较高,这与日本学者发现的濑户内海浮游植物大量繁殖区域多胺浓度较高一致[19]。
多胺的产生有三个条件,一是有可利用的自由氨基酸,二是有能分泌氨基酸脱羧酶的微生物存在;三是有适宜的环境条件,利于细菌的生长、脱羧酶的合成和提高脱羧酶活性[21]。氨基酸在适宜的条件下可直接转化为腐胺,腐胺再进一步转化生成亚精胺、精胺等。海洋环境中多胺的来源主要有以下四种途径:①死鱼及其他有机体的分解。在鱼类及其他有机体死亡后,蛋白质可被微生物降解成游离态的氨基酸,经过脱羧而形成相应的多胺。②生物在代谢过程中也会产生多胺类物质,例如鱼类、藻类等。③赤潮藻在消亡期会释放大量多胺。④外源输入。养殖废水等富含腐败蛋白质的废水排入大海,能产生多种可被藻类吸收的生物活性物质,包括多胺。但多胺极不稳定,光度较强、温度较高等,都会造成多胺的分解。另外,多胺可以被藻体等生物吸收、降解。因此海水中的多胺浓度会受到潮流、光照、温度、营养物质、生物等多种因素的影响。
从实验结果可以看出,2-苯基乙胺表层、腐胺和亚精胺表中底层均在长江口附近区域出现高值,这可能和长江冲淡水有关,一方面陆源物质中可能含有多胺以及多胺合成所需的氨基酸等,另一方面,该海区夏季适宜的光照和温度,使浮游植物大量繁殖[22],生物体在代谢过程中会释放多胺。2-苯基乙胺表中层、亚精胺表中底层及精胺的表层均在杭州湾附近区域出现高值,可能和该海区上升流的涌升带来丰富的营养物质有关,该区域也比较适合浮游植物的生长。这两个区域均为赤潮的高发区,由此可见,赤潮高发区夏季的多胺浓度也较高。
从总平均值看,2-苯基乙胺、亚精胺和精胺在中层的浓度最大,这可能是由于中层为叶绿素最大层,生物代谢旺盛,会像环境中释放多胺。大多数断面2-苯基乙胺、亚精胺和精胺的中层浓度均高于底层浓度可能也是这一缘故。腐胺在大多数断面的底层浓度高于表层浓度,可能是海底沉积物中含有蛋白质等,蛋白质降解时产生多胺,从而导致多胺浓度较高。
4 结论
我国东海海水中 6月份腐胺的含量最高,亚精胺的含量最低,占总组成的比例分别为 62%±15%和6%±5%。从大面分布看,四种游离态多胺的高值大都出现在长江口及杭州湾附近区域。从各断面的垂直分布看,2-苯基乙胺、亚精胺和精胺在大多数断面的中层浓度均高于底层浓度。腐胺在大多数断面的底层浓度高于表层浓度。夜光藻赤潮爆发处多胺的浓度相对较高。
[1]Vinci G,Antonelli M L.Biogenic amines:quality index of freshness in red and white meat[J].Food Control,2002,13(8):519-524.
[2]Minocha R,Long S.Simultaneous separation and quantitation of amino acids and polyamines of forest tree tissues and cell cultures within a single high-performance liquid chromatography run using dansyl derivatization[J].Journal of Chromatography A,2004,1035(1):63-73.
[3]Nishibori N,Nishijima T.Changes in polyamine levels during growth of a red-tide causing phytoplankton Chattonella antiqua (Raphidophyceae)[J].Eur J Phycol,2004,39(1):51-55.
[4]Nishibori N,Nishio S.Occurrence of polyamines in bloom forming toxic dinoflagellateAlexandrium tama-rense[J].Fisheries Science,1997,63:319-320.
[5]Nishibori N,Fujihara S,Nishijima L T.Changes in intracellular polyamine concentration during growth of Heterosigma akashiwo (Raphidophyceae)[J].Fisheries Science,2006,72(2):350-355.
[6]Theiss C,Bohley P,Voigt J.Regulation by polyamine of ornithine decarboxylase activity and cell division in the unicellular green alga Chlamydomonas reinhardtii[J].Plant Physiol,2002,128:1470-1479.
[7]Ober D,Gibas L,Witte L,et al.Evidence for general occurrence of homospermidine in plants and its supposed origin as by-product of deoxyhypusine synthase[J].Phytochemical,2003;62:339-344.
[8]Kotzabasis K,Senger H.Free,conjugated and bound polyamines during the cell cycle in synchronized cultures ofScenedesmus obliqus[J].Zeitschrift fur Naturforschung Teil C Biochemie Biophzsik Biologie Virologie,1994,49:181-185.
[9]Scoccianti V,Penna A,Penna N,et al.Effect of heat stress on polyamine content and proteinpattern inSkeletonema costatum[J].Marine Biology,1995,121:549-554.
[10]Smith T A.Polyamines[J].Annual Review of Plant Physiology,1985,36:117-143.
[11]Gentien P.Bloom dynamics and ecophysiology of theGymnodinium mikimotoispecics complex[J].Physiological Ecology of Harmful Algal Blooms,1998,41:155-173.
[12]Maestrini S Y,Balode M,Bechemin C,et al.Nitrogenous organic substances as potential nitrogen scources,for summer phyplankton in the Gulf of Riga,eastern Baltic Sea[J].Plankton Biol Ecol,1999,46:8-17.
[13]Iwasaki H.Growth physiology of red-tide microorganisms[J].Microbiol Sci,1984,1:179-182.
[14]Lee C,Jørgensen N O G.Seasonal cycling of putrescine and amino acids in relation to biological production in a stratifiedcoastal pond[J].Biogeochemistry,1995,29:131- 157.
[15]Legrand C,Johansson N,Johnsen G,et al.Phagotrophy and toxicity variation in the mixotrophicPrymnesium patelliferum[J].Limnol.Oceanogr,2001,46:1208-1214.
[16]Shilo M.Formation and mode of action of algal toxins[J].Bact Rev,1967,31:180-193.
[17]周名江,朱明远.我国近海有害赤潮发生的生态学、海洋学机制及预测防治研究进展[J].地球科学进展,2006,21 (7):673-679.
[18]付敏,赵卫红,苗辉,等.高效液相色谱法测定海水中游离态腐胺、亚精胺和精胺[J].分析化学,2010,38:1445-1449.
[19]Nishibori N,Matuyama Y,Uchida T.Spatial and temporal variations in free polyamine distributions in Uranouchi Inlet,Japan[J].Marine Chemistry,2003,82:307-314.
[20]Badini L,Pistocchi R,Bagni N.Polyamine transport in the seaweed Ulva Rigida (Chlorophyta)[J].Journal of Phycology,1994,30:599-605.
[21]Silla S M.Biogenic amines:their importance in foods[J].International Journal of Food Microbiology,1996,29:213-231.
[22]周名江,朱明远,张经.中国赤潮的发生趋势和研究进展[J].生命科学,2001,13(2):53-59.

