Periostin基因多态性与苏皖汉族人群冠心病发病的初步研究
周学军,纪 元,蒋建光,刘志平,王芳芳,丁志坚
(南京医科大学附属常州第二人民医院心内科,江苏常州,213000)
目前,冠心病(CAD)已成为人群死亡的主要疾病,阐明其发病机理并确定风险人群,成为社会的一大医疗挑战。血管内皮生长因子(VEGF)因对血管的调节作用在粥样斑块的增长以及不稳定斑块的形成中起重要作用,其影响主要通过它的特异性受体(KDR)传送[1-3]。因此,VEGF/KDR信号通路的调控,在血管生成和修复及冠心病的发生发展方面起着重要作用[4]。2007年,王一波等[5]研究发现,携带 KDR突变的人群更容易受到冠心病的侵害,并提示较高的冠心病危险可能是VEGF/KDR信号通路的下调导致。Periostin (POSTN)是属于fasciclin分子家庭的一种细胞外基质(ECM)蛋白,具有细胞黏附、迁移和分化作用[6]。Bagnato等[7]发现POSTN蛋白在血管内膜的生长和动脉粥样硬化的发展中发挥着有效的作用。另有一些研究表明[8-9],POSTN能调控乳腺癌细胞与人类毛细血管内皮细胞的 KDR表达。因此,我们推测POSTN多态性可能通过调节VEGF/KDR信号通路与冠心病易感性相关,并对POSTN基因多态性与苏皖汉族人群冠心病发病的关系进行了研究,现报道如下。
1 资料与方法
1.1 一般资料
将本院住院患者554例作为冠心病组,其中男338例,女216例,平均年龄(65.75±13.24)岁。纳入标准:经冠状动脉造影证实至少有1支主要冠状动脉狭窄50%以上,其中59.2%为心肌梗死患者。另选同期医院体检的正常人群687例作为对照组,其中男377例,女310例,平均年龄(63.03±13.64)岁。心电图、胸片、腹部超声及肝肾功能均正常,排除心力衰竭、周围血管疾病、瓣膜病、风心病、肺心病、肿瘤、结缔组织、骨折以及其他与POSTN相关疾病。2组人群均为苏皖地区汉族人,无血缘关系,且均对检测知情同意。
1.2 主要仪器和试剂
AU2700全自动生化分析仪(OL YMPUS), PCR扩增仪(Biometra2TGRADIENT),UVI自动凝胶成像分析系统(Bio2Rad,Quan ity one), TaqDNA聚合酶(TaKaRa)、dNTPs(单脱氧核糖核酸混合物)(TaKaRa)、上下游引物(TaKaRa)、限制性内切酶(New England Biolabs)。
1.3 方法
1.3.1 询问一般情况:详细询问每人的疾病史、家族史、个人史、吸烟饮酒史、身高、体重和血压等人群基线资料,并做好记录。
1.3.2 血标本采集:所有研究对象均在禁食12h后,于清晨采肘静脉血2 mL,32 g/L枸橼酸钠抗凝,分离血浆和白细胞,-70℃保存,备用。记录填写冠心病患者资料表并附出院小结一份。
1.3.3 基因组DNA的提取:采用酚-氯仿法提取白细胞基因组DNA,加入4 0μL TE保存(10 mmol/L Tris2HCl,1 mmol/L EDTA,pH 8. 0),-70℃保存。
1.3.4 POSTN基因SNP位点的选取:启动子区的POSTN SNP A2953T位点因为对基因转录调控的潜在影响被选中。这个位点可能通过调控血管生长影响乳腺癌发生发展;此外,dbSNP数据库显示,这个单核苷酸多态性在中国人群中存在;而且,我们进行的小样本预实验显示,这个单核苷酸多态性在我们研究的人群中存在。
1.3.5 PCR扩增:引物由大连宝生物工程有限公司合成,上游引物为5′2CCCTCTAAGATA2 CAAAGGAA23′;下游引物为 5′2CCTGATAC2 GACTATGAGCC23′。PCR反应体系为50μL,包括 :1 0×缓冲液5μL,Mg2+终浓度为2.0 mmol/L,4种dNTP终浓度为0.2 mmol/L,上下游引物各 20 pmol,Taq DNA酶 1.25 U (TaKaRa)和DNA模板100 ng。PCR反应条件: 9 4℃预变性5 min,然后按9 4℃6 0 s,5 8℃50 s,72℃60 s进行30个循环,终末延伸72℃5 min。
1.3.6 限制性内切酶酶切、电泳及测序:取5μL PCR产物用5 U限制性内切酶SspI于37℃温育12 h,产物经30 g/L琼脂糖凝胶电泳,凝胶成像系统判断基因型。基因型分为AA纯合型(221 bp);AT杂合型(175,143和33bp)和TT纯合型(142和33 bp)。部分PCR扩增产物进一步测序鉴定。
2 结 果
2.1 临床资料
与对照组相比,冠心病组有更多的老年人(P<0.0 1)、男性(P<0.0 5)、高血压者(P<0.01)、吸烟者(P<0.01)或糖尿病者(P<0.01);血浆甘油三酯(TG)(P<0.01)、高密度脂蛋白胆固醇(HDL2C)(P<0.01)和低密度脂蛋白胆固醇(LDL2C)(P<0.01)水平冠心病组与对照组差异均有统计学意义。见表1。
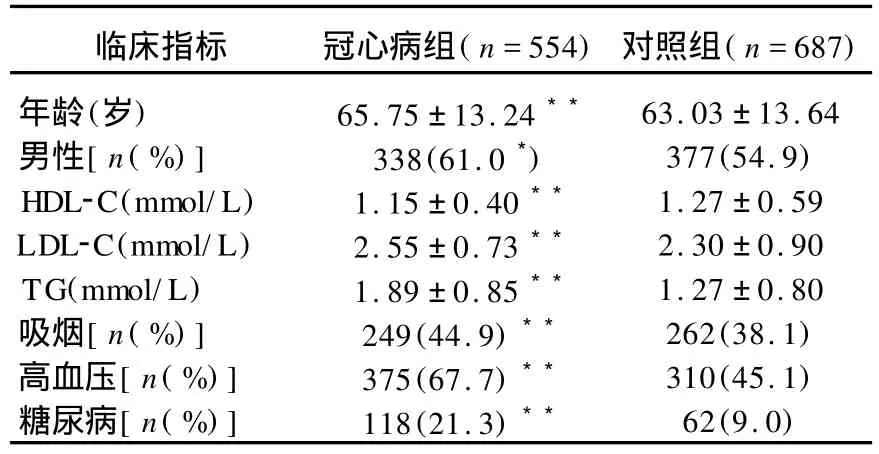
表1 2组临床资料比较
2.2 基因型分布
对照组基因型频率遵循Hardy2Weinberg平衡(χ2=0.033,P=0.857),具有群体代表性。POSTN A2953T基因型分布:冠心病患者(AA型275例,AT型202例,TT型16例),正常人群(AA型368例,AT型266例,TT型31例), 2组分布无显著性差异(χ2=1.982,df=3, P=0.576)。T等位基因(T allele)频率两组分布无显著性差异(P=0.122)。见表2、图1。优化后的logistic回归模型包含年龄、性别、HDL2C、LDL2C、TG、吸烟状况、糖尿病和高血压的患病状况。Hosmer and Lemeshow检验P值为0.0 0 5 (χ2=22.206,df=8)。
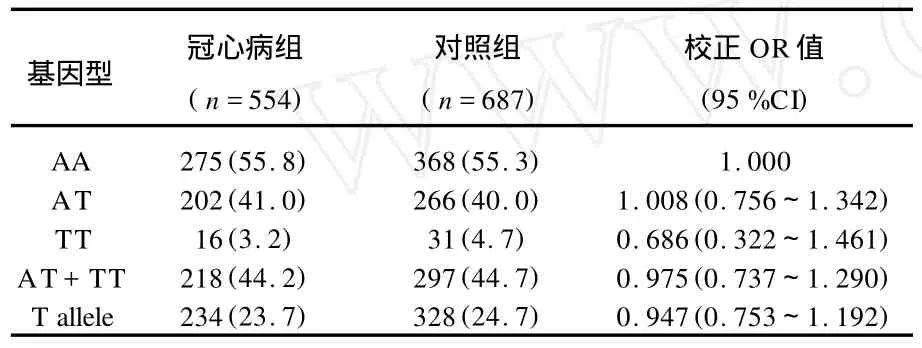
表2 POSTN基因型分布比较[n(%)]
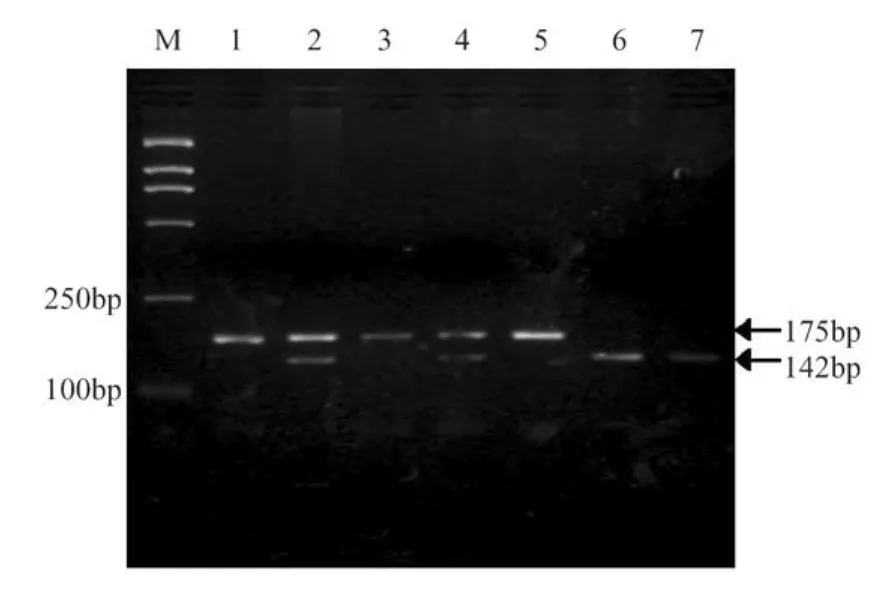
图1 POSTN A2953T基因型
3 讨 论
POSTN蛋白最初于 1993年由日本学者Takeshita等从小鼠成骨细胞株中克隆成功,分子量为90 KD,由838个氨基酸组成,是由心脏成纤维细胞分泌表达的一种ECM蛋白。POSTN基因定位于人类染色体13q13.3区域,长度为3 213 bp,编码838个氨基酸,是心脑血管病的重要候选基因。
POSTN SNP A2953T位点位于启动子区内。转录子数据库系统(TESS)显示,A2953T SNP T等位基因可形成了一个假定的c2myb基因和GA2 TA21转录结合位点,而A等位基因可形成了一个假定的 SOX25转录因子结合位点,因此, POSTN A2953T SNP突变可导致启动子区基因转录调节作用发生变化,从而影响POSTN蛋白的合成。Forsti等[9]已证实,这个位点可能通过调控血管生长影响乳腺癌发生发展进程。
POSTN与动脉粥样硬化发生、发展的关系,已经得到许多实验的证实。Lindner等[10]发现,在大鼠颈动脉球囊损伤模型中,损伤动脉血管内膜中POSTN的mRNA和蛋白表达量明显上调。另外实验表明[11],大鼠肺动脉平滑肌细胞在低氧应激反应下(一种类似动脉粥样硬化发病过程的病理状态),POSTN分泌水平明显上调。此外,在乳腺癌人群中,POSTN表达与血管生成密切相关[8]。因此,推测 POSTN可能通过调节VEGF/KDR信号通路与冠心病易感性相关。
本项研究首次证实POSTN A2953T位点TT基因型在中国人群中存在,填补了 HAPMAP HCB数据库的空白。同时证实POSTN基因A2 953T位点多态性分布在本项研究人群中的存在,分布频率基本与HAPMAP HCB数据库相符。
但在本项研究中,POSTN基因的多态性未发现与CAD发病风险明显相关。可能以下因素有关:首先,不同的种族差异导致不同的遗传差异,POSTN与动脉粥样硬化的研究大多为国外人群研究,汉族人群研究较少,在本研究中国人群未发现POSTN基因多态性与CAD发病风险相关,不代表国外人群情况;其次,POSTN A2953T位点TT基因型在中国人群分布频率较低,可能影响统计效率;此外,本研究只对POSTN基因启动子区的一个功能性位点进行了研究,可能其他一些基因多态性位点与CAD或其他心血管事件的风险相关;另外,POSTN基因变异对冠心病的作用,可能与环境因素和其他基因的交互作用有关;当然,也有可能POSTN存在于动脉粥样硬化斑块中只是一个偶然现象,而不直接参与动脉粥样硬化斑块的病理活动。这些都需进一步扩大样本量,进行不同人群重复试验。
本研究证实,POSTN A2953T位点TT基因型在中国人群中存在,POSTN基因A2953T位点多态性分布中国人群中存在,补充了POSTN基因多态性的数据库信息;但POSTN基因多态性与中国人群冠心病发病危险未发现明显相关。该研究结果尚需进行更大样本的前瞻性重复性研究。
[1] Marzilli M,Merz C N,Boden W E,et al.Obstructive coro2 nary atherosclerosis and ischemic heart disease:an elusive link![J].J Am Coll Cardiol,2012,60(11):951.
[2] Khurana R,Simons M,Martin J F,et al.Role of angiogen2 esis in cardiovascular disease:a critical appraisal[J].Circula2 tion,2005,112(12):1813.
[3] Nikol S.Therapeutic angiogenesis for peripheral artery dis2 ease:gene therapy[J].Vasa,2007,36(3):165.
[4] Koch S,Claesson-Welsh L.Signal transduction by vascular endothelial growth factor receptors[J].Cold Spring Harb Per2 spect Med,2012,2(7):a006502.
[5] Wang Y,Zheng Y,Zhang W,et al.Polymorphismsof KDR gene are associated with coronary heart disease[J].Journal of the American College of Cardiology,2007,50(8):760.
[6] Kudo Y,Siriwardena BS,Hatano H,et al.Periostin:novel diagnostic and therapeutic target for cancer[J].Histology and histopathology,2007,22(10):1167.
[7] Bagnato C,Thumar J,Mayya V,et al.Proteomics analysis of human coronary atherosclerotic plaque:a feasibility study of direct tissue proteomics by liquid chromatography and tan2 dem mass spectrometry[J].Mol Cell Proteomics,2007,6 (6):1088.
[8] Binion DG,Otterson MF,Rafiee P.Curcumin inhibits VEGF-mediated angiogenesis in human intestinal microvas2 cular endothelial cells through COX-2 and MAPKinhibition [J].Gut,2008,57(11):1509.
[9] Forsti A,Jin Q,Altieri A,et al.Polymorphisms in the KDR and POSTN genes:association with breast cancer susceptibil2 ity and prognosis[J].Breast cancer research and treatment, 2007,101(1):83.
[10] Lindner V,Wang Q,Conley BA,et al.Vascular injury in2 duces expression of periostin:implications for vascular cell differentiation and migration[J].Arteriosclerosis,thrombo2 sis,and vascular biology,2005,25(1):77.
[11] Li P,Oparil S,Feng W,Chen YF.Hypoxia-responsive growth factors upregulate periostin and osteopontin expres2 sion via distinct signaling pathways in rat pulmonary arterial smooth muscle cells[J].J Appl Physio,2004,97(4):1550.

