成人缺血缺氧性脑病脑葡萄糖代谢减低的特点和分级
苏玉盛,马云川,尚建文,王曼,张琳瑛
缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)是指因心跳呼吸骤停、窒息、中毒、电击伤等所导致的脑缺血缺氧性损害和由此引发的一系列神经精神症状的一种临床综合征[1],新生儿较常见,成人少见。国内仅有几篇有关该病MRI的报道[2-5],但PET影像学方面报道极少。
1 资料与方法
1.1 一般资料
1.1.1 HIE组 2008年~2011年宣武医院康复科26例HIE住院患者,其中男性20例,女性6例;年龄21~67岁,平均34岁;病后4~36 d入院,平均20 d;病因分类[7]:循环障碍性缺氧11例(42.3%):各种类型休克7例,心脏骤停复苏后4例;低氧性缺氧9例(34.6%):机械性窒息6例,麻醉意外2例,溺水1例;贫血性缺氧6例(23.1%):大量失血、一氧化碳中毒各3例。所有患者均有明确脑部缺氧病史,且有脑部弥漫性受损表现,符合HIE诊断[6]。
1.1.2 对照组 选择2009年~2011年来本科行健康检查者20名,其中男性14名,女性6名;年龄32~73岁,平均46岁。经临床体格检查及CT或MRI检查确认无脑血管病,并排除其他系统严重疾病。
1.2 显像方法 采用EXACT 47 PET扫描仪(德国Siemens公司),轴向视野为16.2 cm,透射源为68Ge。受检者空腹6 h以上,控制血糖至正常范围(4.44~6.67 mmol/L)。封闭视听30 min后肘静脉注射18F-FDG 5.55 MBq/kg,注射药物后安静休息,注意视听封闭,避免紧张体位,40 min后行脑3D静态采集,发射扫描采集计数达9.6×107,透射扫描5 min。经计算机滤波反投影法进行图像重建,获得横断面、冠状面和矢状面断层影像。
1.3 影像数据处理及分析方法
1.3.1 目视法分析 由2名有经验的核医学医师通过目视法分析,患者PET图像出现连续2个或2个以上层面出现的减低或缺损视为异常。重点观察代谢减低区的部位、范围和程度。
1.3.2 统计参数图(statistical parameter mapping,SPM)分析 在Matlab 6.5平台上,应用SPM2软件对PET原始图像每一个像素点数据进行分析。先对大脑图像进行标准化处理,采用线性仿射变换和非线性变换法将不同受试者PET脑图像统一投射到一个标准脑模板上,并经数学换算将标准脑内各部位像素点对应至Talairach标准脑图谱。然后用9×9×9 mm的高斯滤波进行平滑处理,以提高图像的信噪比。本研究参数估计选用两独立样本t检验,设统计学检验标准α=0.001(未校正),对两组进行统计学分析。设定HIE组为代谢减低,有差异体素阈值设定为30个体素,即连续差异有统计学意义的体素达到30个以上就考虑该区域葡萄糖代谢有差异,将所得到的代谢减低区投射到三方位立体脑图像上,根据Talariach坐标值并结合Talairach标准脑图谱(该图谱来自于一个尸体标本,通过对尸脑标本断层切割,在矢向断面勾勒脑部各组织结构,以彩色绘图形式描述脑部解剖结构信息)确定具体部位,通过KE值代表激活区范围的大小[8]。
2 结果
2.1 HIE患者脑葡萄糖代谢减低的特点
2.1.1 目视分析法 HIE组中:①葡萄糖代谢减低以双侧性减低为主,单侧性减低2例(7.7%),双侧性减低24例(92.3%);②双侧基底节和丘脑代谢减低最为明显,仅1例(3.8%)患者双侧基底节和丘脑代谢大致正常,其余25例(96.2%)患者双侧基底节和丘脑均呈现不同程度的代谢减低;③大脑皮质各叶出现代谢减低的程度不同,20例(76.9%)额叶代谢减低,14例(53.8%)枕叶代谢减低,11例(42.3%)顶叶代谢减低,5例(19.2%)颞叶代谢,按易受损程度从高到低依次为额叶、枕叶、顶叶和颞叶。
2.1.2 SPM分析法 HIE组阳性率100%,表现为局灶性和弥漫性脑葡萄糖代谢减低激活区。
2.2 HIE患者分级 将基底节和丘脑作为评价葡萄糖代谢损伤程度的重要靶区,结合脑皮质损害情况,将成人HIE代谢损伤程度分为三级:Ⅰ级(轻度损伤):双侧基底节和丘脑代谢大致正常,同时并发大脑皮质单部位轻、中度代谢减低。Ⅱ级(中度损伤):双侧基底节和丘脑代谢中度减低,同时并发大脑皮质单部位或多部位轻、中度代谢减低。Ⅲ级(重度损伤):双侧基底节和丘脑代谢重度减低,同时并发大脑皮质单部位或多部位中、重度代谢减低。见图1。
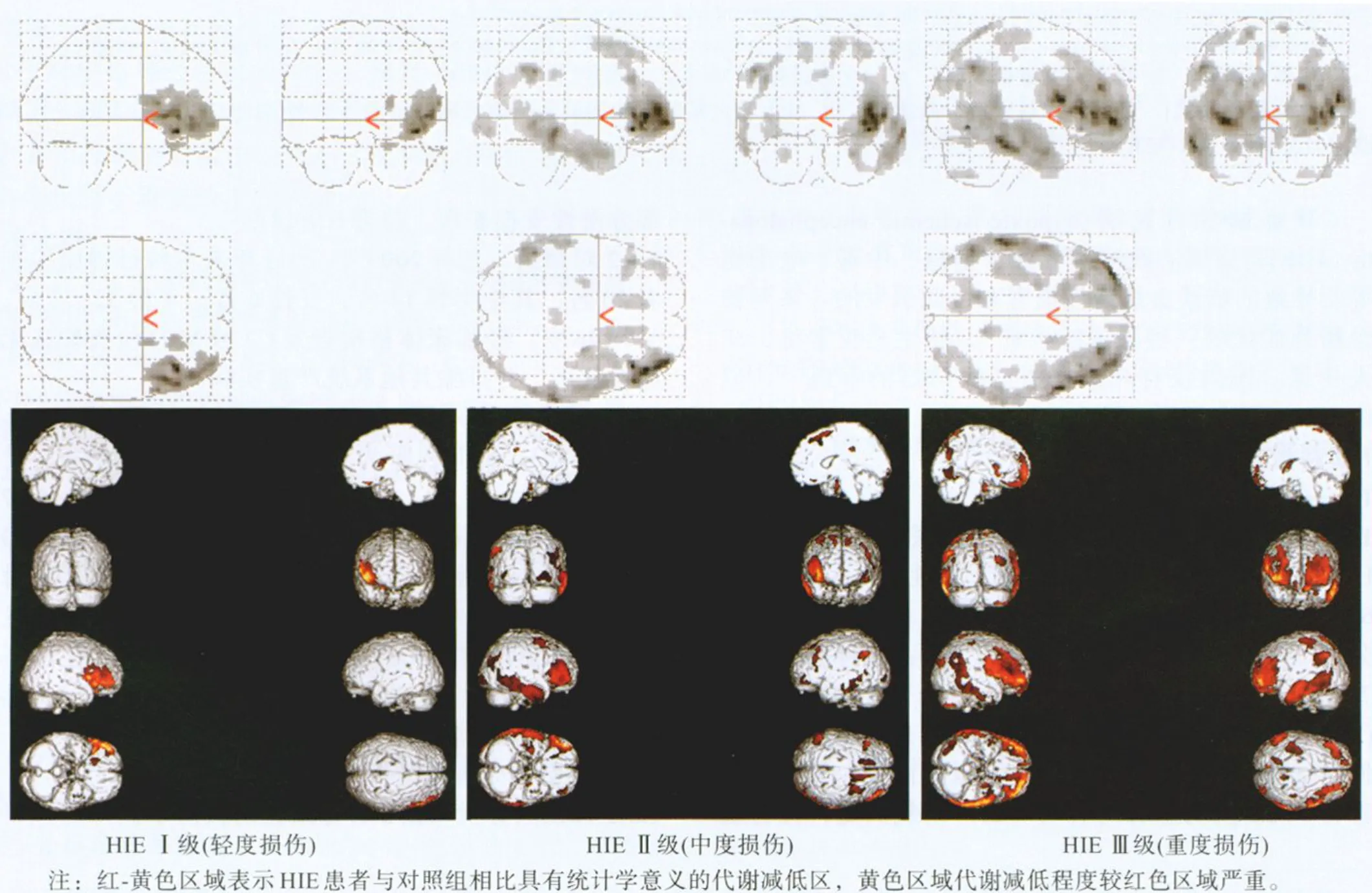
图1 HIE患者PET显像SPM分析结果图
按上述方法分级,26例HIE患者中,Ⅰ级2例(KE值<100),Ⅱ级19例(100
3 讨论
随着医学科学技术的进步,尤其是心肺复苏技术及重症监护的发展,越来越多的HIE患者得以存活。一部分患者的意识很快恢复,但也有一部分出现不同形式的意识障碍,如植物状态及最小意识状态。而此类患者面临社会及经济等多方面问题,只有做出正确的评估及预测,才能了解治疗的有效性,患者才不会丧失治疗的机会。但由于意识变化是细微的,运动反应有不一致性,故对其临床评估比较困难。
临床上,目前评估患者意识障碍及严重程度常用的方法包括:(Glasgow Coma Scale,GCS)评分,JFK量表(JFK Coma Recovery Scale)及Rappaport量表等。尽管这些量表对评估意识障碍的严重程度有积极作用,但受限于临床检查者的临床经验,对患者轻微的意识变化很难做出准确的判断。特别是最小意识状态、植物状态患者以及失语症患者等,则不易使用。这就要求临床检查者具备丰富的临床经验,结合神经电生理及神经影像学。
神经影像学方面,脑葡萄糖代谢显像是脑的功能性显像,可以探查到脑代谢等功能方面的变化,这些变化常常在脑的结构性损伤之前出现,是疾病早期的病理生理异常表现,对HIE的评估和判断预后有明显优势。曾有国外学者研究认为,缺血缺氧性脑损伤后昏迷患者的脑代谢率为正常脑组织50%~70%[9-12],从缺氧性昏迷恢复过来的患者脑葡萄糖代谢率为正常范围的75%[13]。在植物状态时,脑干是无损的,而双侧大脑半球的灰、白质有广泛的严重损害,植物状态患者的全脑皮质代谢值是正常范围的40%~50%[14]。在持续植物状态(persistent vegetative state,PVS)患者,脑代谢值降至正常的30%~40%。
本研究发现,HIE患者的脑葡萄糖代谢减低绝大多数是双侧性的,是以双侧基底节和丘脑代谢减低最为显著,分析其原因可能为:①病理学研究提示,基底节各核团对缺氧特别敏感;②苍白球是由大脑中动脉的深穿支豆纹动脉供血,其特殊的构造及走行极易造成所供部位的缺血;③目前研究发现,基底节对缺血缺氧的易损性与谷氨酸受体的区域分布有关[15]。因此,本研究首次提出将基底节和丘脑作为评价代谢损伤程度的重要靶区,结合脑皮质损害情况,将HIE患者进行分级,用以指导临床治疗和预后评价。
总之,脑葡萄糖代谢显像对HIE的评价具有许多其他检查方法无可比拟的优越性,能够明确本病的损害部位、范围及程度,并能够对HIE患者进行分级,为评估预后提供科学依据。
[1]周光斗,刘振华,陈俊抛.临床神经疾病诊断学[M].广州:广东科技出版社,2003,536:686-687.
[2]明兵,李振勋,高源统,等.新生儿窒息早期的MRI表现及预后的关系[J].中华放射学杂志,2002,36(7):637-640.
[3]Takahashi S,Higano S,Ishii K,et al.Hypoxic brain damage:cortical laminar necrosis and delayed changes in white matter at sequential MRimaging[J].Radiology,1993,189(2):449.
[4]Ment LR,Bada HS,Barnes P,et al.Practice parameter:neuroimaging of the neonate:report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society[J].Neurology,2002,58(6):1726-1738.
[5]Chalela JA,Wolf RL,Maldjian JA,et al.MRI identification of early white matter injury in anoxic-ischemic encephalopathy Julio A[J].Neurology,2001,56(2):481-485.
[6]孙红斌,王学峰.神经系统的理论与实践[M].成都:四川科学技术出版社,1997:286.
[7]胡维铭,王维治.神经内科主治医师700问[M].2版.北京:中国协和医科大学出版社,2000:896.
[8]Talairach J,Tournoux P.Coplanar Stereotaxic Atlas of the Human Brain[M].Stuttgart:Thieme Medical,1988.
[9]Hattori N,Huang SC,Wu HM,et al.Correlation of regional metabolic rates of glucose with Glasgow coma scale after traumatic brain injury[J].JNucl Med,2003,44(11):1709-1716.
[10]Schaafsma A,de Jong BM,Bams JL,et al.Cerebral perfusion and metabolism in resuscitated patients with severe post-hypoxic encephalopathy[J].JNeurol Sci,2003,210:23-30.
[11]Tommasino C,Grana C,Lucignani G,et al.Regional cerebral metabolism of glucose in comatose and vegetative state patients[J].Neurosurg Anesthesiol,1995,7(2):109-116.
[12]Bergsneider M,Hovda DA,McArthur DL,et al.Metabolic recovery following human traumatic brain injury based on FDG-PET:time course and relationship to neurological disability[J].Head Trauma Rehabil,2001,16(2):135-148.
[13]DeVolder AG,Goffinet AM,Bol A,et al.Brain glucose metabolism in postanoxic syndrome:positron emission tomographic study[J].Arch Neurol,1990,47(2):197-204.
[14]Boly M,Faymonville ME,Peigneux P,et al.Auditory processing in severely brain injured patients:differences between the minimally conscious state and the persistent vegetative state[J].Arch Neurol,2004,61(2):233-238.
[15]朱文珍,漆建平,夏黎明,等.新生儿缺血缺氧性脑病的MRI研究现状[J].放射学实践,2003,8(3):154-157.

