NaCl胁迫对不同耐盐黄瓜品种生长及根区土壤酶活性的影响
赵 索 吴凤芝
(东北农业大学园艺学院,黑龙江哈尔滨 150030)
由于温室、大棚等栽培条件下的土壤缺少雨水淋洗,且温度、湿度、通气状况和水肥管理等均与露地栽培有较大差别,加之设施栽培又长期处于高集约化、高复种指数、高肥料施用量的生产状态下,其特殊的生态环境与不合理的水肥管理措施导致了土壤盐渍化、养分不平衡、土壤酸化等诸多生产问题的产生,其中最为突出的是土壤盐渍化,它不仅直接危害作物的正常生长,而且也易引发其他相关生产问题(殷永娴和刘鸿雁,1996;余海英 等,2005)。如何提高作物的耐盐性、增加在盐胁迫下农作物的产量一直是人们关注的焦点。黄瓜是设施栽培的主要蔬菜种类之一,容易受到盐胁迫的影响(郁继华 等,2004),但是不同基因型对盐的忍耐性存在较大差异(王素平 等,2006)。前人关于植物耐盐机理的研究主要集中在植物生理生化代谢方面。耐盐性通常是复杂的多基因性状(Flowers,2004),植物的耐盐性机制有很多方面,包括细胞的渗透调节作用(许兴 等,2002;韩志平 等,2010)、盐分离子的选择吸收与区域化分布(高K+/Na+比的保持)(孙小芳和刘友良,2000;马德源 等,2009)、细胞膜的稳定性以及糖类物质代谢活性(Gao et al.,1998;袁琳 等,2005)、氮类物质合成(Aziz et al.,1999;Santa-Cruz et al.,1999)、矿质营养(魏国强 等,2004)等。研究表明,同种植物不同品种的根系分泌物组分不同,而根系分泌物的差异会导致根际微生物群落结构和土壤酶活性的变化,土壤生物学环境的变化会影响土壤养分的利用率、植物的生长状况和抗逆性等(袁虹霞 等,2002;张俊英等,2007;Kong et al.,2008;张立芙 等,2009)。因此,同种植物的不同品种根际土壤生态学指标的差异(如根际土壤酶活性的不同)可能与植物耐盐性存在一定的关系,周德平等(2011)的研究表明土壤盐胁迫强度与土壤脲酶、蛋白酶、转化酶和过氧化氢酶活性在各个时间点上都呈高度线性负相关。但不同耐盐品种在盐胁迫下土壤酶活性的变化未见报道。
土壤是一个活的生态系统,土壤中所进行的一切生化过程都受控于土壤酶活性。土壤酶主要来源于土壤微生物和动植物残体腐解过程中释放的酶,是表征土壤中物质、能量代谢旺盛程度和土壤质量水平的一个重要生物指标(Pagliai & Nobili,1993;涂书新 等,2000;Ferando &Carmen,2005)。土壤酶活性与植物生长和产量密切相关(杨丽娟 等,2000)。Kandeler 等(1999)认为,几乎所有的土壤生态系统退化都伴随着不同程度的土壤酶活性下降。设施土壤盐渍化不仅会影响作物生长,还会直接影响土壤酶和土壤微生物活性,通过改变土壤的部分理化性质来间接地影响土壤微生物的生存环境(章家恩 等,2002)。因此,设施内土壤盐渍化会对土壤微生物区系和植物生长发育产生明显的作用,从而对土壤酶活性产生直接或间接的影响,因此研究设施内土壤盐渍化对黄瓜根区土壤酶活性的影响对黄瓜生产具有一定指导意义。
本试验在温室条件下以不同耐盐黄瓜品种为试材,以NaCl 为盐胁迫条件,研究NaCl 胁迫对不同耐盐黄瓜品种生长和根区土壤酶活性的影响,以期探明不同耐盐黄瓜品种土壤酶学特征,为缓解设施土壤盐渍化奠定一定理论基础。
1 材料与方法
1.1 试验材料
试验于2010年7~12月在东北农业大学园艺试验站日光温室和园艺学院蔬菜生理生态研究室进行。黄瓜(Cucumis sativus L.)耐盐品种津春5 号和盐敏感品种津优1 号(张景云和吴凤芝,2009)均由天津科润黄瓜研究所育成。试验土壤为黑土,基本理化性质为:有机质含量36.24 g·kg-1,碱解氮86.92 mg·kg-1,速效磷136.17 mg·kg-1,速效钾150.12 mg·kg-1,EC 值475 μS·cm-1,pH 值7.52,指标测定按照鲍士旦(2005)的方法。
1.2 试验设计
采用槽式栽培,每槽面积约为2 m2(4.08 m×0.48 m),槽内设有软管滴灌,土壤过筛除杂,将NaCl 用自来水溶解后拌入土壤中并保证盐水的量浸透土壤而不渗出,使其终浓度为525 mg·kg-1,以拌入同样水量的土壤为对照。每槽填土195 kg,土厚35 cm,每槽土壤饱和持水量约为78 L,槽底铺有地膜(张景云和吴凤芝,2009)。
试验选用2 个黄瓜品种,每个品种设1 个清水对照,共4 个处理。每个处理20 株,3 次重复,各处理采用完全随机排列,并设有保护行。另外,设不种植物的拌盐土壤与不拌盐土壤栽培槽各1 个为无苗对照。试验处理及编号见表1。黄瓜幼苗于四叶一心时(8月12日)定植在栽培槽内,磷酸二胺和硫酸钾按1m∶1m混合,定植时撒入定植穴内,每穴30 g;无苗对照不施肥,但同时浇水,保持同样的土壤含水量,之后常规管理。
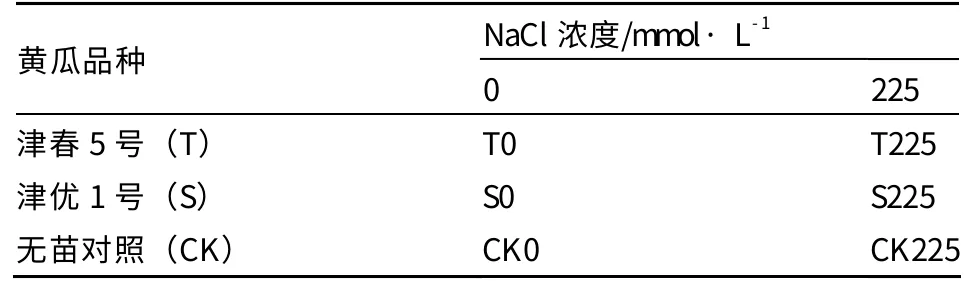
表1 试验设计
1.3 项目测定
分别于定植后30、40、50 d 进行形态指标的测定,单株产量采用小区测产法测定;叶面积采用打孔法测定;干质量采用鲜样烘干法(郝再彬 等,2004)测定。每次取样各处理随机取3 株,3 次重复。
分别于定植后30、40、50 d 取距根部10 cm 以内的根区土壤样品,每次取样各处理随机取3 株黄瓜的根区土壤,3 次重复,土样过20 目筛,保存于4 ℃冰箱中,用于土壤酶活性的测定。参照严昶升(1988)的方法:土壤脲酶活性采用靛酚蓝比色法测定;土壤中性磷酸酶活性采用磷酸苯二钠比色法测定;土壤脱氢酶活性采用三苯基四氮唑氯化物(TTC)比色法测定;土壤过氧化氢酶活性采用高锰酸钾滴定法测定。
1.4 数据处理
原始数据的整理采用Microsoft Excel(Office 2003)软件,数据处理采用SAS 8.1 软件,方差分析使用ANOVA 过程。
2 结果与分析
2.1 盐胁迫对不同耐盐黄瓜品种单株产量的影响
图1 表明,在非盐处理条件下,不同耐盐黄瓜品种单株产量差异不显著,盐敏感黄瓜品种(S0)单株产量最高,达到805 g·株-1。盐处理的两黄瓜品种(S225、T225)单株产量均显著低于非盐处理;盐处理条件下,耐盐品种(T225)的单株产量显著高于盐敏感品种(S225)。
2.2 盐胁迫对不同耐盐黄瓜品种植株叶面积的影响
图2 表明,随着黄瓜生长,植株叶面积整体呈现增加的趋势。定植后30 d 盐处理和非盐处理条件下,两黄瓜品种间叶面积均无显著差异;盐处理的黄瓜植株叶面积显著低于非盐处理。定植后40、50 d,非盐处理条件下盐敏感品种(S0)叶面积高于耐盐品种(T0),在定植后50 d 达显著差异;盐处理条件下盐敏感品种(S225)叶面积低于耐盐品种(T225),在定植后50 d 达显著差异。说明在受到相同程度的盐胁迫情况下,耐盐品种表现出较强的适应性。
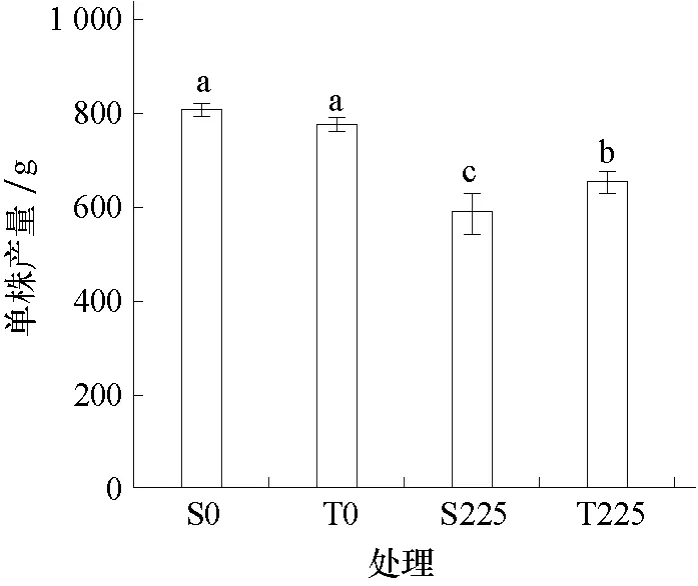
图1 盐胁迫对不同耐盐黄瓜品种单株产量的影响
2.3 盐胁迫对不同耐盐黄瓜品种全株干质量的影响
图3 表明,随着黄瓜生长,全株干质量整体呈现增加的趋势。非盐处理条件下,盐敏感品种(S0)全株干质量高于耐盐品种(T0),在定植后30、40 d 时差异显著;盐处理条件下,盐敏感品种(S225)全株干质量显著低于耐盐品种(T225)。盐处理的耐盐品种(T225)全株干质量均低于非盐处理(T0),在定植后50 d 达到显著差异;盐处理的盐敏感品种(S225)全株干质量在定植后30、40、50 d均显著低于非盐处理(S0)。
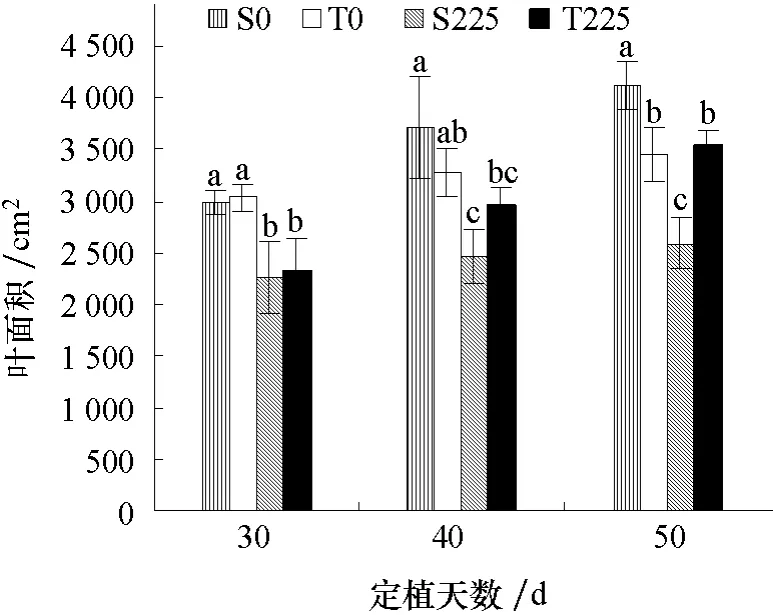
图2 盐胁迫对不同耐盐黄瓜品种叶面积的影响
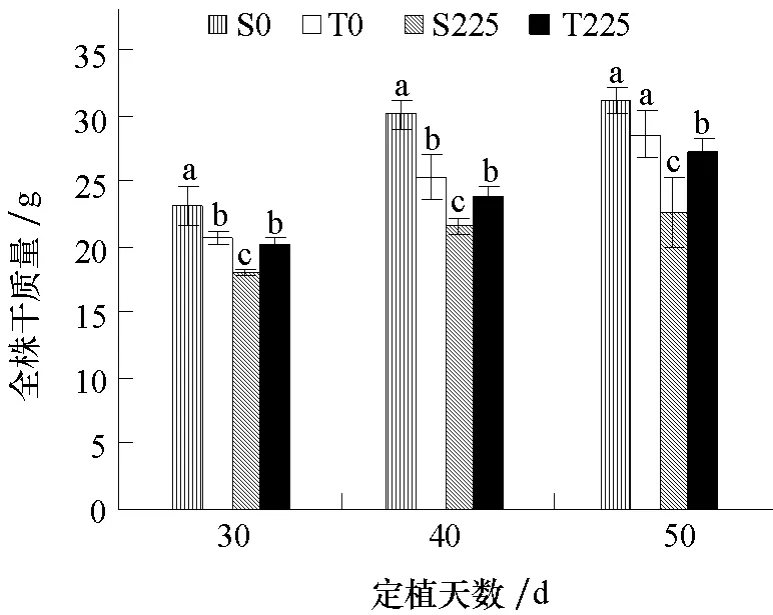
图3 盐胁迫对不同耐盐黄瓜品种全株干质量的影响
2.4 盐胁迫对不同耐盐黄瓜品种根区土壤脲酶活性的影响
图4 表明,随着黄瓜生长,根区土壤脲酶活性总体呈现升高的趋势。非盐处理条件下,定植后40 d 盐敏感品种(S0)土壤脲酶活性显著低于耐盐品种(T0);盐处理条件下,定植后30、50 d 盐敏感品种(S225)土壤脲酶活性均显著低于非盐处理(S0);盐处理条件下,耐盐品种(T225)土壤脲酶活性与非盐处理(T0)差异不显著;无苗对照盐处理(CK225)在定植后40 d 显著低于无苗对照非盐处理(CK0)。
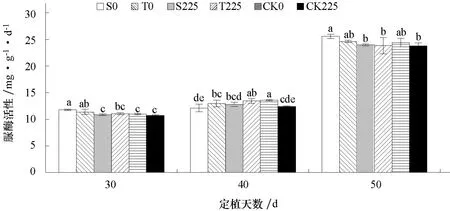
图4 盐胁迫对不同耐盐黄瓜品种根区土壤脲酶活性的影响
2.5 盐胁迫对不同耐盐黄瓜品种根区土壤过氧化氢酶活性的影响
图5 表明,随着黄瓜生长,根区土壤过氧化氢酶活性总体呈现降低的趋势。定植后30 d,非盐处理条件下两黄瓜品种(S0、T0)土壤过氧化氢酶活性明显高于盐处理(S225、T225)和无苗对照(CK0、CK225);盐敏感品种在盐处理条件下(S225)土壤过氧化氢酶活性比非盐处理条件下(S0)显著降低,但耐盐品种土壤过氧化氢酶活性降低不显著,表现出较强的适应性;定植后40、50 d 各处理均无显著差异。

图5 盐胁迫对不同耐盐黄瓜品种根区土壤过氧化氢酶活性的影响
2.6 盐胁迫对不同耐盐黄瓜品种根区土壤中性磷酸酶活性的影响
图6 表明,随着黄瓜生长,根区土壤中性磷酸酶活性基本保持不变。非盐处理条件下,耐盐黄瓜品种(T0)土壤中性磷酸酶活性高于盐敏感品种(S0),在定植后30 d 达到显著差异;定植后50 d,盐处理条件下两黄瓜品种(S225、T225)土壤中性磷酸酶活性与非盐处理相比显著降低;定植后30 d,盐处理条件下耐盐品种(T225)土壤中性磷酸酶活性显著高于盐处理条件下的无苗对照(CK225)。
2.7 盐胁迫对不同耐盐黄瓜品种根区土壤脱氢酶活性的影响
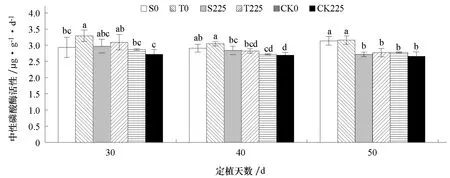
图6 盐胁迫对不同耐盐黄瓜品种根区土壤中性磷酸酶活性的影响
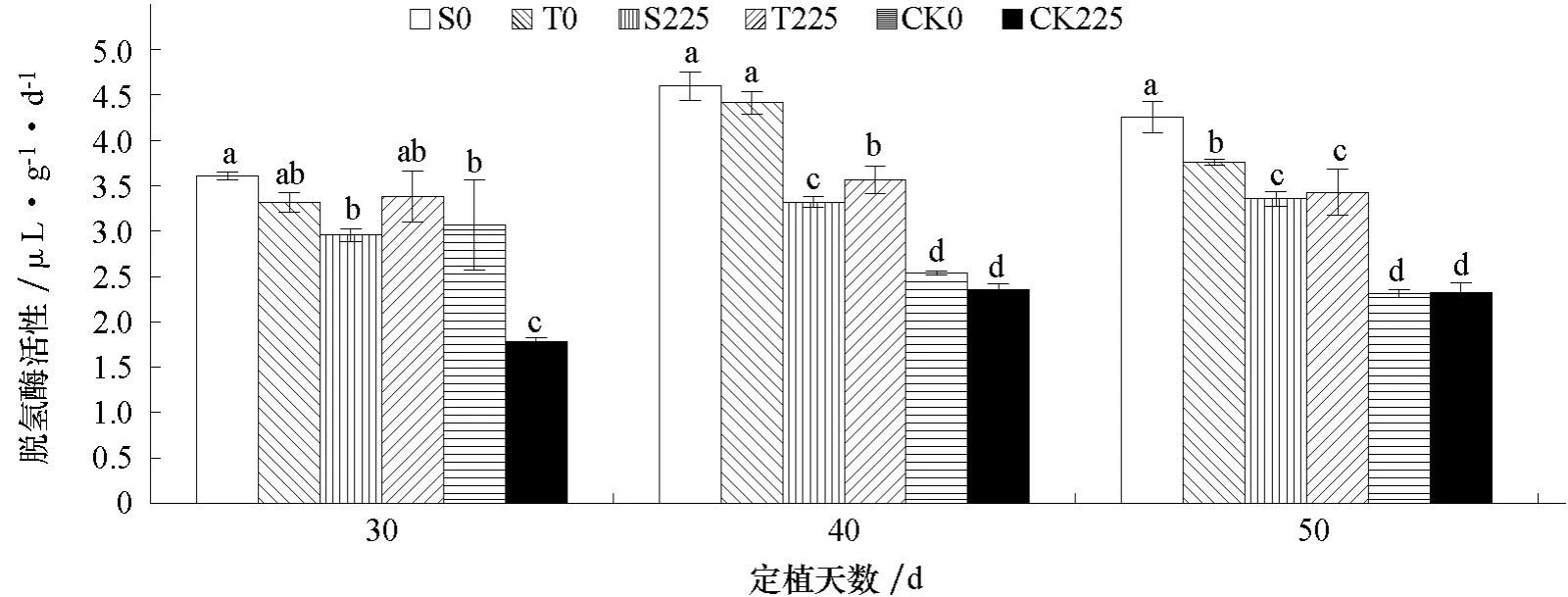
图7 盐胁迫对不同耐盐黄瓜品种根区土壤脱氢酶活性的影响
图7 表明,随着黄瓜生长,根区土壤脱氢酶活性略有增加。非盐处理条件下,盐敏感品种(S0)土壤脱氢酶活性高于耐盐品种(T0),在定植后50 d 达到显著差异;盐处理条件下,耐盐品种(T225)土壤脱氢酶活性高于盐敏感品种(S225),在定植后40 d 达到显著差异;无苗对照中盐处理(CK225)土壤脱氢酶活性在定植后30 d 显著降低;定植后40、50 d,非盐处理两黄瓜品种(S0、T0)土壤脱氢酶活性显著高于盐处理(S225、T225),盐处理两黄瓜品种(S225、T225)土壤脱氢酶活性显著高于无苗对照(CK0、CK225)。
3 结论与讨论
设施栽培土壤常处在半封闭状态下,具有气温高、湿度大、肥料投入量多等特点,再加上相对单一的栽培制度,使得设施内土壤盐渍化普遍存在(童有为和陈淡飞,1991;余海英 等,2006)。一般认为在无机盐中对植物危害最大的是钠盐,农作物通常对NaCl 非常敏感(戚乐磊等,2002)。本试验在非盐处理条件下,盐敏感品种津优1 号单株产量、叶面积和全株干质量总体趋势高于耐盐品种津春5 号;在盐处理条件下,盐敏感品种津优1 号单株产量和全株干质量下降显著,叶面积在定植后50 d 下降显著,但耐盐品种津春5 号降低幅度没有盐敏感品种津优1 号大。以上结论与前人研究结果相一致(崔世茂 等,2005;孙志宾 等,2006;王素平 等;2006)。
土壤酶在营养物质转化、能量代谢、污染物质净化和温室气体排放等过程中都发挥着十分重要的作用,因此被认为是土壤生态过程的中心(关荫松,1987;周礼恺,1988;Daniel,2005;Menon et al.,2005)。据报道土壤酶活性受土壤盐分和外源物质影响显著(Ekenler & Tabatabai,2003;Rietz & Haynes,2003;Gianfreda & Ruggiero,2006)。本试验选择了4 种与土壤质量评价密切相关的酶进行研究。脲酶是土壤中最活跃的水解酶之一,能催化施入土壤中尿素水解从而使尿素转化为铵供作物利用,在土壤氮素循环中起着重要作用(关荫松,1987)。过氧化氢酶是由植物根系或者土壤生物、微生物分泌的(胡晓捷 等,2004),表征土壤生物氧化过程的强弱,在生物氧化过程中起分解过氧化氢的作用,是机体防御机制上重要的酶,具有保护酶的作用 (关荫松,1987;周礼恺,1988)。磷是作物生长必需的三大营养元素之一,但土壤中的磷绝大部分是以有机态存在的,作物无法吸收,通过磷酸酶的酶促反应可将有机磷化合物转化为无机磷,被作物吸收利用(周礼恺,1988)。脱氢酶为胞内酶,主要来源于微生物和作物的生命活动,能酶促有机物质脱氢分解矿化(Sinclair et al.,1997),土壤脱氢酶的主要作用是酶促碳水化合物、有机酸等脱氢,其含量高低标志着土壤微生物分解代谢的强弱,反映了微生物总活性(关荫松,1987;周礼恺,1988)。
本试验在盐处理条件下,盐敏感品种根区土壤脲酶活性在定植后30 d 和50 d 表现为显著降低,但定植后40 d 出现正好相反的结果;盐敏感品种根区土壤过氧化氢酶活性在定植后30 d 显著降低,而耐盐品种根区土壤过氧化氢酶活性则无显著变化;非盐处理条件下盐敏感品种根区土壤中性磷酸酶活性在定植后30 d 显著低于耐盐品种,但在盐处理条件下两品种间无显著差异;在盐处理条件下,盐敏感品种根区土壤脱氢酶活性均显著降低,在定植后40 d 耐盐品种表现出品种优势,根区土壤脱氢酶活性显著高于盐敏感品种。土壤脱氢酶活性变化与前人的研究结果相一致(戴伟和王兵,1994;邱莉萍 等,2007)。总体看来,相同盐处理条件下耐盐品种定植后30 d 和40 d 的土壤脲酶活性、过氧化氢酶活性和脱氢酶活性较盐敏感品种受抑制程度轻,受盐害程度低,耐盐品种可能通过改善土壤环境来加强其自身的耐盐性,并且植物的生长对土壤酶活性有明显的促进作用。而中性磷酸酶活性在非盐处理条件下,耐盐品种表现出品种优势显著高于盐敏感品种,但盐处理条件下,两品种间无显著差异。
植物可以直接通过根的分泌产生土壤酶,植物群落的物种多样性和物种组成亦可影响土壤中微生物的数量及种类(Li et al.,2007),从而间接地影响土壤酶活性,这些也是不同黄瓜品种间土壤酶活性差异的原因。而盐胁迫对土壤微生物数量和活性均产生了不同程度的抑制作用(毛志刚 等,2010),表现形式为土壤微生物随着生长环境盐度的增加,数量和活性普遍呈降低的趋势(Ibekwe et al.,2010),并抑制了土壤酶活性(时唯伟 等,2009),导致植物生长减慢;另一方面盐胁迫抑制了植物根系的发育,根系分泌物减少,微生物繁殖减慢,群落结构发生变化,从而降低土壤酶活性(焦利卫 等,2009)。耐盐黄瓜品种可能通过自身代谢提高土壤酶活性。
鲍士旦.2005.土壤农化分析.3 版.北京:中国农业出版社.
崔世茂,陈源闽,新居直祐,赵彦.2005.NaCl 胁迫对胡萝卜种子萌发、幼苗生长及叶细胞结构的影响.华北农学报,31(3):21-24.
戴伟,王兵.1994.大岗山红黄壤中过氧化氢酶与土壤性质关系的研究.林业科技通讯,(4):17-18.
关荫松.1987.土壤酶及其研究法.北京:农业出版社.
韩志平,郭世荣,尤秀娜,孙锦,段九菊.2010.盐胁迫对西瓜幼苗活性氧代谢和渗透调节物质含量的影响.西北植物学报,30(11):2210-2218.
郝再彬,苍晶,徐仲.2004.植物生理实验.哈尔滨:哈尔滨工业大学出版社.
胡晓捷,杨炜春,刘维屏.2004.莠去津对土壤过氧化氢酶活性的影响研究.环境污染与防治,26(2):87-88.
焦利卫,齐树亭,吕玉珊.2009.盐化潮土不同农田土壤养分和土壤酶活性研究.安徽农业科学,37(35):17620-17622.
马德源,李发良,朱剑锋,战伟龑,杨洪兵,2009.盐胁迫下荞麦体内Na+分配与品种耐盐性的关系.安徽农业科学,37(13):5908-5909.
毛志刚,谷孝鸿,刘金娥,任丽娟,王国祥.2010.盐城海滨湿地盐沼植被及农作物下土壤酶活性特征.生态学报,30(18):5043-5049.
戚乐磊,陈阳,贾恢先.2002.盐胁迫下有机及无机硅对水稻种子萌发的影响.甘肃农业大学学报,37(3):272-278.
邱莉萍,张兴昌,程积民.2007.坡向坡位和撂荒地对云雾山草地土壤酶活性的影响.草业学报,16(1):93-97.
时唯伟,支月娥,王景,周培.2009.土壤次生盐渍化与微生物数量及土壤理化性质研究.水土保持学报,23(6):166-170.
孙小芳,刘友良.2000.NaCl 胁迫下棉花体内Na+、K+分布与耐盐性.西北植物学报,20(6):1027-1033.
孙志宾,齐兴云,张洪涛,王增兰,赵彦修.2006.NaCl 对拟南芥生长与渗透调节的影响.山东科学,19(3):10-17.
童有为,陈淡飞.1991.温室土壤次生盐渍化的形成和治理途径研究.园艺学报,18(2):159-162.
涂书新,孙锦荷,郭智芬,谷峰.2000.植物根系分泌物与根际营养关系评述.土壤与环境,9(1):64-67.
王素平,李娟,郭世荣.2006.NaCl 胁迫对黄瓜幼苗植株生长和光合特性的影响.西北植物学报,26(3):455-461.
魏国强,朱祝军,方学智,李娟,程俊.2004.NaCl 胁迫对不同品种黄瓜幼苗生长、叶绿素荧光特性和活性氧代谢的影响.中国农业科学,37(11):1754-1759.
许兴,郑国琦,邓西平,徐兆桢,惠红霞.2002.水分和盐分胁迫下春小麦幼苗渗透调节物质积累的比较研究.干旱地区农业研究,20(1):52-56.
严昶升.1988.土壤肥力研究方法.北京:农业出版社.
杨丽娟,须晖,邱忠祥,刘永青.2000.菜田土壤酶活性与黄瓜产量的关系.植物营养与肥料学报,6(1):113-116.
殷永娴,刘鸿雁.1996.设施栽培下土壤中硝化、反硝化作用的研究.生态学报,16(3):246-250.
余海英,李廷轩,周健民.2005.设施土壤次生盐渍化及其对土壤性质的影响.土壤,37(6):581-586.
余海英,李廷轩,周健民.2006.典型设施栽培土壤盐分变化规律及潜在的环境效应研究.土壤学报,43(4):571-576.
郁继华,杨秀铃,许耀辉,张国斌.2004.NaCl 胁迫对黄瓜自根苗和嫁接苗光合速率的影响.植物营养与肥料学报,10(5):554-556.
袁虹霞,李洪连,王烨,房卫平,王振跃.2002.棉花不同抗性品种根系分泌物分析及其对黄萎病菌的影响.植物病理学报,32(2):127-131.
袁琳,克热木·伊力,张利权.2005.NaCl 胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响.植物生态学报,29(6):985-991.
张景云,吴凤芝.2009.盐胁迫对黄瓜不同耐盐品种叶绿素含量和叶绿体超微结构的影响.中国蔬菜,(10):13-16.
张俊英,王敬国,许永利.2007.不同大豆品种根系分泌物中有机酸和酚酸的比较研究.安徽农业科学,35(23):7127-7129,7131.
张立芙,吴凤芝,周新刚,杨平.2009.盐胁迫下黄瓜根系分泌物对土壤养分及土壤酶活性的影响.中国蔬菜,(14):6-11.
章家恩,刘文高,胡刚.2002.不同土地利用方式下土壤微生物数量与土壤肥力的关系.土壤与环境,11(11):140-143.
周德平,吴淑杭,褚长彬,刘芳芳,姜震方,范洁群.2011.盐胁迫对蔬菜地土壤微生物及土壤酶活的毒害效应.农业环境科学学报,(8):1602-1607.
周礼恺.1988.土壤酶学.北京:科技出版社.
Aziz A,Martin-Tanguy J,Larher F.1999.Salt stress-induced proline accumulation and changes in tyramine and polyamine levels are linked to ionic adjustment in tomato leaf discs.Plant Science,145:83-91.
Daniel H.2005.Encyclopedia of soils in the environment.Oxford:Academic Press:445-448.
Ekenler M,Tabatabai M.2003.Responses of phosphatases and arylsulfatase in soils to liming and tillage systems.Plant Nutr Soil Sci,166:281-290.
Ferando G,Carmen T.2005.Different approaches to evaluating soil quality using biochemical properties.Soil Biology and Biochemistry,37:877-887.
Flowers T J.2004.Improving crop salt tolerance.Journal of Experimental Botany,55:307-319.
Gao Z F,Sagi M,Lips S H.1998.Carbohydrate metabolism in leaves and assimilate partitioning in fruits of tomato(Lycopersicon esculentumL.)as affected by salinity.Plant Science,35:149-159.
Gianfreda L,Ruggiero P.2006.Enzyme activities in soil.Berlin:Springer:257-311.
Ibekwe A M,Poss J A,Grattan S R.2010.Bacterial diversity in cucumber(Cucumis sativus)rhizosphere in response to salinity,soil pH,and boron.Soil Biology & Biochemistry,42:567-575.
Kandeler E,Luxh J M.1999.Xylanase,invertase and protease at the soil-litter interface of a loamy sand.Soil Biol & Biochem,31:1171-1179.
Kong C H,Wang P,Zhao H,Xu X H,Zhu Y D.2008.Impact of allelochemical exuded from allelopathic rice on soil microbial community.Soil Biology & Biochemistry,40:1862-1869.
Li Y Y,Zhou Y C,Zou J,Liu L.2007.Study on rhizosphere soil enzyme activities of different vegetation types in the limestone area of Guizhou Province.Journal of Anhui Agricultural Sciences,35:9607-9609.
Menon P,Gopal M,Parsad R.2005.Effects of chlor-pyrifos and quinalphos on dehydrogenase activities and reduction of Fe3+in the soils of two semi-arid fields of tropical India.Agriculture,Ecosystems and Environment,108:73-83.
Pagliai M,Nobili M D.1993.Relationships between soil porosity,rootdevelopment and soil enzyme activity in cultivated soils.Geoderma,(3):1-47.
Rietz D,Haynes R.2003.Effects of irrigation-induced salinity and sodicity on soil microbial activity.Soil Biol Biochem,35:845-854.
Santa-Cruz A,Acosta M,Perez-Alfocea F.1999.Changes in free polyamine levels induced by salt stress in leaves of cultivated and wild tomato species.Physiol Plant,101:341-346.
Sinclair D C R,Smith G M,Bruce A.1997.Soil dehydrogenase activity adjacent to remedially treated timber,weathered in a physical field model International.Biodeterioration & Biodegradation,39:207-216.

