18F-FDG PET/CT结合HRCT在肺炎型细支气管肺泡癌诊断中的应用
彭辽河,丁久荣,胡晓燕,邱大胜,李 杰,周 静,朱 佳
(湖北省肿瘤医院PET/CT中心,湖北 武汉 430079)
细支气管肺泡癌(Bronchioloalveolar carcinoma,BAC)是肺腺癌的一种特殊类型,影像学表现呈多样性,其中肺炎型细支气管肺泡癌(Pneumonia type of bronchioloalveolar carcinoma,PTBAC)作为影像学表现中的一种分型,临床并不少见[1]。由于其影像学表现酷似肺炎,临床及实验室检查无特异表现,给临床诊断带来一定的困难。PET/CT作为最先进的肿瘤诊断工具能够同时提供病灶的分子水平的生化代谢信息与解剖形态学信息,实现了PET与CT的优势互补,将其纳入常规肺癌诊断流程中也越来越多[2],但是其在PTBAC定性诊断中的应用报道较少。笔者搜集经病理证实的26例PTBAC患者资料进行18F-氟代脱氧葡萄糖 (18F-fluorodeoxyglucose,18F-FDG)PET/CT影像特点分析,同时对其中 15例结合HRCT影像特征进行分析,探讨其内在的联系,旨在提高诊断准确率。
1 资料与方法
1.1 一般资料
搜集经病理证实PTBAC患者26例的临床资料,其中男11例,女15例,年龄27~73岁,平均57.3岁,病程为2周~3年余。临床表现:全组患者均有不同程度的胸闷、胸痛、咳嗽等症状,其中18例有进行性呼吸困难,活动后胸闷、憋气;12例咳白色泡沫样痰,或伴有刺激样阵发性干咳;9例痰中伴有血丝;4例无典型临床体征。实验室检查:2例痰中查到可疑癌细胞,3例癌胚抗原(CEA)阳性,22例未见异常。确诊方法:7例经手术标本病理确诊,16例经CT引导下穿刺活检病理确诊,4例经支气管镜活检病理确诊均证实含细支气管肺泡癌成分。全部患者均先行常规18F-FDG PET/CT显像检查,其中15例根据诊断需要0~3 d内行高分辨率CT(HRCT)及部分CT增强扫描。
1.2 PET/CT显像
采用美国GE公司Discovery STE-16 PET/CT机,显像剂18F-FDG由武汉协和医院医用回旋加速器中心提供,放化纯度>95%。患者空腹6 h以上,给药前常规检查血糖并控制在7.2 mmol/L以下,平静状态下静脉注射18F-FDG 5.55 MBq/kg,注射后安静休息60 min常规显像或120 min延迟显像,显像包括CT平扫及PET发射扫描,CT透射扫描参数120kV,50~80 mA,图像标准法重建,重建层厚为3.75 mm。PET发射扫描采用3D采集,根据患者的身高扫描6~8个床位,2 min/床位,图像重建采用有序子集最大期望值迭代(OSEM)法,图像衰减校正采用同机CT扫描数据。将最终得到CT图像、经过衰减校正的PET图像 (AC)、未经过衰减校正的PET图像(NC)和PET/CT融合图像传送到Xeleris或AW 4.4工作站,进行帧对帧图像对位融合显示。
1.3 HRCT扫描
采用PET/CT中16层螺旋CT,针对可疑病灶进行吸气后屏气扫描及薄层骨算法重建,扫描参数120 kV,电流500 mAs,准直器宽度0.625 mm,重建层厚1.25 mm;增强扫描,经肘静脉注入非离子型对比剂,注射剂量为80~100 mL,注射流率2.5~3 mL/s,扫描延迟时间35 s。图像传送到Xeleris及AW 4.4后处理工作站,对图像进行分析。
1.4 图像分析方法
PET/CT图像及HRCT图像由两名高年资影像诊断医师独立阅片,观点一致为准,观点不一致时共同协商处理。PET/CT图像判断采用目测法和半定量法,分析PET图像上病灶放射性分布特点及测量病灶标准摄取值 (Standardized uptake value,SUV)的大小,由于SUV由计算机感兴趣区(Region of interest,ROI)技术得到,受阅片者主观因素影响较大,因此取最大SUV相对比较客观并进行评价,根据常规认为肺部良恶性肿瘤的临界最大SUV=2.5进行分析,最大SUV>2.5认为是恶性[3],结合同机CT形态学表现及患者临床病史与相关检查资料综合作出诊断。HRCT图像重点分析病灶的内部及邻近结构改变等征象,结合患者临床病史与相关检查资料综合作出诊断。最后加以总结,探讨二者影像学特点及协同诊断的临床意义。
2 结果
2.1 病变分布特点
全组均位于肺外围近胸膜下呈肺叶或肺段实变阴影,累及一个肺叶或肺段的大部分,或相邻的肺叶、肺段。其中左肺上叶5例、左肺下叶6例、右肺上叶3例、右肺中叶5例、右肺下叶7例。其中,肺叶或肺段实变9例,肺叶或肺段实变与多发结节共存12例,肺实变并肺门、纵隔淋巴结肿大2例,累及相邻肺叶3例(右肺中、下叶2例,左肺上叶、下叶背段1例)。
2.2 病变影像学特点
PTBAC的18F-FDG PET/CT显像特点:26例患者中均出现高于肺本底的放射性浓聚影,其中肺实变病灶中均存在团片状、斑片状浓淡不一放射性浓聚影(图1~3),半定量分析,肺实变部分最大SUV均>2.5,延迟显像后均有不同程度进一步升高,最高者最大SUV 13.8;肺实变病灶伴肺结节病灶可表现放射性浓聚影,最大SUV均>2.5,而部分结节无高摄取,最大SUV<2.5;肺实变中高摄取伴肺门、纵隔淋巴结浓聚影,其中淋巴结浓聚影SUV亦明显升高,最大SUV 5.6;实变病灶周围不规则斑片或节段性分布的磨玻璃病变中无高摄取。
PTBAC的HRCT影像特点:15例患者均表现无典型分布特征的肺叶或肺段实变,或双肺多发斑片状实变影,密度较同层肌肉密度低,部分增强后,病变密度仍低于肌肉密度。其中,支气管充气征或蜂房征(13例);边缘磨玻璃征(5例);实变内血管造影征(2例);混合阴影(6例),即支气管充气征或蜂房征、血管造影征并存(图4~6)。
2.3 18F-FDG PET/CT显像确诊率及其结合HRCT影像确诊率
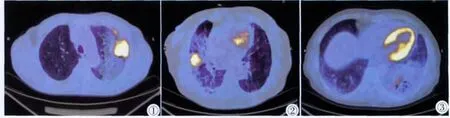
图1 ~3 18F-FDG PET/CT检查显示实变病灶中均存在团片状、斑片状浓淡不一放射性浓聚影,其周围不规则斑片或节段性分布的磨玻璃病变中无高摄取。Figure 1~3. 18F-FDG PET/CT images showed the different figures of radioactive concentration with various uptake of FDG by the lesions.No high metabolism was observed surrounding ground glass shadow.
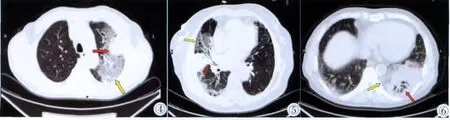
图4 ~6 胸部HRCT显示实变病灶内支气管充气征或蜂房征(红箭),及边缘磨玻璃征(黄箭)。Figure 4~6. Chest HRCT images showed the aerial bronchogram sign,“honeycomb”sign and ground-glass sign of lesions.
26例患者中,结合临床,PET/CT显像确切诊断肺癌9例,恶性不除外13例,肺感染性病变4例,确诊率为34.6%(9/26),误诊率较高;其中,15例(13例拟诊恶性不除外及2例考虑肺感染性病变)患者PET/CT显像后结合HRCT影像,13例拟诊恶性不除外患者确切诊断为肺癌,1例PET/CT初次考虑感染性病变者经HRCT图像结合增强扫描诊断为肺癌,1例PET/CT初次考虑感染性病变者结合HRCT均疑为肺炎,后经PET/CT延迟显像后SUV进一步升高综合评判考虑肺癌,手术病理证实;PET/CT与HRCT相结合诊断正确率达100%。
3 讨论
BAC于1876年由Mallassez首次描述,1960年Liebow正式命名,其病理分类归属于肺腺癌的一个亚型,其中PTBAC是BAC影像学表现中的一种类型。PTBAC的发病年龄多在40~70岁之间,好发女性和无吸烟史的人群,临床表现多缺乏特异性,其病理生理过程与其他类型BAC大致相仿,肿瘤原发于肺细支气管黏膜上皮和肺泡上皮,沿原有肺泡或细支气管壁生长排列,不破坏肺网状结构,肺组织基本框架依然保留,受累的末梢支气管及肺泡伴有分泌大量黏液和纤维增生,可通过局部气道和气道淋巴途径播散至肺的其他区域,由局部癌变进展成弥漫性病变,产生肺部炎症样改变,因而影像学表现复杂多样且多变、误诊率高[4]。
目前PET/CT在肺癌诊断、分期、疗效判断、预后评价及对治疗计划的制定能起到指导性作用[2]。18F-FDG PET/CT显像是根据组织内葡萄糖的代谢差异来识别恶性病变,通过观察病变的放射性浓聚影情况及根据SUV来描述和比较组织的18F-FDG摄取程度,且通常以SUV>2.5作为诊断肺部恶性病变的截点[3]。但是18F-FDG作为一种非特异性的肿瘤显像剂其PET显像存在一定的假阳性和假阴性,任何有葡萄糖代谢增高的病变均可引起18F-FDG PET显像的假阳性,常见的有结核、炎症、感染、肉芽肿等疾病,而有些葡萄糖代谢不增高的肿瘤病变则可引起18F-FDG PET显像的假阴性,如部分BAC等。本研究中,PTBAC在18F-FDG PET/CT显像上出现多样性放射性分布,如实变病灶区的团片状、斑片状浓淡不一放射性浓聚影及表现SUV值较高且通过延迟显像后表现SUV进一步升高,部分结节与磨玻璃病变中无放射性高摄取而表现SUV值较低或者阴性,分析原因可能受PTBAC的分化程度、生长方式等因素的影响,其葡萄糖代谢表现出很大差异,因此放射性摄取特点及SUV值高低也有很大变化,给临床诊断增加了难度,与文献报道基本一致[5]。而PET/ CT中的同机CT扫描图像虽然可以满足精确定位的需要,但是在平静呼吸状态下和低X线剂量下获得的重建层厚较厚的CT图像,分辨率较低而无法清晰显示病灶内部及周围结构的形态学细节,并不能完全满足诊断的要求,诊断PTBAC具有一定的局限性。
胸部HRCT具有良好的空间分辨率,能够更清晰地显示PTBAC的内部细微结构及周围形态学征象及其基本的、相对特征性的影像学表现[7-8]:支气管充气征或蜂房征,即支气管管壁不规则增厚,凸凹不平,僵硬扭曲,管腔普遍狭窄,可累及多级支气管,呈现为“枯枝”状,以及病变内可见蜂窝状低密度区,表现为病灶近外带大小不等的透亮区,蜂窝状分布,其内密度不均匀,这种征象虽然也可见于大叶性或干酪性肺炎等病变中,但对PTBAC的诊断仍有重要意义;边缘磨玻璃征,即肺实变边缘或周围见弥漫性半透明密度影,其内可有网格样改变,这是与感染性病变鉴别的一个重要点;血管造影征,即实变肿瘤中见“树枝”状血管影,增强后更加明显,被认为是特征性征象,特异性达90%以上;混合阴影,即血管造影征、充气征、周围毛玻璃影、周围多发结节等同时存在或部分同时存在,有一定的特异性。因此,支气管充气征或蜂房征、边缘磨玻璃征、实变内血管造影征等均有一定的特征性,且多种征象同时并存有更高的诊断价值。本组15例PTBAC患者基本符合这个特征。
PET/CT中的多层螺旋CT的装配不仅起到衰减校正的作用,同时又使HRCT扫描成为可能,为实现它们的优势互补提供了设备条件,也更加体现出PET/CT检查的临床价值[9]。尤其对于PTBAC与肺部炎性病变的诊断与鉴别诊断更为重要,使PET/ CT显像特点与HRCT形态特征表现二者进一步互相印证,取长补短,优势互补,这样能够大大提高诊断准确性。如PET/CT显像上病变浓聚不典型时,但并不能完全排除PTBAC时,应充分利用HRCT图像上清晰显示的病灶内部及周围结构的丰富形态学信息来进一步佐证,以更加肯定PET/CT的诊断;相反,HRCT图像上病变没有足够的特征性形态学表现时,PET/CT常规显像及延迟显像更能够提供病变病理生化代谢信息,有利于病变的有效诊断和定性以及远处转移情况。本组中,13例PET/CT拟诊恶性病变患者经结合HRCT最终确切诊断为肺癌,1例PET/CT初次考虑感染性病变患者经结合HRCT后诊断为肺癌;而1例PET/CT结合HRCT均疑为肺炎患者,后经PET/CT延迟显像SUV进一步升高综合评判考虑肺癌,手术病理证实。
总之,PTBAC独特的生物学行为和临床及病理学表现,决定了其影像表现的复杂多样性。18F-FDG PET/CT显像虽然能够同时提供病灶的分子水平的生化代谢信息和解剖形态学信息,但是其在PTBAC与部分肺部炎性病变的诊断与鉴别诊断中的不足,亦是显而易见,实际工作中充分利用诊断CT,尤其是HRCT能够提高PTBAC的组织分辨率,使图像显示更清晰,更有利于从征象及性质上作出准确判断来弥补常规18F-FDG PET/CT显像中的不足,达到真正的优势互补,进而更能充分发挥和彰显PET/CT检查的资源优势,减少误诊率及提高诊断准确率。
[1]战忠利,孙蕾娜.WHO 2004年版肺癌组织学分类与临床意义[J].中国肿瘤影像学,2009,2(2):145-147.
[2]Fischer BM,Mortensen J.The future in diagnosis and staging of lung cancer:positron emission tomography[J].Respiration,2006, 73(3):267-276.
[3]Kuehl H,Veit P,Rosenbaum SJ,et al.Can PET/CT replace separate diagnostic CT for cancer imaging?Optimizing CT protocols for imaging cancers of the chest and abdomen[J].J Nucl Med,2007,48(1):45-57.
[4]Cadranel J,Lavolé A,Gounant V,et al.Other thoracic cancers. Bronchioloalveolar carcinoma and adenocarcinoma with bronchioloalveolar carcinoma feature:a clinico-pathological spectrum[J]. Rev Mal Respir,2008,25(8 pt 2):3S196-202.
[5]Uesaka D,Demura Y,Ishizaki T,et al.Evaluation of dual-timepoint18F-FDG PET for staging in patients with lung cancer[J].J Nucl Med,2008,49(10):1606-1612.
[6]杨忠毅,章英剑.核医学影像在细支气管肺泡癌中的应用[J].中国肺癌杂志,2009,12(10):1123-1126.
[7]赵倩,蔡祖龙,赵绍宏.细支气管肺泡癌的CT征象分析[J].中国临床医学影像杂志,2009,20(3):164-166.
[8]李家开,蔡祖龙,杨立,等.炎症型支气管肺泡癌的CT影像动态演变规律析[J].中国医学影像技术,2007,23(11):1622-1624.
[9]Beyer T,Townsend DW,Brun T,et al.A combined PET/CT scanner for clinical oncology[J].J Nucl Med,2000,41(8):1369-1379.

