犬颌骨与髂骨两种骨髓间充质干细胞增殖和骨向分化能力比较
王国轩,朱国雄,朱 斌,梁世桢,赵喜聪,安玉林,金 岩
(1.辽宁医学院济南军区总医院研究生培养基地,山东济南250031; 2.济南军区总医院口腔科,山东济南250031;3.第四军医大学口腔医学院,陕西西安710032)
颌骨来源于神经外胚层的神经嵴细胞[1],经历的是膜内成骨过程,而髂骨来源于中胚层,经历的是软骨内成骨过程[2],并且有资料证明这两种骨骼在体内有着不同的平衡调控机制[3]。近几年研究表明:颌骨来源的骨髓间充质干细胞同样具有间充质系的特性[4-5],包括间充质干细胞表面分子标志物的表达、成骨成脂等多向分化潜能、单克隆生长能力等。自体骨骼移植修复颌面部骨缺损时,供体位点通常包括颌面部骨骼、躯干骨骨骼和四肢骨骨骼,研究表明用来自颌面部的移植瓣移植比用来自躯干骨和四肢骨的移植瓣具有更高的成功率,提示来自于骨骼不同解剖位点的移植瓣对移植效果有一定影响[6-7]。本研究对来自同一个体的J-BMMSCs和I-BMMSCs的增殖和成骨能力进行比较,为骨移植和组织工程骨的种子细胞获取提供理论基础。
1 材料和方法
1.1 实验动物和主要仪器、试剂
健康成年犬4只(第四军医大学实验动物中心提供);二氧化碳恒温孵箱(Forma,美国);荧光倒置相差显微镜和照相系统(OLYMPUS,日本);酶标仪(Bio-Rad);流式细胞仪(ELITE ESO型,BecKmen-Coulter,美国);α-MEM培养基、胎牛血清(Hyclone,美国);2.5 g/L胰蛋白酶、谷氨酰胺(GIBCO,美国);β—甘油磷酸钠、地塞米松(dexamethasoned,Dex,Sigma)、维生素C(vitaminC,Vit,Sigma)、茜素红(上海化学试剂采购供应站);逆转录试剂盒(TaKaRa)、RT-PCR试剂盒(TaKaRa)。
1.2 两种BMMSCs的分离、培养和纯化
1.2.1 J-BMMSCs的分离和培养
实验犬经10 g/L戊巴比妥钠液(3.5 mL/kg)肌肉注射麻醉后,用种植机获取颌骨骨碎屑,PBS清洗两次后800 r/min离心5min,弃上清,再用含100 mL/L胎牛血清的α-MEM培养液重悬后接种于T25培养瓶,置CO2孵箱中37℃、50 mL/L CO2条件下培养。24 h后小心吸去培养液和未贴壁细胞并进行首次换液,以后每3 d换液1次,待细胞长满瓶底约90%时,用2.5 g/L胰酶消化细胞并按1∶3比例传代,记为p1。取对数生长期的第1代细胞,调整细胞密度至100~150/mL,充分混匀并接种于直径10 cm的一次性培养皿中,3 mL/皿,培养贴壁后标记单个细胞并补液至8 mL,常规培养7~10 d,出现细胞克隆(细胞克隆判断标准≥50个细胞)后,将克隆细胞用胰酶消化后常规传代培养。
1.2.2 I-BMMSCs的分离、培养
实验犬经10 g/L戊巴比妥钠液(3.5 mL/Kg)肌肉注射麻醉后,用穿刺针刺入髂骨骨髓腔,抽取骨髓6~8 mL,立即注入加有1 mL肝素的离心管,所取骨髓按1∶1比例用磷酸盐缓冲液(PBS)稀释并置10 mL离心管中混匀,再将骨髓稀释液按1∶1比例缓慢加入到1.073 g/mL Percoll分离液之上,2 000 r/min离心20 min;离心后离心管内液体共分为4层,小心吸取第2层白色膜状层,加5 mL磷酸盐缓冲液充分混匀后,800 r/min离心5 min,离心洗涤2次;弃上清液,再用含100 mL/L胎牛血清α-MEM培养液重悬后接种于T25培养瓶,置CO2孵箱中37℃、50 mL/L CO2条件下培养。24 h后小心吸去培养液和未贴壁细胞并进行首次换液,以后每3 d换液1次,待细胞长满约90%后,用2.5 g/L胰酶消化细胞并按1∶3比例传代,记为p1。以此类推,取第3代细胞用于以下实验。
1.3 流式细胞仪检测细胞表面标记分子
用2.5 g/L胰蛋白酶消化下的上述两种干细胞,以含30 mL/L胎牛血清的PBS缓冲液洗涤2次后重悬,调整细胞密度为1×106/mL,分装至EP管中,每管200 μL,分别加入CD44、CD29、CD34抗体后,4℃孵育1 h,PBS洗涤两遍后重悬,流式细胞仪检测。
1.4 克隆形成率
对有限稀释法克隆后的上述两种干细胞进行克隆形成率计算,比较两者的克隆形成率。
1.5 MTT法检测细胞增殖
取第3代两种BMMSCs,分别以2×103/孔细胞密度接种于96孔板,37℃50 mL/L CO2孵箱中培养,每天用MTT法在酶标仪上分别测两组细胞的吸光度值(OD值),取平均值,连续测8 d。以时间为横轴,OD值为纵轴绘制生长曲线。
1.6 成骨诱导培养
取第3代两种BMMSCs分别以2×105/mL的密度接种于6孔培养板中(1 mL/孔),培养至贴壁细胞达70%汇合后弃原液,加入成骨诱导液(含100 mL/L FBS的α-MEM培养液、10 mmol/L的β-甘油磷酸钠液、0.3 mmol/L的抗坏血酸(Vc)、1×10-5mmol/L的地塞米松液)进行诱导培养。7 d后ALP染色,21 d后茜素红染色,倒置显微镜下观察、照相,并用十六烷基吡啶进行定量分析[8]。
1.7 Real-time PCR检测两种干细胞Runx-2、BSP mRNA表达
分别收集成骨诱导 0、7、14 d后的两种BMMSCs,用细胞总RNA提取试剂盒提取细胞总RNA,β-actin为内参照。参照GenBank数据库,采用Primer primer 5.0计算机软件设计引物并由TaKara公司合成,基因序列(表1)。然后参照RT-PCR试剂盒说明书的操作步骤和反应条件检测Runx-2和BSP mRNA表达情况。
1.8 统计学分析
使用SPSS 11.0软件进行统计分析,两独立样本均数比较用t检验,检验水准α=0.05。
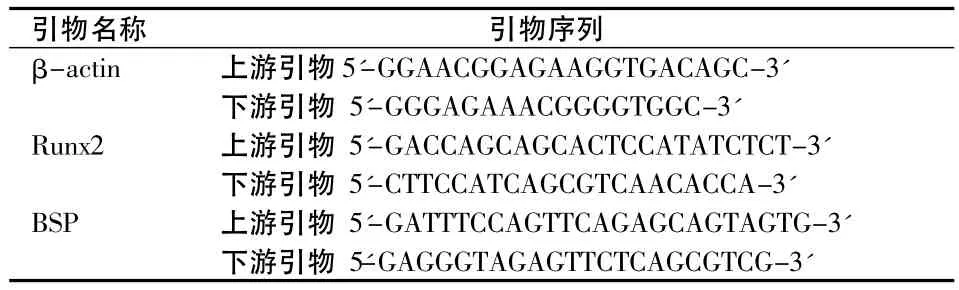
表1 引物基因序列
2 结果
2.1 BMMSCs的形态特征
传3代以后两组BMMSCs细胞形态均一,呈长梭形(图1)。
图1 第3代细胞(×100)
2.2 两种干细胞表面抗原比较
对两种干细胞进行流式细胞仪检测,结果显示两种细胞纯度均较高。J-BMMSCs组CD44和CD29的阳性率分别为98.4%、94.7%(图2a~b),而CD34的阳性率仅为1.2%(图2c);I-BMMSCs组CD44和CD29的阳性率分别为97.1%、95.1% (图2d、e),而CD34的阳性率仅为2.4%(图2f)。
2.3 两种BMMSCs克隆形成率比较
J-BMMSCs组克隆形成率为(24.5±2.3)%,明显高于I-BMMSCs组(18.6±1.3)%,差异有统计学意义(P<0.05)(图3)。
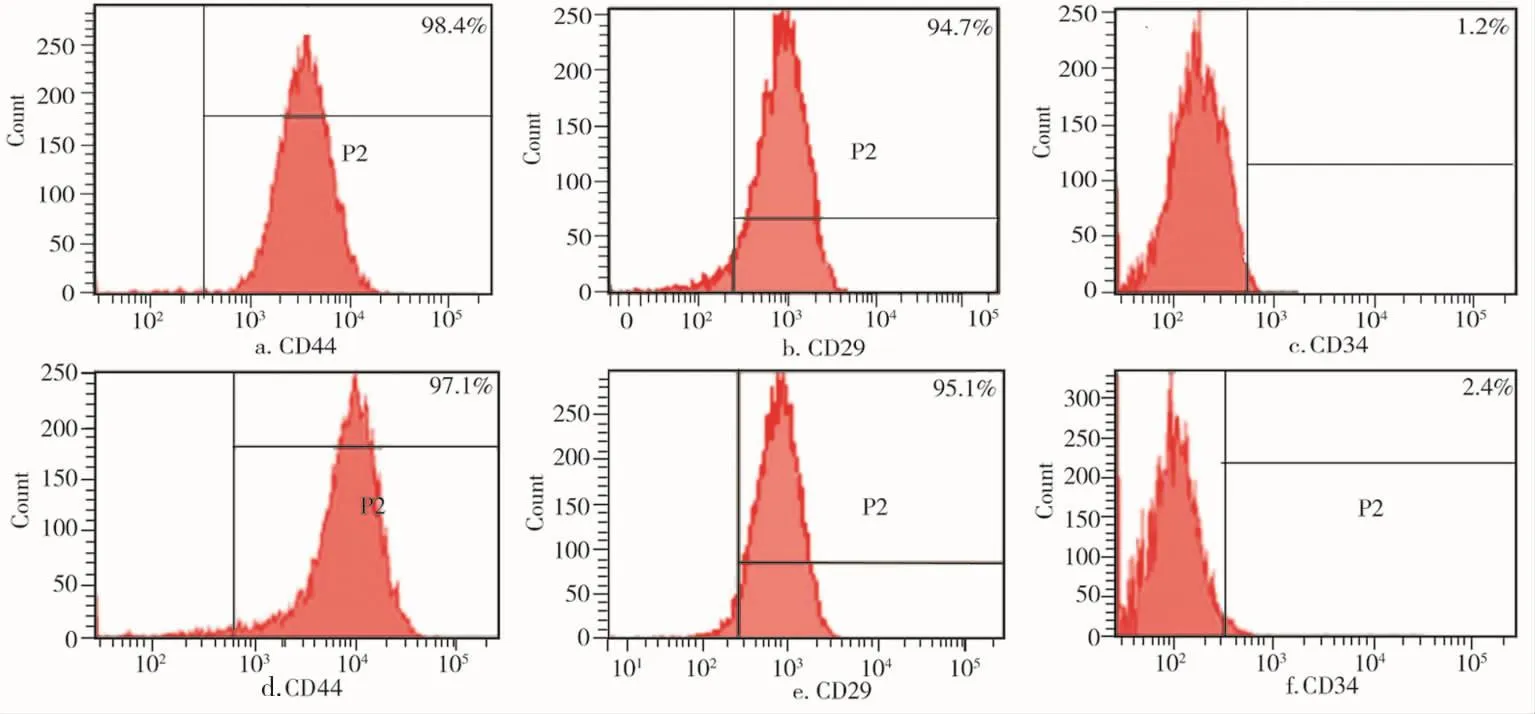
图2 流式细胞仪检测结果

图3 两组克隆形成率比较
2.4 两种BMMSCs生长曲线比较
对两种BMMSCs第3代细胞生长曲线进行测定,显示1~3 d两组增殖情况基本一致,4 d后J-BMMSCs组的增殖速度要强于I-BMMSCs组,4~8 d各时间点两两比较差异均有统计学意义(P<0.05)(图4)。
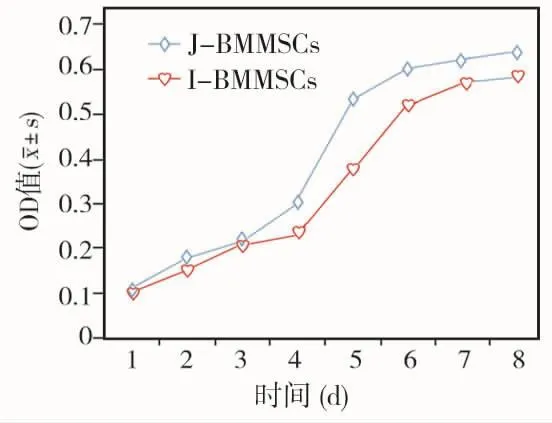
图4 两组生长曲线比较
2.5 成骨诱导结果
成骨诱导7 d后,ALP染色显示J-BMMSCs组染色比I-BMMSCs组深(图5)。成骨诱导21 d后茜素红染色显示两组均形成钙化结节,定量分析结果显示J-BMMSCs组钙化量高于I-BMMSCs组(P<0.05)(图6)。
2.6 RT-PCR结果
两组BMMSCs成骨诱导0、7、14 d后,对成骨基因Runx-2和BSP进行Real-time PCR检测,结果显示J-BMMSCs组各时间点的Runx-2、BSP mRNA表达均明显高于I-BMMSCs组,差异有统计学意义(P<0.05)(图7)。
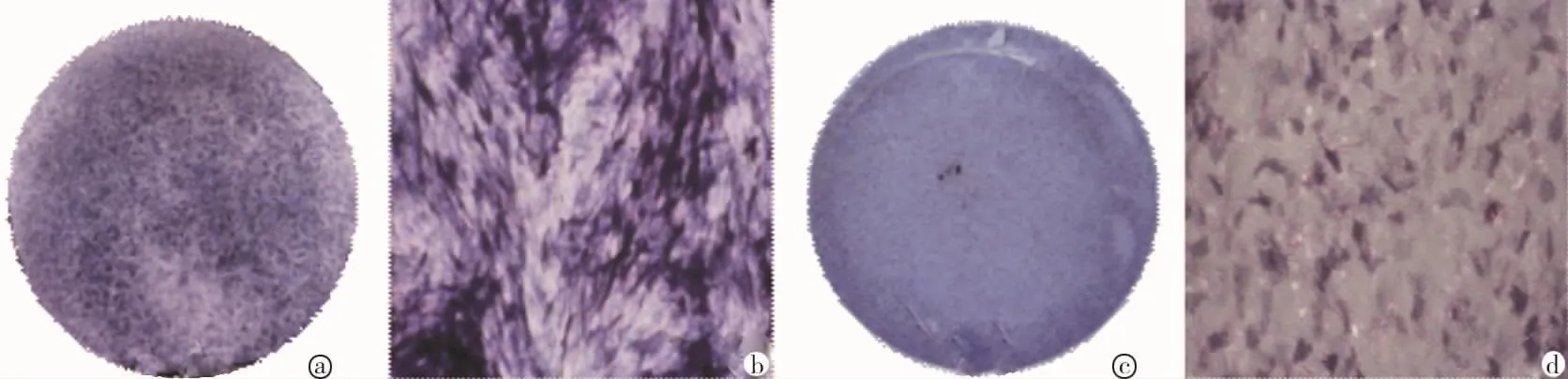
图5 两组细胞成骨诱导7d后ALP染色结果(×100)
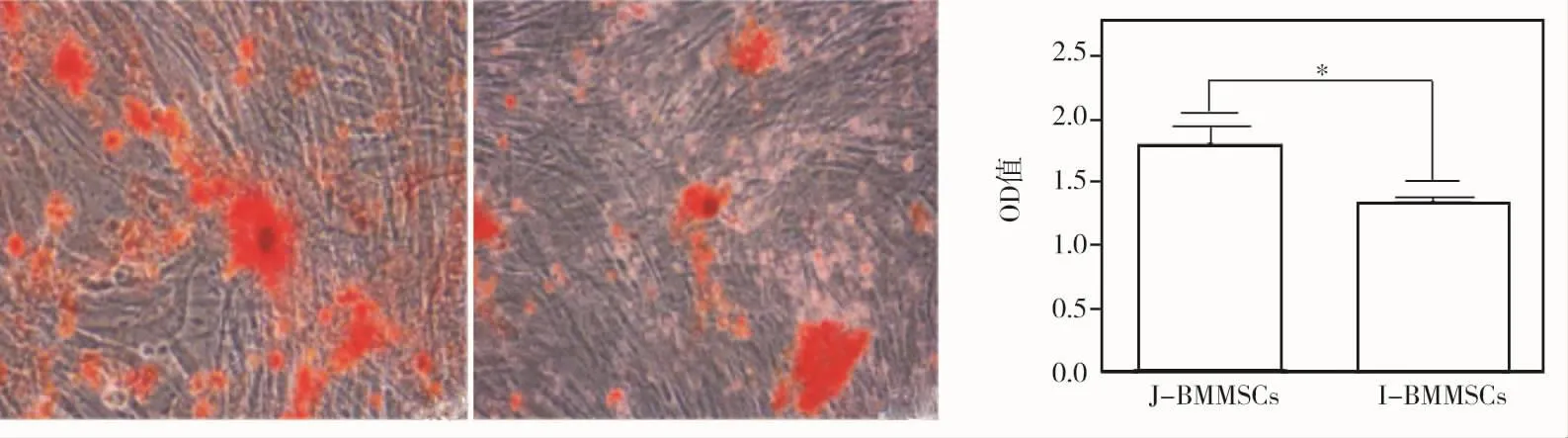
图6 两组细胞成骨诱导21 d后钙化结节形成情况(×100)及定量分析结果

图7 成骨诱导0、7、14 d后两组Runx-2、BSP mRNA表达水平(*P<0.05)
3 讨论
虽然颅面骨和髂骨有着相似的组织学特性[9],但颅面骨来源于神经外胚层的神经嵴细胞,在神经嵴细胞迁移过程中,所产生的生长因子和相关信号通路引导神经嵴细胞通过膜内成骨形成颅面结构[10],而躯干骨和四肢骨来源于中胚层的间叶细胞,经历的是软骨内成骨过程。全身性病,例如骨质疏松症、甲状旁腺功能亢进等影响着包括颌骨在内的所有骨骼;在切除卵巢的骨质疏松鼠模型上,颌骨的新陈代谢也受到了和髂骨相似的影响[11-12]。但是不管是在卵巢切除术后还是营养失调的情况下,颌骨比髂骨丢失了更少的骨组织[3]。而巨颌症、颌骨二磷酸盐相关的骨坏死等只影响上颌骨和下颌骨[13-14],以上都提示颌骨和髂骨有着不同的体内平衡机制。
以上研究证明:颌骨和髂骨在胚胎发育过程中来源于不同的胚层,并且在骨质疏松症等疾病中表现出来的反应也不同,那么他们在生长增殖与成骨能力方面是否有不同?本研究通过体外组织块培养法和有限稀释法获取J-BMMSCs,用骨髓穿刺法和Percoll密度梯度离心法获取I-BMMSCs。通过比较两者克隆形成率及生长曲线显示:J-BMMSCs组增殖能力强于I-BMMSCs组。两者在成骨诱导条件下,通过钙化结节染色和定量分析发现: J-BMMSCs比 I-BMMSCs有更强的成骨能力。Runx2、BSP都是成骨的早期基因,是骨形成的标志,本研究中同时收集了成骨诱导0、7、14 d后的两组细胞进行RT-PCR检测,结果发现各个时间点的J-BMMSCs组骨基因的mRNA表达水平均高于I-BMMSCs组。
概括本结果可见:J-BMMSCs增殖和成骨能力均强于I-BMMSCs,支持先前有关来源于牙髓[15]、牙周膜[16]、牙槽骨[4]等颅面部的干细胞具有独特性能这一结论,与Aghaloo等[17]对大鼠颌骨骨髓间充质干细胞与长骨骨髓间充质干细胞成骨能力的研究结论也一致。从而初步证明颌骨是骨移植术中一个主要的供体位点。
[1] Chai Y,Maxson RE Jr.Recent advances in craniofacial morphogenesis[J].Dev Dyn,2006,235:2353-2375.
[2] Mackie EJ,Ahmed YA,Tatarczuch L,et al.Endochondral ossification:how cartilage is converted into bone in the developing skeleton[J].Int J Biochem Cell Biol,2008,40(1):46-62.
[3] Mavropoulos A,Rizzoli R,Ammann P.Different responsiveness of alveolar and tibial bone to bone loss stimuli[J].J Bone Miner Res,2007,22(3):403-410.
[4] Matsubara T,Suardita K,Ishii M,et al.Alveolar bone marrow as a cell source for regenerative medicine:differences between alveolar and iliac bone marrow stromal cells[J].J Bone Miner Res,2005,20:399-409.
[5] Cicconetti A,Sacchetti B,Bartoli A,et al.Human maxillary tuberosity and jaw periosteum as sources of osteoprogenitor cells for tissue engineering[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2007,104(5):618 el-12.
[6] Jackson IT,Helden G,Marx R.Skull bone grafts in maxillofacial and craniofacial surgery[J].J Oral Maxillofac Surg,1986,44 (12):949-955.
[7] Sawin PD,Traynelis VC,Menezes AH.A comparative analysis of fusion rates and donor-site morbidity for autogeneic rib and iliac crest bone grafts in posterior cervical fusions[J].J Neurosurg,1998,88(2):255-265.
[8] Bodine PVN,Trailsmith M,Komm BS,et al.Development and characterization of a conditionally transformed human osteoblastic cell line[J].J Bone Miner Res,1996,11:806-819.
[9] Leucht P,Kim JB,Amasha R,et al.Embryonic origin and Hox status determine progenitor cell fate during adult bone regeneration[J].Development,2008,135(17):2845-2854.
[10] Chai Y,Jiang X,Ito Y,et al.Fate of the mammalian cranial neural crest during tooth and mandibular morphogenesis[J].Development,2000,127(8):1671-1679.
[11] Hsieh YD,Devlin H,McCord F.The effect of ovariectomy on the healing tooth socket of the rat[J].Arch Oral Biol,1995,40 (6):529-531.
[12] Miller SC,Hunziker J,Mecham M,et al.Intermittent parathyroid hormone administration stimulates bone formation in the mandibles of aged ovariectomized rats[J].J Dent Res,1997,76(8): 1471-1476.
[13] Ueki Y,Tiziani V,Santanna C,et al.Mutations in the gene encoding c-Abl-binding protein SH3BP2 cause cherubism[J].Nat Genet,2001,28(2):125-126.
[14] Ruggiero SL,Mehrotra B,Rosenberg TJ,et al.Osteonecrosis of the jaws associated with the use of bisphosphonates:a review of 63 cases[J].J Oral Maxillofac Surg,2004,62(5):527-534.
[15] Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625-13630.
[16] Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149-155.
[17] Aghaloo TL,Chaichanasakul T,Bezouglaia O,et al.Osteogenic potential of mandibular vs.long-bone marrow stromal cells[J].J Dent Res,2010,89(11):1293-1298.

