冠状动脉瘤的发生可能与炎症机制有关*
李建军
冠状动脉瘤的发生可能与炎症机制有关*
李建军
冠状动脉瘤(CAE)是较易识别的一种冠状动脉造影异常现象,表现为冠状动脉的异常扩张,其发生率约为0.3%~5.3%。冠状动脉造影是该病诊断的金标准,能明确提示动脉瘤的大小、形状、发生部位和数量。虽然近年来CAE的发病率有所上升,但对其发病机制的认识仍存有争议。有报道提示在几种情况下可明显增加CAE的发病率,包括动脉粥样硬化性血管病变、杂和子家族性高胆固醇血症、应用除草剂、乙酰胆碱酯酶抑制剂和硝酸盐、既往血管球囊成形术、多发性动脉炎和川崎病。除此之外,CAE的可能危险因素还包括基质金属蛋白酶及其组织抑制物失衡、血管紧张素转化酶基因表型差异、血浆同型半胱氨酸水平升高、可卡因的应用、吸烟、血管损伤及糖尿病等。现有的大量研究表明,炎症是动脉粥样硬化各个发病阶段的重要机制,在急性血栓性并发症及其临床事件的发生上炎症现象最为突出。新近的研究也显示,CAE的发生和发展与炎症反应相关,表现为炎性细胞因子和C-反应蛋白水平升高。因此,对CAE形成过程中炎症机制的研究,尤其是促炎和抗炎通路的全面理解可能更有助于寻找新的治疗方法。
冠状动脉瘤;炎症;C-反应蛋白*
项目:本文由国家自然科学基金(81070171),北京市自然科学基金(7082081)和中国高等教育博士点项目专项研究基金(20111106110013)部分资助
冠状动脉瘤(CAE)临床上并非少见,也较易识别,表现为血管造影或病理检查中冠状动脉异常扩张,检出率为 0.3%~5.3%[1],在造影证实为冠心病患者中的发病率为1% ~5%[2]。虽然推测50%以上的CAE与动脉粥样硬化有关,但其确切病因仍不完全清楚[1]。但可以肯定并表现一致的研究结果是瘤样扩张的冠状动脉节段的组织病理学检查均显示动脉中层受损[2]。
CAE的确切定义是冠状动脉节段性扩张,其直径大于临近正常节段的1.5倍[1]。CAE诊断的金标准是冠状动脉造影,可提供有关冠状动脉瘤的大小、形状、部位和数量等主要影像学信息,其表现是不规则的、弥漫的或囊状,或纺锤状的冠状动脉扩张。病理解剖通常较为弥漫性病变并累及冠状动脉全长,但也可表现为间断和(或)局限性。如单支冠状动脉全长均扩张归为弥漫型(图1),仅部分扩张则为局灶型(图2)。
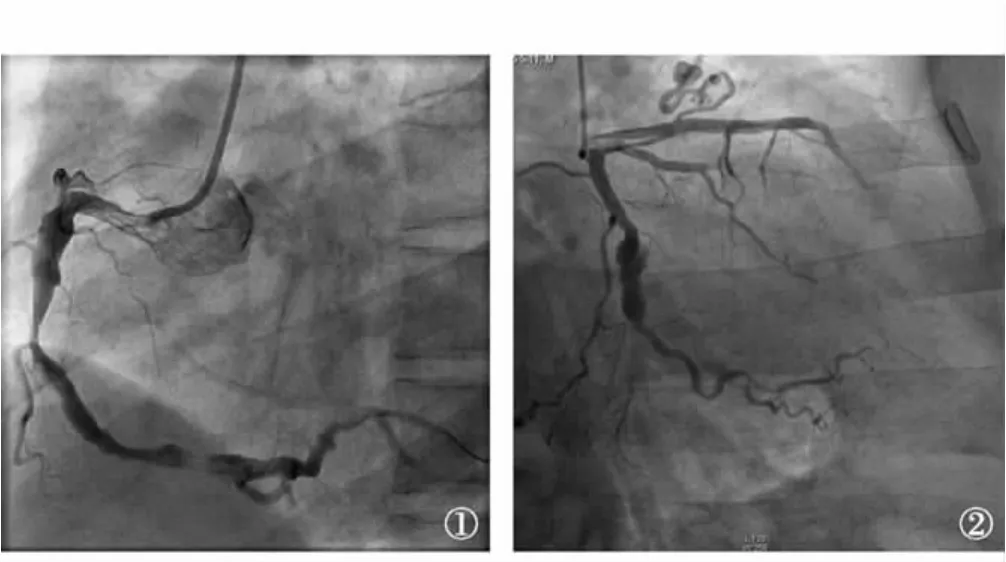
图1 右冠状动脉弥漫性瘤样扩张 图2 冠状动脉左回旋支局限性瘤样扩张
1 冠状动脉瘤的临床意义
心导管术的问世使临床上对CAE活体诊断成为可能。CAE的发病率综合各家报道约0.3% ~5.3%,但据文献报道近年来有上升趋势[3]。CAE常与阻塞性冠状动脉病变并存。其发病的主要机制多认为是中层退行性变,导致覆盖正常内皮的冠状动脉发生瘤样改变。
近年来,CAE的发病率有所上升。但是否与血管造影和血管成形术的临床应用增加有关尚不清楚。尽管其发病率上升,但有关其发病机制研究仍明显不足并尚存争议。事实上,CAE作为冠状动脉粥样硬化的变异形式,并非罕见。在临床上易发生不良冠状动脉事件如血管痉挛、血栓形成以及夹层等[4]。研究发现,CAE与心肌梗死危险性增加强烈相关[5]。一项研究尚发现,30例CAE患者中有28例出现心绞痛样症状,18例发生透壁性心肌梗死[6]。
有学者采用TIMI分级对CAE患者的冠状动脉血流进行评价[7]。虽然结构上的改变(冠状动脉管壁损坏、扩张)能够解释为什么CAE患者易于发生血栓和血管痉挛,而伴存的血流缓慢,则可能是出现心绞痛症状的原因,甚至是一些CAE患者发生心肌梗死的危险因素之一。
2 冠状动脉瘤的临床特征
对1100例患者进行血管造影,CAE患者58例,其中只有5例CAE而没有冠状动脉狭窄,提示单纯CAE较少见[5]。而且CAE多见于右冠状动脉。对4332例患者血管造影资料的回顾性研究发现,CAE的发病率为3.39%[4]。大部分(77.6%)CAE患者合并有冠状动脉狭窄。CAE累及一支血管的约49.7%,大多数(132人)发生在右冠状动脉,而且扩张程度最重。绝大多数CAE患者发生在男性(91.2%),吸烟者(56.5%),年龄比没有CAE的患者年轻[(60.8±11.7)岁 vs(63.3±10.7)岁,P=0.01]。Logistical回归分析显示只有男性与CAE有相关性(OR=3.33,95%CI 1.81~6.13),糖尿病与无CAE独立相关(OR=0.65,95%CI0.43 ~0.89)。
近来,Giannoglou等[2]在北希腊的连续10524例患者中冠状动脉造影资料进行研究。发现CAE患者287例(2.7%)。其临床特点为男性发病率显著高于女性;在男性患者而非女性患者中,年轻者CAE发病率高;CAE在右冠状动脉中的发病率显著高于前降支和回旋支;而冠状动脉病变往往更易累及前降支;而且,发生于右冠状动脉的CAE与前降支的冠状动脉病变呈强相关。
另有研究对6983例连续患者的冠状动脉造影进行分析显示,134(2%)例患者为孤立性CAE[8]。在118例有症状的患者中,34例(25%)有心肌梗死病史或表现为心肌梗死首发,32例梗死部位与CAE血管相关。62例血脂异常的患者中,42例(65%)为高甘油三酯血症。前降支是最常见的受累血管。弥漫性CAE最常见于右冠状动脉,一例患者发生了自发性CAE夹层;弥漫性CAE多发生于右冠状动脉而局灶性多发生于前降支。
无冠状动脉病变的即孤立性CAE患者死亡率为6%,合并明显冠状动脉狭窄的死亡率为 7%[1],与 Cokkinos等[4]对CAE患者的5年随访结果相同。后者报道的死亡率分别为10%和9.5%,与无CAE的急性冠状动脉综合征患者的11.9%相似。
3 冠状动脉瘤的可能致病因素
CAE的发病率在近年似有上升趋势。尽管其确切病因尚未清楚,几种情况可能使CAE发病率的增加。如粥样硬化性血管病变、杂合子家族性高胆固醇血症、使用除草剂、乙酰胆碱酯酶抑制剂和硝酸盐(可能是刺激一氧化氮合成的作用)、既往动脉球囊血管成形术、多发性动脉炎和川崎病[1-6]。
另外,CAE形成的可能致病因素还有分子生物学机制包括有基质金属蛋白酶(MMPs)和金属蛋白酶组织抑制物(TIMPs)失衡、血管紧张素转化酶(ACE)基因型、高同型半胱氨酸以及可卡因滥用、吸烟、血管外伤和糖尿病等[7-16]。
4 基质金属蛋白酶/金属蛋白酶组织抑制物失衡
MMPs是降解细胞外基质成分的一组酶。这些酶在许多的生化过程中都有重要作用,如胚胎发生、创伤愈合、血管形成、组织重塑和某些疾病如癌症和动脉粥样硬化的发生与发展。迄今在人类已经发现了23个MMP基因,大多数是多区域蛋白。最近,有人提出它们在MMPs的不同表达中的作用及其与TIMPs之间的关系是CAE的潜在致病因素[4-7]。而且有报道提出,CAE患者大动脉瘤的发生率较高,可能意味着有共同的发病机制。在一个病案报道中,Kajinami等描述弥漫CAE患者冠状动脉组织标本中有几种MMPs免疫活性增加。另外,川崎病中循环中可能导致冠状动脉病变发生的MMPs/TIMPs不平衡较为明显[5]。
Tengiz等[7]推测 MMP/TIMP失衡可能是 CAE的发病机制。动脉和小动脉主要由中层血管层调节其管壁的张力和强度。对发生瘤样扩张的冠状动脉进行组织病理检测,结果显示血管各层都存在广泛的损害,尤其是中层和内膜层。这些改变的严重程度与CAE直径相关。MMPs能够降解动脉壁细胞外基质中多种成份。因此MMPs与TIMPs之间的不平衡可能介导这种破坏性的改变,而循环中金属蛋白酶水平能够反映其在血管壁的水平。对一系列的CAE患者的研究发现,血液中MMP-3的水平在CAE患者高于对照组,提示MMP-3可能通过对细胞外基质蛋白的降解作用而参与CAE的致病机制。
另外,近年来的研究显示CAE患者颈总动脉内膜—中层厚度显著低于单纯冠状动脉疾病患者,提示CAE合并冠状动脉疾病患者颈动脉内膜—中层厚度降低可能有与冠状动脉疾病本身不同的致病机制[5]。
5 血管紧张素转化酶基因型
实验研究资料显示,肾素血管紧张素系统激活可增强血管壁的炎症反应或激活基质金属蛋白酶。另外,ACE插入/缺失(ID)多态性与血管张力和CAE的发生相关[8]。因此,有人推测,ACE基因多态性可能是影响CAE的潜在因素。Uyarel等[8]对接受冠状动脉造影的112例患者进行了回顾性评价。两组患者ACE的ID基因型进行分析发现,第一组为发生CAE的56例患者。第二组有明确冠状动脉病变,无CAE证据。采用聚合酶链反应检测ACE基因型。结果显示,第一组中DD基因型比率高于第二组(分别为39%和18%,P<0.05)。而Ⅰ等位基因在第二组明显高于第一组(分别为82.1%和60.7%,P<0.05)。据此作者认为,ACE DD基因型可能是CAE的危险因素。
除上述危险因素之外,一些非经典的危险因素亦是当前心血管疾病领域的研究热点。尽管可能的机制尚未充分了解,有学者认为CAE可能是动脉粥样硬化发生血管重塑的初始状态。然而,尚不清楚的是,为什么一些冠心病患者发生了CAE而大多数患者并未如此。既往的组织病理研究发现,在CAE中有弹性蛋白,胶原和细胞外基质损伤以及炎性细胞聚积[6]。这些发现使人们产生了这样一个推理,即CAE病理机制可能与血管张力及结构和组织血管紧张素Ⅱ有关,而后者在血管壁通路中起重要作用。Diet等[7]证实,在炎性细胞和巨噬细胞存在的部位有组织ACE激活存在,而且缺失型多态性使ACE活性增加,在CAE形成中有关键作用。
6 同型半胱氨酸水平
高同型半胱氨酸被认为是动脉疾病包括冠心病、脑血管疾病和外周血管疾病的独立危险因素[4]。近来,有学者[9]对孤立性即不合并冠状动脉狭窄的32例CAE患者和30例冠状动脉造影正常的对照者进行研究,发现单纯CAE患者血浆同型半胱氨酸水平显著高于对照组[(14.9±4.5)mmol/L vs(8.6±19)mmol/L,P<0.001]。此外,他们还发现 CAE的节段数量与血浆同型半胱氨酸水平显著正相关(γ=0.537,P=0.002)。提示血浆同型半胱氨酸水平可能与CAE的发生有关。
7 周围精索静脉曲张
近年来发现CAE患者周围精索静脉曲张发生率增加。来源于35例男性CAE患者的资料显示,62%(21人)的CAE患者有精索静脉曲张[6],显著高于单纯冠心病患者,提示CAE的发生机制可能进一步增加易感患者发生精索静脉曲张。
8 应用可卡因
CAE虽见于0.2%至5%血管造影的患者,也可能与动脉粥样硬化、川崎病和一些其它少见疾病有关。最近,Satran等[10]对连续112例有应用可卡因史并且行冠状动脉造影的患者进行研究发现,可卡因应用者的CAE发病率明显高于对照组(分别为30.4%和7.6%)。提示可卡因的使用可能有增加形成CAE的倾向,继而成为心肌梗死的病因。
9 其它可能致病因素
吸烟[4]和家族型高胆固醇血症[6]也认为是CAE的成因之一,糖尿病与CAE独立负相关[5]。也有少数数据显示应用二硝酸异山梨醇酯治疗的患者似乎能加速CAE的进展[11]。有人提出无冠状动脉狭窄的CAE属于非动脉粥样硬化起源;认为一氧化氮是这些动脉的强扩张剂,参与CAE的发病机理。
10 炎症与冠状动脉瘤
炎症在防御感染性物质和损伤中起重要作用。人类已初步了解到在引起急性或慢性炎症反应的先天或获得性免疫中的许多分子细胞基础及发生与发展的基本过程[5]。近年来的研究指出,炎症是动脉粥样硬化各个阶段的重要特征。炎症通路在急性血栓并发症及其临床事件中表现最为典型。因此,目前无论从理论上还是从临床实践上都越来越认识到炎症在动脉粥样硬化中的重要性。有数据显示CAE与代表炎症活动的炎性细胞因子和C反应蛋白(CRP)水平升高相关。因此,对炎症机制尤其是CAE中促炎和抗炎通路的深入了解有助于促进研发新的防治方法,减少其发生。
新近的研究提示,细胞因子诱导的组织炎症在腹主动脉瘤发病中有一定作用,而且有资料证实在这些患者循环中白介素-6(IL-6)水平升高。Tokgozoglu等[12]对43例CAE患者研究发现,与正常对照组相比,CAE患者血清IL-6水平显著升高,可能提示炎症通路的潜在作用。
Turhan等[13]选择32例孤立CAE患者,与32例冠心病合并CAE的患者和30例血管造影正常者进行对比分析,以炎症的特殊标记物—血浆CRP水平为主要指标。结果发现,CRP水平在孤立CAE患者中显著升高,提示CAE的发病机制中可能涉及更严重的炎症机制。但是Finkelstein等[14]最近公布的数据显示,CAE与冠心病以及正常对照组之间血CRP水平没有显著差异,CRP与循环MMP/TIMP水平之间也没有相关性。从而对炎症在这些人群中作为CAE的形成机制提出质疑。
事实上,有关炎症在CAE中的作用的研究资料尚少。Yilmaz等[15]发现单纯CAE病人血浆可溶性细胞间黏附分子-1(ICAM-1),血管细胞黏附分子-1(VCAM-1)和E-选择素水平较冠心病不合并CAE患者以及冠状动脉正常的对照组升高,提示在这些患者的冠状动脉循环中存在更严重和广泛的慢性炎症。另外,Turhan等[16]发现孤立性CAE和冠心病合并CAE患者血中ICAM-1及VCAM-1水平较冠状动脉正常的对照组升高。我们新近的研究也发现,CAE患者血IL-6和CRP水平较正常对照和单纯冠心病患者为高。这些研究结果均提示血管壁炎症可能在CAE的发病机制中有一定作用。
11 临床提示
尽管CAE是熟知的血管造影现象,其潜在病理机制目前仍不清楚。但临床上CAE并非常见,其存在可能与心绞痛、血栓形成和心肌梗塞发生有关。因此,积极开展其发生机制的研究具有一定的临床价值。
由于CAE的发病机制目前尚未完全清楚,更凸现出探讨其致病危险因素的重要性。许多研究表明动脉粥样硬化是一类炎症性疾病。尽管在动脉粥样硬化过程中CAE形成的机制尚不清楚,但了解到动脉粥样硬化诱导的CAE最初起源于中层的变薄和/或削弱。因此,CAE可能与冠状动脉粥样硬化合并出现。这些研究可能会阐明CAE的致病机制,也可能帮助研发新的减轻血管损伤的治疗模式。
12 参考文献
[1] Satran A,Bart BA,Henry CR,et al.Increased prevalence of coronary artery aneurysms among cocaine users.Circulation,2005,111:2424-2429.
[2] Giannoglou GD,Antoniadis AP,Chatzizisis YS,et al.Prevalence of ectasia in human coronary arteries in patients in northern Greece referred for coronary angiography.Am JCardiol,2006,98:314-318.
[3] Demopoulos VP,Olympios CD,Fakiolas CN,et al.The natural history of aneurismal coronary artery disease.Heart,1997,78:136-141.
[4] Li JJ,Nie SP,Qian XW,et al.Chronic inflammatory status in patients with coronary artery ectasia.Cytokine,2009,46:61-64.
[5] Li JJ,Li Z,Li J.Is systemic inflammation responsible for coronary artery ectasia?Int JCardiol,2008,130:e69-e70.
[6] Li JJ.Is any link between inflammation and coronary artery ectasia?Med Hypotheses,2007,69:678-683.
[7] Tengiz I,Ertugrul E,Aliyev E,et al.Elevated levels ofmatrixmetalloprotein-3 in patients with coronary aneurysm:a case control study.Curr Cont Trails Cardiovasc Med,2004,5:1-6.
[8] Uyarel H,Okmen E,Tartan Z,etal.The role of angiotensin converting enzyme genotype in coronary artery ectasia.Int Heart J,2005,46:89-96.
[9] Kasar F,Sincer I,Aksoy Y,etal.Elevated plasma homocysteine levels in patients with isolated coronary artery ectasia.Coron Artery Dis,2006,17:23-27.
[10] Yetkin E,Kilic S,Acikgoz N,et al.Increased prevalence of varicocele in patientswith coronary artery ectasia.Coron Artery Dis,2005,16:261-264.
[11] Sanyal S and Caccavo N.Is nitroglycerin detrimental in patientswith coronary artery ectasia?Tex Heart Inst J,1998,25:140-144.
[12] Tokgozoglu L,Ergene O,Kinay O,et al.Plasma interleukin-6 levels are increased in coronary artery ectasia.Acta Cardiol,2004,59:515-519.
[13] Turhan H,Erbay AR,Yasar AS,et al.Comparison of C-reactive protein levels in patientswith coronary artery ectasia versus patientswith obstructive coronary artery disease.Am J Cardiol,2004,94:1303-1306.
[14] Finkelstein A,Michowitz Y,Abashidze A,et al.Temporal association between circulating proteolytic,inflammatory and neurohormonalmarkers in patients with coronary ectasia.Atherosclerosis,2005,179:353-359.
[15] Yilmaz H,Tayyareci G,Sayar N,et al.Plasma soluble sdhesion molecule levels in coronary artery ectasia.Cardiology,2006,105:176-181.
[16] Turhan H,Erbay AR,Tasar AS,etal.Plasma soluble adhesionmolecules:intercellular adhesionmolecule-1,vascular cell adhesionmolecule-1 and E-selectin levels in patients with isolated coronary artery ectasia.Coron Artery Dis,2005,16:45-50.
(编辑:王宝茹)
100037 北京市,中国医学科学院 北京协和医学院 心血管病研究所 阜外心血管病医院 血脂异常与心血管疾病诊疗中心
李建军 教授 博士 博士研究生导师 主要从事炎症、血脂异常与冠心病诊疗与研究 Email:lijnjn@yahoo.com.cn
R54
C
1000-3614(2012)03-0234-03
10.3969/j.issn.1000-3614.2012.03.023
2012-03-13)
·征订启事·

