人参、红参皂苷类成分指纹图谱研究
郑 重,宋凤瑞,刘淑莹,刘志强
(1.中国科学院长春应用化学研究所,吉林 长春 130022;2.中国科学院研究生院,北京 100049)
人参、红参皂苷类成分指纹图谱研究
郑 重1,2,宋凤瑞1,刘淑莹1,刘志强1
(1.中国科学院长春应用化学研究所,吉林 长春 130022;2.中国科学院研究生院,北京 100049)
为了建立一种快速鉴定人参和红参的方法,应用超高效液相色谱-串联质谱研究人参和红参中的皂苷类成分指纹图谱。室温下用甲醇提取人参粉末,提取液离心,并用0.22μm滤膜过滤。色谱柱是BEH Shield RP18柱(1.7μm×2.1×50mm,Waters,USA)和BEH保护柱;流动相:乙腈(A),水(B);0~5min A从25%到50%,5~8min,A从50%变化到90%,8~10min,A从90%变到100%,10~12min,A保持在100%;进样体积10μL,检测波长195nm。质谱喷雾电压-4.5kV,金属毛细管电压-45V,温度250℃,壳气(氮气)流速27L/h,辅助气(He)流速180L/h,质量扫描范围m/z200~1 500,碰撞气为氦气,质谱碎裂信息用来鉴定皂苷。液质联用数据显示在人参炮制过程中化学成分发生了变化,结果表明不同批次的人参与红参能够清晰分组。该方法快速,简单,特征性和重现性良好。
人参;红参;人参皂苷;指纹图谱;多元统计分析
人参为五加科Araliaceae植物Panax ginseng C.A.Mey.的干燥根,是名贵中药材,红参是人参的熟用品,其加工方法是经过浸润、清洗、分选、蒸制、晾晒、烘干等工序而成[1]。因为热处理红参在蒸制过程中会发生化学反应,导致成分上发生变化。人参和红参中所含成分很多,主要活性成分是人参皂苷。人参皂苷有抗肿瘤、增强免疫力、抗衰老等广泛的药理活性。中药指纹图谱是一种综合的、可量化的鉴定手段,它建立在中药化学成分系统研究的基础上,主要用于评价中药材以及中药制剂半成品质量的真实性、优良性和稳定性。随着HPLC-MS和GC/MS等联用技术的发展,中药指纹图谱技术趋于完善[2-4],高效液相色谱法已成为中药指纹图谱技术的首选方法。本工作在样品简单预处理后,应用超高效液相色谱-质谱联用技术测定人参(即未经处理的原人参)和红参(由原人参加工而成)中皂苷类的化学成分,系统地观察经过蒸制其化学成分发生变化的规律,为人参样品的快速鉴别提供参考方法。
1 实验部分
1.1 仪器与试剂
LTQ超高效液相色谱-质谱系统:美国Thermo公司产品;H-class超高效液相色谱系统:美国 Waters公司产品;电子分析天平:德国Sartorius公司产品;KQ-500DE型数控超声波清洗器:昆山市超声仪器有限公司产品;5810R高速离心机:德国Eppendorf公司产品。
人参、红参药材:由中国农业科学院特产研究所提供;标记为 Re、Rg1、Rf、Rb1、Rc、Rg2、Rg3、Rd的人参皂苷:由吉林大学药学院提供;乙腈(色谱纯):美国Fisher试剂公司产品;其他试剂(分析纯):北京化工厂产品;水为 Milli-Q超纯水(18.2MΩ·cm)。
1.2 实验条件
1.2.1 色谱条件Waters Acquity BEH Shield RP18色谱柱(1.7μm×2.1×50mm),Waters BEH RP18保护柱,柱温25℃;样品进样量10μL;流动相为乙腈和水,采用二元线性梯度洗脱,流速0.3mL/min;检测波长195nm。
1.2.2 质谱条件 喷雾电压4.5kV;金属毛细管电压4.5V;温度250℃;鞘气为N2,流速30 arb;辅助气体为He,流速10arb;分析条件采用负离子模式,扫描范围为m/z200~1 500。
1.3 样品制备
精密称取1g药材人参,加入30mL甲醇,浸泡过夜,超声60min,以5 000r/min离心10 min,过0.22μm滤膜,备用。
1.4 样品测试
本研究系统地观察了样品的测试情况:1)精密度实验:连续进样5次,其色谱图中各色谱峰的相对保留时间RSD为0.11%,相对峰面积的RSD为0.25%;2)重现性实验:取同一批人参药材制备溶液5份,各色谱峰的相对保留时间RSD均小于0.25%,相对峰面积的RSD均小于1.94%,重现性较好;3)稳定性实验:取同一人参样品试液,分别于第0、4、8、12、24h测定,各色谱峰的相对保留时间RSD均小于0.08%,相对峰面积的RSD均小于2.54%,说明样品至少在24h内是稳定的。
1.5 测试结果
不同批次的原人参和红参的超高效液相色谱指纹图谱示于图1和图2。不同批次的原人参由于产地、生长年限等因素,其谱图有所差异;而经过加工后制成红参的色谱图相似度比原人参高。

图1 不同批次人参指纹图谱Fig.1 Fingerprint graphs of ginsengs for different batches
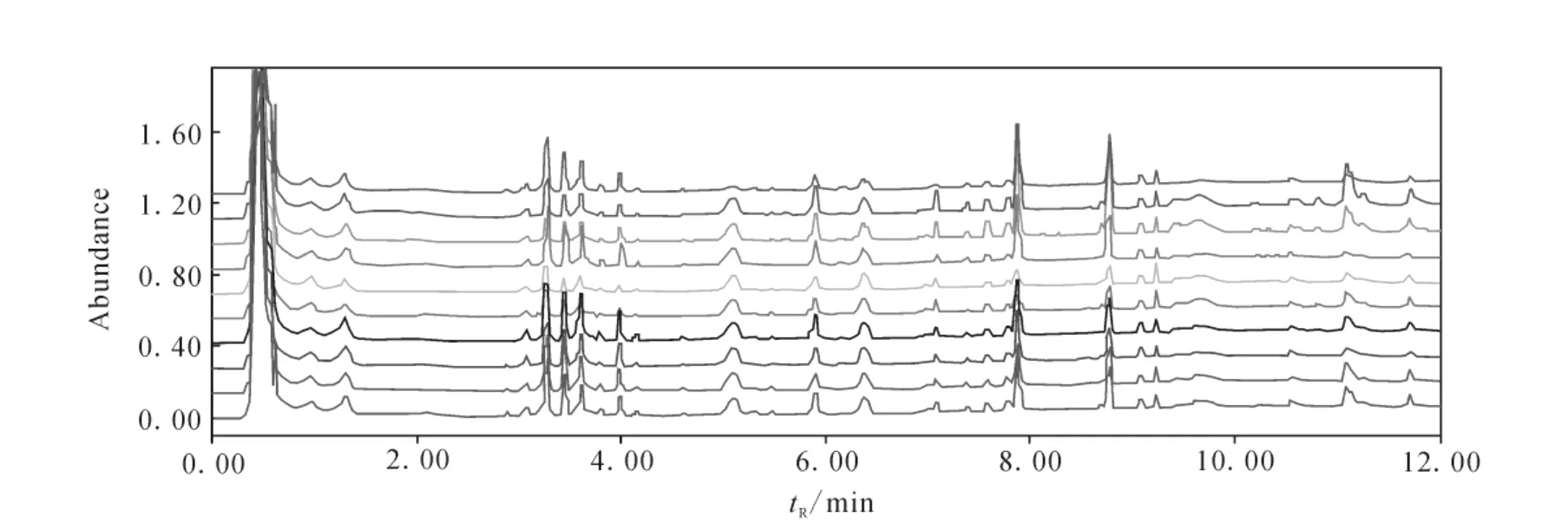
图2 不同批次红参样品指纹图谱Fig.2 Fingerprint graphs of red ginsengs for different batches
2 结果与讨论
人参的有效成分是人参皂苷,而不同的人参皂苷其基本结构是相似的:由30个碳原子排列成4个环的甾烷类固醇核。它们依据苷元结构的不同而被分为两组:达玛烷型和齐墩果烷型。达玛烷类型又被分为两类:原人参二醇型皂苷和原人参三醇型皂苷,其骨架结构示于图3。它们的区别在于:当R3为羟基时,是原人参三醇型皂苷;当R3为氢时,是原人参二醇型皂苷。
原人参二醇型皂苷有:Ra1、Ra2、Ra3、Rb1、Rb2、Rb3、Rc、Rd、Rg3、(20R)-Rg3、Rh2、(20R)-Rh2、Rs1、Rs2、Rs3、F2、Malonyl-Rb1、Quinguenoside-R1、Malonyl-Rb2、Malonyl-Rc、Malonyl-Rd、Notoginsenoside-R4、Rg5、Rh3、Rs4、Rk1、Rs5;原人参三醇型皂苷有:Re、Rf、20-gluco-Rf、Rg1、Rg2、(20R)-Rg2、Rh1、(20R)-Rh1、Notoginsenoside-R1、Notoginsenoside-R2、F1、Rh4、F4、Rs6、Rg6、Rk2、Rk3、Rs7、25-hydroxy-gindenoside-Rg2、 25-hydroxy-gindenoside-Rh1、 Ia、Ib[5-7]。部分原人参二醇型和原人参三醇型皂苷的结构信息列于表1。

图3 原人参二醇型皂苷和原人参三醇型皂苷的结构式Fig.3 Structures of panaxadiol ginsenosides and panaxatriol ginsenosides

表1 部分原人参二醇型皂苷和原人参三醇型皂苷的结构Table 1 Structures of some panaxadiol ginsenosides and some panaxatriol ginsenosides
齐墩果烷型皂苷为Ro,其结构示于图4。
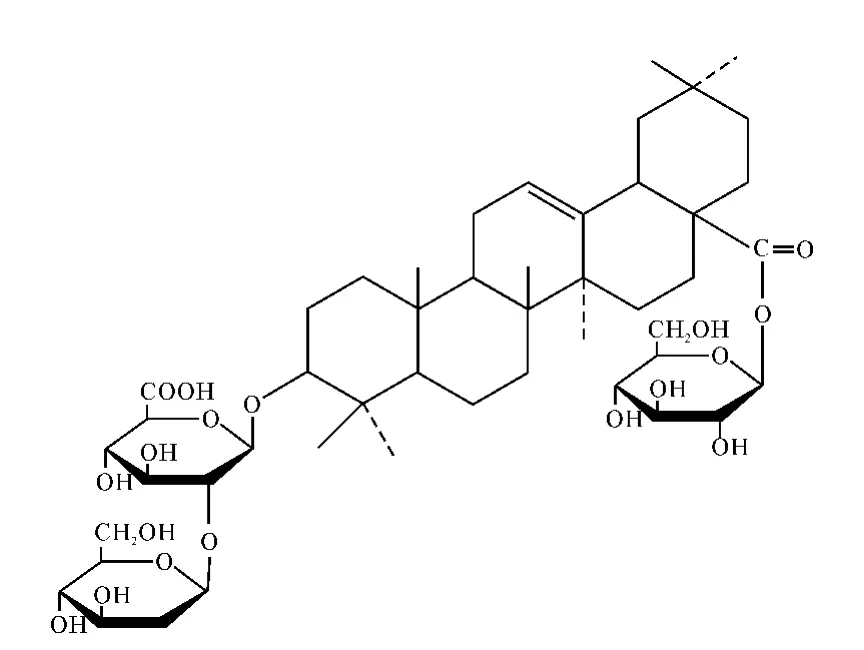
图4 人参皂苷Ro的结构Fig.4 Structure of ginsenoside Ro
2.1 原人参主要皂苷类成分的研究
原人参样品色谱图示于图5,其中,所标记的谱峰为原人参中含有的皂苷类成分。利用UPLC-ESI-MSn技术可以先将样品中的人参皂苷通过液相色谱分离,在电喷雾一级谱中获得分子质量信息,通过多级串联质谱分析得到碎片信息,并由此确定苷元类型和所连糖基的种类和数量,最后确定皂苷的结构。
以图5中峰1的ESI-MS2数据为例来说明人参皂苷的鉴定方法。峰1的二级串联质谱图示于图6。m/z945是峰1的准分子离子峰[M-H]-,其相对分子质量可以推测为946。观察到m/z799的碎片离子峰是m/z945丢失一分子鼠李糖基,m/z783的碎片离子峰是m/z945丢失一分子葡萄糖基,m/z637的碎片离子峰是m/z945丢失一分子鼠李糖基同时失去一分子葡萄糖基,m/z475的碎片离子峰是m/z945丢失一分子鼠李糖基同时失去二分子葡萄糖基,这与人参皂苷Re标准品的ESI-MS2信息相同,且色谱保留时间一致,可推断此峰为人参皂苷Re[8]。用同样的方法可以判定所测得的其它UPLC-MS/MS数据,即可进行各色谱峰的归属[8-17],结果列于表2。

图5 原人参样品皂苷类成分的色谱图Fig.5 Chromatogram of ginsenosides for ginseng

图6 峰1的二级串联质谱图Fig.6 ESI-MS2 spectrum of peak 1
2.2 红参的主要皂苷类成分的研究
红参样品的色谱图示于图7。其中,所标记的谱峰为红参中含有的皂苷类成分。按照2.1所述方法确定各谱峰对应皂苷的结构,其中保留时间为8.9min的色谱峰所对应的物质在红参中的含量显著升高,但它与其它皂苷成分不同,该物质在质谱正负离子扫描模式下均没有信号响应,所以初步判定其不是皂苷类成分。由于红参中含有皂苷类成分与原人参中的皂苷种类大体相同(人参皂苷Ro和原人参二醇在原人参样品中未被检出),但含量有所区别,其结果列于表2。
2.3 原人参、红参皂苷类成分的主要区别
从谱峰信息中可以看出:人参皂苷Rg3、Rg5、Rk1、F和原人参二醇在红参中的含量明显高于在生晒参(即原人参)中的含量。有报道,红参中的丙二酰基人参皂苷Rb1、Rb2、Rc、Rd的含量明显低于生晒参中的含量[18]。说明在红参加工过程中,人参皂苷发生糖苷键断裂进而转换成相应的苷元或次生苷。皂苷Rb1、Rb2、Rc、Rd的20位糖基很不稳定,容易被水解产生Rg3;并且20位羟基也不稳定,容易以水分子形式脱掉,形成双键,生成不饱和的人参皂苷Rk1与Rg5。皂苷Rb1、Rb2、Rc、Rd的20位糖基与3位糖基均被水解,生成原人参二醇。人参皂苷Re的20位糖基不稳定,容易被水解,生成Rg2,Rg2在20位发生了脱水反应,生成不饱和的人参皂苷F4。Rg1的20位糖基水解,再脱去一分子,水在20与22位间形成双键,生成人参皂苷Rh4[19]。Ro在红参中被大量发现,而在生晒参中没有出现相应的谱峰。m/z793的化合物为Ro脱掉一个六碳糖基生成的产物。

表2 原人参、红参样品中各色谱峰的LC/MS2鉴定Table 2 The MS2 information of LC peaks in ginseng and red ginseng

图7 红参样品皂苷类成分的色谱图Fig.7 Chromatogram of ginsenosides for red ginseng
2.4 原人参、红参在药理活性上的区别
原人参与红参都具有大补元气、复脉固脱、补脾益肺、生津止渴、安神益智等功效。但二者的用法不同:原人参性平,是日常保健常用的补品;红参是原人参的熟用品,性温,具有药效强劲之特点,是阴盛阳虚者的首选补品。
原人参、红参中的主要药效成分是人参皂苷,它们有着广泛的药理活性[20]。近年来,人参皂苷的抗肿瘤活性研究成为热点,众多研究表明,它具有较高的抗肿瘤活性,与化疗药物(如顺铂)联合应用有协同作用。人参皂苷抗肿瘤活性受母核影响:齐墩果酸型>原人参二醇型>原人参三醇型;抗肿瘤活性受糖链影响:苷元>单糖苷>二糖苷>三糖苷>四糖苷;抗肿瘤活性受C20构型影响:20(R)-人参皂苷>20(S)-人参皂苷。由于原人参加工成红参的过程中,部分原人参三醇型皂苷转化成为原人参二醇型皂苷及苷元,且有显著量的人参皂苷Ro产生,因此红参抗肿瘤活性大于原人参。
2.5 原人参和红参样品的模式识别
模式识别有多种方法,主成分分析(PCA)是其中的一种方法。这种方法是将原变量进行线性组合得到新的变量,常称为主成分。以携带信息量最大的主成分1和主成分2的得分为坐标,所得样品的散点图即可用于模式识别。
为了进一步观察原人参和红参的区别,本工作运用多元统计分析软件SIMCA-P[21]对原人参和红参进行分类研究。该软件分别在样品得分1和得分2的基础上,由显著性检验计算出临界点,于是可绘制一临界点椭圆图,示于图8。即在椭圆内的点为正常样品,落于椭圆外的点为异常样品。
由图8可见,原人参和红参很清楚地散落在两个不同的区域。假若有一未知样品,知道其落点的位置则可判断属于哪种人参。由此,模式识别的结果对于判别“真”和“假”是一种有效的手段,具有重要的实际应用价值。
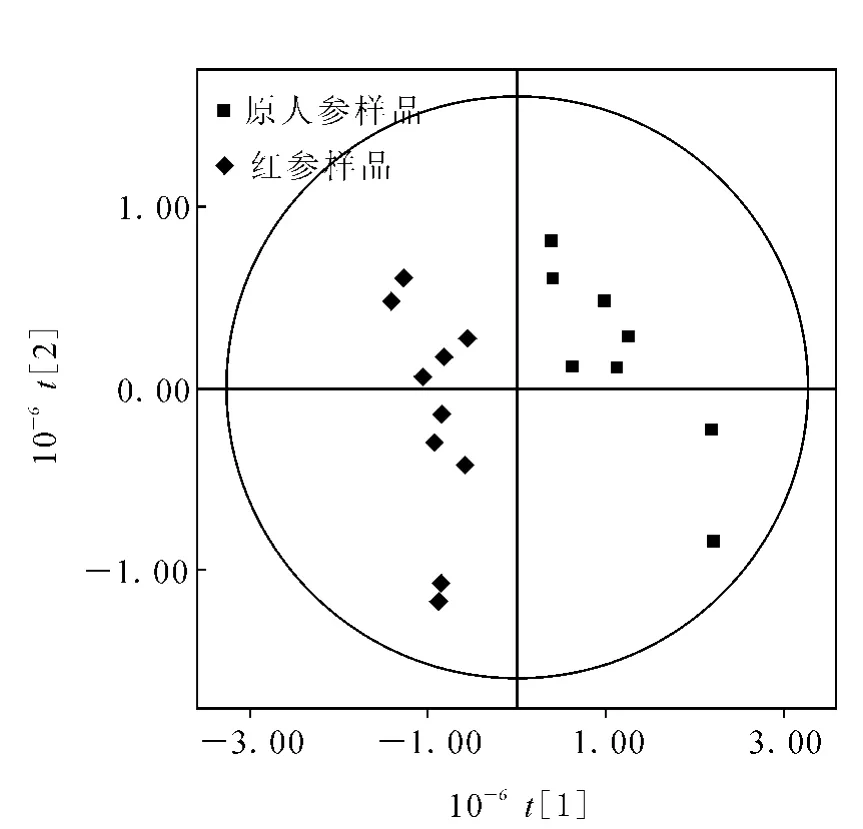
图8 PLS-DA样品分布得分图(score plot)Fig.8 PLS-DA model of ginseng and red ginseng score plot
3 结论
应用UPLC-MSn技术实现了对人参、红参药材皂苷类成分的快速分析检测,提供了丰富的谱图信息,经统计学软件SIMCA-P分析能够清晰的分组。通过对原人参、红参差异性成分的确认,解释了皂苷类成分在人参炮制成红参过程中所发生的化学变化。
[1]中华人民共和国药典委员会.中国药典:一部[M].北京:中国医药科技出版社,2010.
[2]ZHANG J L,CUI M,HE Y,et al.Chemical fingerprint and metabolic fingerprint analysis of Danshen injection by HPLC-UV and HPLC-MS methods[J].Journal of Pharmaceutical and Biomedical Analysis,2005,36(5):1 029-1 035.
[3]闫 峻,刘 舒,皮子凤,等.复方板蓝根颗粒抗病毒成分 HPLC-UV指纹图谱及LC-ESI-MSn研究[J].化学学报,2011,69(2):204-208.
[4]LIANG X,ZHANG X,DAI W X,et al.A combined HPLC-PDA and HPLC-MS method for quantitative and qualitative analysis of 10major constituents in the traditional Chinese medicine Zuo Gui Wan[J].Journal of Pharmaceutical and Biomedical Analysis,2009,49(4):931-936.
[5]DOU D,WEN Y,PEI Y,et al.Ginsenoside-Ia:A novel minor saponins from leaves of Panax ginseng[J].Planta Medica,1996,62(2):179-181.
[6]KIM D S,CHANG Y J,ZEDK U,et al.Dammarane saponins fromPanax ginseng[J].Phytochemistry Phytochemistry Phytochemistry,1995,40(5):1 493-1 497.
[7]PU Z D.Recent studys on the chemical constituents of Korean ginseng[J].Korean Journal of Ginseng science,1996,20:389-415.
[8]刘 燕,聂黎行,陈方军,等.高分离度快速液相色谱-离子阱质谱分析参麦注射液化学成分[J].药物分析杂志,2011,31(9):1 672-1 677.
[9]李 丽,刘志强,许庆轩,等.人参中皂苷类化合物的 HPLC-ESIMS研究[J].分析测试学报,2006,25(1):45-48.
[10]张海江,蔡小军,程翼宇.高效液相色谱-电喷雾质谱法鉴别人参、西洋参和三七的皂苷提取物[J].中国药学杂志,2006,41(5):391-394.
[11]马小琼,肖红斌,梁鑫淼.源内裂解液相色谱-质谱鉴别人参皂甙Rf和拟人参皂甙F11[J].分析化学,2006,34(9):1 273-1 277.
[12]张 旭,王丽娜,宋凤瑞,等.液质联用测定人参与五灵脂、莱菔子配伍的人参皂苷[J].分析化学,2007,33(4):559-563.
[13]张 旭,宋凤瑞,王隶书,等.人参与藜芦配伍化学成分变化的 HPLC-ESI-MS与ESI-MS研究[J].化学学报,2007,65(9):829-833.
[14]张语迟,刘志强,宋凤瑞,等.利用高效液相色谱和电喷雾质谱指纹图谱鉴别人参与桔梗[J].质谱学报,2008,29(4):203-208.
[15]潘坚扬,程翼宇,王 毅,等.9种人参皂苷同时测定方法及在人参质量鉴别中的应用[J].分析化学,2005,33(11):1 565-1 568.
[16]郭继芬,钟大放,乔善义,等.液相色谱-电喷雾质谱联用技术分析人参皂苷[J].质谱学报,2003,24(4):477-481.
[17]李 丽,刘春明,吴 巍,等.高效液相色谱-电喷雾质谱联用法测定人参和西洋参的皂苷类成分[J].分析化学,2005,33(8):1 087-1 090.
[18]李向高,郑友兰,贾继红,等.吉林红参与高丽红参的比较研究——应用高速薄层扫描法测定人参皂苷[J].吉林农业大学学报,1985,4:56.
[19]肖盛元,罗国安.红参加工过程中人参皂苷化学反应 HPLC/MS/MS研究[J].中草药,2005,36(1):40-43.
[20]王海南.人参皂苷药理研究进展[J].中国临床药理学与治疗学,2006,11(11):1 201-1 206.
[21]吴宏伟,李洪梅,唐力英,等.代谢组学方法研究姜黄根茎及块根次生代谢产物表达差异[J].分析化学,2012,40(5):713-717.
Fingerprint Study on Ginsenoside in Ginseng and Red Ginseng
ZHENG Zhong1,2,SONG Feng-rui1,LIU Shu-ying1,LIU Zhi-qiang1
(1.Changchun Institute of Applied Chemistry,Chinese Academy of Science,Changchun130022,China;2.Graduate School of Chinese Academy of Science,Beijing100049,China)
A rapid analysis method was established to identify ginseng and red ginseng.Ginsenosides in ginseng and red ginseng were studied as the fingerprint compounds by ultrahigh performance liquid chromatography-electrospray ionization multistage tandem mass spectrometry(UPLC-ESI-MSn).Power of ginseng sample was extracted with methanol at room temperature.The extract was centrifuged and filtered through a 0.22μm filter before analyzed by UPLC-MS.UPLC separations were carried out using a BEH Shield RP18column(1.7μm×2.1×50mm,Waters,USA)and a BEH RP18guard column(Waters).The column temperature was kept at 25℃.The flow rate was set to 0.3mL/min,and the eluting gradient was as follows:[acetonitrile(A)and water(B)]:0—5min,25%—50%A;5—8min,50%—90%A;8—10min,90%—100%A;10—12min,100%A.The injection volume was 10μL.The detection wavelength was 195nm.The mass spectrometer was op-erated in the negative ion mode with source voltage of 4.5kV.The metal capillary voltage was 45V,and temperature was 250℃.The sheath gas(N2)flow-rate was 27L/h,the auxiliary gas(He)flow-rate was 180L/h.The scan range was m/z 200—1 500.Helium was used as collision gas,and collision energy was adjusted for the intensity ratio of the base peak to the parent ion between 2and 20.The fragments got from ESI-MSnsupplied very important information to identify the ginsenosides.The data of the UPLC-ESI-MSnfor ginseng samples and red ginseng samples revealed that the chemical composition changes during the red ginseng steaming process.The result shows different batches of ginseng and red ginseng are clearly distinguished,which explain the chemical composition changes during the red ginseng steaming process.The method is rapid,simple,characteristic and good reproducibility.
ginseng;red ginseng;ginsenoside;fingerprint;multivariate statistical analysis
O 657.63
A
1004-2997(2012)06-0327-07
2012-10-14;
2012-10-30
国家自然科学基金项目(20953001),吉林省与中国科学院科技合作资金项目(2010SYHZ0052,2011CJT0015)资助
郑 重(1978~),男(汉族),吉林长春人,助理研究员。E-mail:zhengzh@ciac.jl.cn
刘志强(1962~),男(汉族),吉林人,研究员,从事天然药物化学与有机质谱学研究。Email:liuz@ciac.l.cn

