超高效液相色谱-四极杆飞行时间质谱测定茶叶中手性农药茚虫威对映体残留
张新忠,罗逢健,陈宗懋,吕美玲
(1.中国农业科学院茶叶研究所,农产品质量安全研究中心,浙江 杭州 310008;2.农业部茶叶产品质量安全风险评估实验室,浙江 杭州 310008;3.安捷伦科技中国有限公司,北京 100102)
超高效液相色谱-四极杆飞行时间质谱测定茶叶中手性农药茚虫威对映体残留
张新忠1,2,罗逢健1,2,陈宗懋1,2,吕美玲3
(1.中国农业科学院茶叶研究所,农产品质量安全研究中心,浙江 杭州 310008;2.农业部茶叶产品质量安全风险评估实验室,浙江 杭州 310008;3.安捷伦科技中国有限公司,北京 100102)
为了满足茶叶中手性农药茚虫威对映异构体残留检测的需要,采用超高效液相色谱-四极杆飞行时间质谱(UHPLC-Q-TOF/MS)分析茶叶中手性农药茚虫威对映异构体的残留。采用乙腈提取,Florisil和GCB混合柱净化,Lux 3μCellulose-1手性柱拆分,0.40mL/min V(0.10%甲酸水溶液)∶V(甲醇)=15∶85的溶液作为流动相,UHPLC-Q-TOF/MS基质外标法定性定量分析。茚虫威两个对映体在0.002 5~0.600 mg/L浓度范围内满足线性关系,相关系数r为0.997 3和0.993 1,仪器检测限为0.001mg/L;绿茶在0.01、0.10、1.00mg/kg 3个添加浓度水平下,平均添加回收率为80.75%~101.69%,相对标准偏差(RSD)小于15%,方法定量限为0.002 5mg/kg。该方法准确、可靠,能够满足茶叶中茚虫威手性对映体残留分析的需要。
茶叶;茚虫威;手性农药;对映体拆分;残留分析;超高效液相色谱-四极杆飞行时间质谱(UHPLC-QTOF/MS)
近年来,茶园中使用较多的吡虫啉、啶虫脒等农药,这些农药存在水溶性强、易在茶汤中浸出、影响人体饮用安全的问题,因此引起人们对茶叶中农药残留安全性越来越多的关注[1]。据统计全球市场上有25%的农药为手性化合物[2],而在研究农药残留时,则很少关注农药手性对映异构体的差别。茚虫威是国家现代茶产业体系发现的一种对茶园茶树假眼小绿叶蝉等有很好防治效果,用于替代吡虫啉、啶虫脒的脂溶性农药[3],其化学结构示于图1,研究表明其有效体为S体,R体不具备杀虫活性[4]。目前,对茚虫威手性对映异构体残留分析[5]和拆分分析[6]的研究较少,且大多采用正相手性液相色谱紫外检测法,该方法的灵敏度和准确度较低,与质谱的兼容性差。
茶叶是一种复杂基质,目前未见有关茶叶中手性农药对映体残留分析的研究报道。因此,为了满足未来茶叶中茚虫威农药手性对映体残留检测筛查的需要,为进一步研究茚虫威手性对映异构体在茶叶中的选择性降解迁移规律提供分析方法,本研究采用超高效液相色谱-四极杆飞行时间串联质谱(UHPLC-Q-TOF/MS)测定茶叶中手性农药茚虫威对映体的残留。
1 实验部分
1.1 仪器与试剂
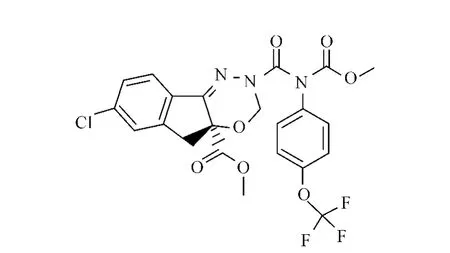
图1 茚虫威化学结构式Fig.1 The chemical structure of indoxacarb
UHPLC-Q-TOF/MS 6530系列:美国 Agilent公司产品,配以实时质量校正的双喷雾离子源;高速离心机:德国Sigma公司产品;电子分析天平(0.000 1g和0.01g):瑞士 Mettler-Toledo公司产品;R-210旋转蒸发仪:瑞士Buchi公司产品;KQ-250DB型数控超声波清洗器:昆山市超声仪器有限公司产品;T-18高速均质匀浆器:德国IKA公司产品;DFT-200手提式高速万能粉碎机:浙江温岭市林大机械有限公司产品;Vortex Genie2型涡旋振荡器:美国Scientific Industries公司产品;玻璃柱管(10mm×200 mm):杭州常盛科教器具厂产品;50mL离心管、0.22μm Filter Unit滤膜:天津博纳艾杰尔科技有限公司产品。
乙腈、甲醇、正己烷、丙酮(色谱纯):Honeywell公司产品;甲酸、NaCl、无水 MgSO4(分析纯):上海试四赫维化工有限公司产品;纯净水:杭州娃哈哈有限公司产品;Cleanert PestiCarb填料(石墨化炭黑GCB,120~400目):天津博纳艾杰尔科技有限公司产品;硅镁型吸附剂(Florlisil填料,60~100目,650℃烘4h,冷却后按10%比例加入纯净水,密封振荡混匀4h,放置干燥器中备用):温州市化学用料厂产品;Florlisil+GCB混合柱:取2.0g Florlisil和0.050g GCB搅拌混合均匀,按照1g NaSO4、Florlisil+GCB混合物、1g NaSO4顺序装入玻璃柱管中制成Florlisil+GCB混合柱,10mL V(正己烷)∶V(丙酮)=7∶3的溶液预淋洗;茚虫威外消旋体标准品(R 体∶S体=1∶1,98%):德国 Dr.Ehrenstorfer公司产品。
0.10%甲酸溶液:吸取1mL甲酸,加入至1 000mL纯净水中溶解,超声脱气,现配现用。
1.2 色谱-质谱条件
1.2.1 色谱条件 Lux 3μCellulose-1色谱柱(150mm×2.0mm):美国Phenomenex公司产品;柱温40℃;进样10μL;15%的0.10%甲酸水溶液(A)与85%甲醇(B)洗脱10min;流速0.40mL/min;R体与S 体的保留时间分别为3.55min和4.03min。
1.2.2 质谱条件 ESI+-Q-TOF/MS全扫描模式,毛细管电压3 500V,干燥气温度300℃,干燥气(N2)流速8L/min,雾化气(N2)压力2.41×105Pa,碎裂电压130V,锥孔电压65 V,倍增电压750V,质量扫描范围m/z 100~1 000,采集速率2spectra/s,参比离子 m/z 121.050 873和m/z922.009 798。
1.3 样品处理
称取2.00g粉碎后的绿茶粉,置于50mL塑料离心管中,加入10mL乙腈涡旋混匀,超声浸泡20min后,加入1g NaCl涡旋混匀并均质1min,以6 000r/min离心5min,取乙腈层6 mL至三角瓶,真空旋转浓缩近干;加入5mL V(正己烷)∶V(丙酮)=7∶3的溶液超声溶解,上样至Florilisil+GCB混合柱,接收流出液;继续加入25mL V(正己烷)∶V丙酮=7∶3的溶液洗脱接收,浓缩近干;加入0.90mL甲醇超声溶解;再加入0.10mL水,涡旋混匀;过0.22μm滤膜转移至进样瓶,UHPLC-Q-TOF/MS进样5μL,基质外标法测定。
1.4 标准曲线
称取0.010 0g茚虫威外消旋体标准品至烧杯中,乙腈溶解并转移至50mL容量瓶中定容,配制成200mg/L标准储备液(对映单体浓度为100mg/L),-18℃下避光保存。将储备液用V(甲醇)∶V(水)=9∶1的溶液稀释成对映体浓度为0.600、0.200、0.050、0.020、0.005、0.002 5mg/L系列标准工作溶液,UHPLC-QTOF/MS进样5μL,重复测定3次,以浓度为横坐标X,提取离子平均峰面积为纵坐标Y,获得茚虫威对映体溶剂标准曲线、线性相关系数及仪器检出限。
1.5 添加回收率、精密度与方法定量限
称取2.00g经测定不含茚虫威残留的空白绿茶,分别添加1.00mL茚虫威对映单体浓度为0.020、0.200和2.00mg/L的标准溶液(即茚虫威对映单体添加水平为0.01、0.10和1.00 mg/kg),每个浓度分别添加6份,涡旋混匀后放置过夜12h,以使更接近于实际样品,然后按照1.3进行提取净化,待测;同时将提取净化后获得的空白绿茶基质溶液加入相应浓度的标准溶液中定容,作为基质标准进行测定,计算添加回收率、相对标准偏差及方法定量限。
2 实验结果
2.1 手性色谱条件的优化
文献[5-6]分别采用Chiralpak®AS-H 柱 和Chiralcel®OD-H柱对茚虫威手性对映体进行正相拆分分析,获得较好的拆分效果,但在正相条件下,无法与质谱联用以提高灵敏度,而这对茶叶等复杂基质中的残留分析显得尤为重要。本研究在反相拆分条件下,对比了Lux 3μCellulose-1和Lux 3μCellulose-2两种色谱柱,分别选取纯水、0.10%甲酸水溶液和10mmol/L乙酸铵水溶液作为流动相A,甲醇或乙腈作为流动相B,在不 同柱温 (5~50 ℃)、不同流量(0.100~0.800mL/min)、不同流动相(60∶40~10∶90)条件下的茚虫威对映体拆分效果。
结果表明:Lux 3μCellulose-2柱拆分效果不如Lux 3μCellulose-1柱;乙腈拆分效果不如甲醇;加入离子化试剂甲酸、乙酸铵等对拆分效果影响不大,但有利于茶叶基质中的杂质洗脱出来,延长色谱柱寿命,同时对茚虫威离子化的[M+H]+峰与[M+Na]+的比例亦有一定影响,能抑制[M+Na]+的生成,促进[M+H]+的生成。因此最终选择Lux 3μCellulose-1柱作为茚虫威手性对映体的拆分分析柱,0.10%甲酸水溶液(A)与甲醇(B)作为流动相。
色谱柱柱温和流量的降低会使容量因子明显加大,分离因子稍有加大,分离度加大,但峰型展宽且会出现拖尾,不同色谱柱柱温下拆分效果示于图 2;柱温 30 ℃,流速 0.30mL/min,0.10%甲酸水溶液(A)与甲醇(B)流动相在不同比例下对茚虫威的拆分效果示于图3,当V(甲醇)∶V(0.10%甲酸)=60∶40时,30min内未见茚虫威对映异构体流出,甲醇比例越高,茚虫威保留时间越短,但拆分效果越弱;进样液与流动相比例接近相对于单纯有机溶剂进样,可以提高分离度。最终选择的色谱拆分分析条件见1.2。
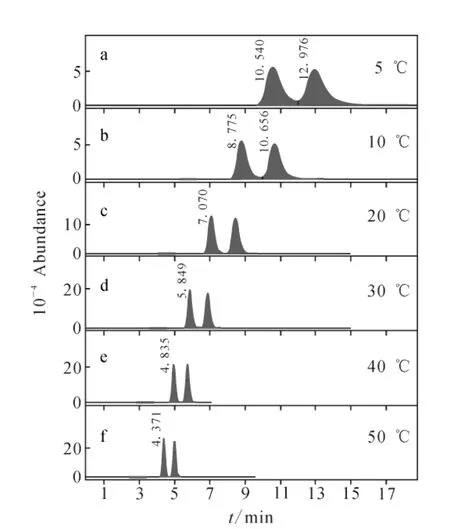
图2 不同色谱柱温度下Lux Cellulose-1拆分茚虫威对映体的效果Fig.2 The enantioseparation effect of indoxacarb at different temperatures by Lux Cellulose-1column
通过对当前市场上茚虫威农药分析并结合文献[7]推断对映体1为R体,对映体2为S体,最佳分析条件下,杜邦商品农药凯恩®的拆分色谱图与标准品对比色谱图示于图4。
2.2 质谱条件的优化
茚虫威[M+H]+峰测定的质荷比为m/z528.076 3,计算的理论质荷比为m/z528.078 5,误差-4.17×10-6;[M+Na]+峰测定的质荷比为m/z550.058 9,计算的理论质荷比为m/z550.059 9,误差+1.82×10-6。在测定过程中发现[M+Na]+峰强度远远大于[M+H]+峰,故对全扫描图谱采用[M+Na]+峰理论值±10×10-6误差提取离子流进行定量分析,[M+H]+峰辅助定性分析,优化后的质谱条件见1.2。采用 Q-TOF/MS扫描,用准确质荷比提取离子流进行定性定量分析,比普通的LC/DAD或LC/MS方法有更好的灵敏度和准确度。
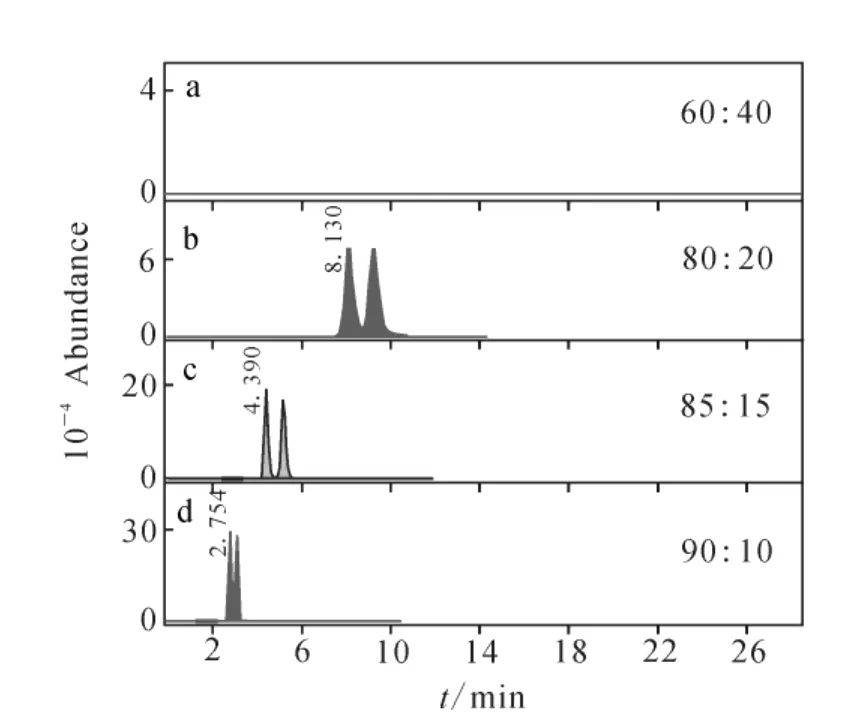
图3 Lux Cellulose-1柱中流动相甲醇(B)与0.10%甲酸水溶液(A)在不同比例下对茚虫威拆分效果Fig.3 The enantioseparation effect of indoxacarb at different mobile phase compositons by Lux Cellulose-1
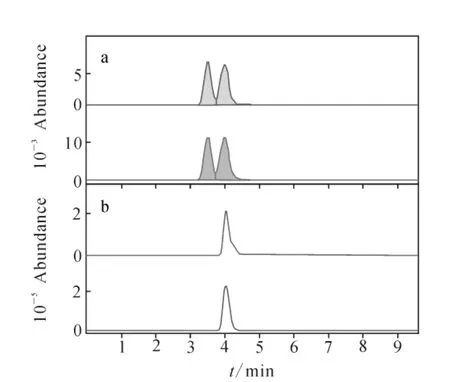
图4 标准品色谱图(a)与杜邦公司商品化农药凯恩®的拆分色谱图(b)对比Fig.4 The comparative chromatogram of standard solution(A)and Dupont pesticide KAI-ENG® (B)
2.3 提取净化方法的优化
茚虫威难溶于水,易溶于乙腈、丙酮等有机溶剂,对茶叶中茚虫威残留的提取多采用乙腈[8-10]、氯化钠水溶液结合V(丙酮)∶V(正己烷)=3∶7[11]等。前期研究[12]对比了绿茶添加样分别采用乙腈、丙酮、水+乙腈提取的效果,结果在回收率上差别不大,但是丙酮提取的色素类杂质多,会增加后续净化的难度;对于水溶解度较小的农药茚虫威,干茶样中加入水浸泡提取并不能改善提取效果,反而会增加咖啡碱等水溶性杂质的浸出,而加大后续净化的难度。因此最终选择茶叶直接加入乙腈均质提取,既能减少杂质共提物,又有较好的回收率。
茶叶中农药残留分析净化时,多采用GCB[11]、TPT 混 合 填 料 柱[8-9]、凝 胶 渗 透 色 谱GPC[13]以及 QuEChERs[10,14]等方法净化。本研究尝试采用2g Florlisil柱净化1.2g绿茶提取液,同时混合加入0.050g GCB填料用于吸附除去部分色素,既能节省试验成本,相对于QuEChERs等净化方法,又能更好地去除咖啡碱、儿茶素等杂质共提物,保证净化效果并降低了后期质谱离子源等的维护。图5给出了30 mL不同体积比的正己烷-丙酮对Florlisil+GCB柱上手性农药茚虫威对映体的洗脱效果。结果表明V(正己烷)∶V(丙酮)=7∶3时,回收率和净化效果最佳,最终选择2.0g Florlisil+0.050g GCB混合柱净化,30mLV(正己烷)∶V(丙酮)=7∶3的溶液作为洗脱剂。
2.4 标准曲线、添加回收率、精密度和定量限
在0.002 5、0.005、0.020、0.050、0.200和0.600mg/L标准浓度下,手性农药茚虫威对映体S体和R体分别满足线性方程y=9 443 775x+116 891和y=6 310 326x+137 072,线性相关系数r分别为0.997 3和0.993 1,仪器检出限为0.001mg/L。
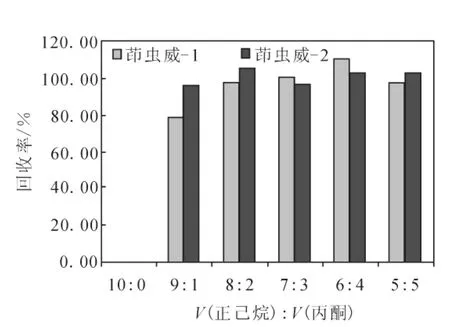
图5 不同比例的正己烷-丙酮洗脱Florlisil+GCB柱上手性农药茚虫威对映体的回收率Fig.5 The elution recoveries of indoxacarb enantiomers at the mix-column of florisil and GCB by different compositions of hexane and acetone
空白绿茶粉添加标准后混匀放置12h再进行分析,基质外标法定量,平均回收率为80.75%~101.69%,相对标准偏差(RSDs)为5.58%~14.48%,根据最低添加浓度下的信噪比S/N=10,计算得方法定量限为0.002 5 mg/kg,详细结果列于表1,相关色谱图示于图6。A~D分别为总离子流色谱图,a~d分别为[M+Na]+峰m/z550.059 9±10×10-6提取离子流色谱图。根据3个浓度下的溶剂标准溶液与基质标准溶液对比发现,茚虫威具有较强的基质减弱效应,因此在实际测定时,应用基质标准来进行定量以确保定量的准确度。
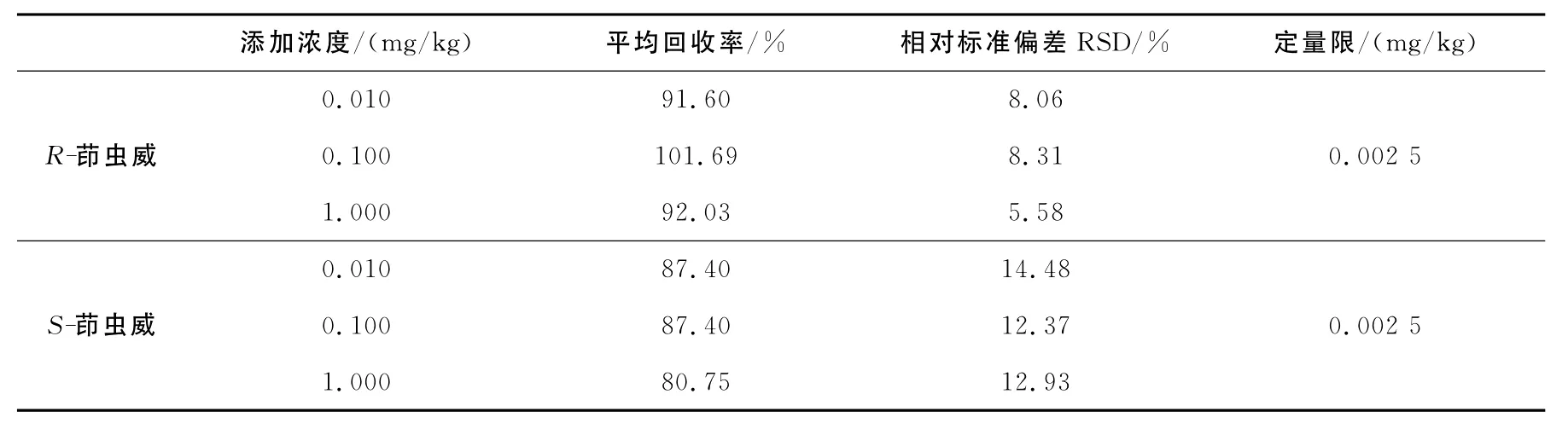
表1 UHPLC-Q-TOF/MS测定绿茶中茚虫威对映体的添加回收率、相对标准偏差和方法定量限Table 1 The spiked recoveries,relative standard deviations(RSDs)and limits of quantification(LOQs)of indoxacarb enantiomers in green tea by UHPLC-Q-TOF/MS
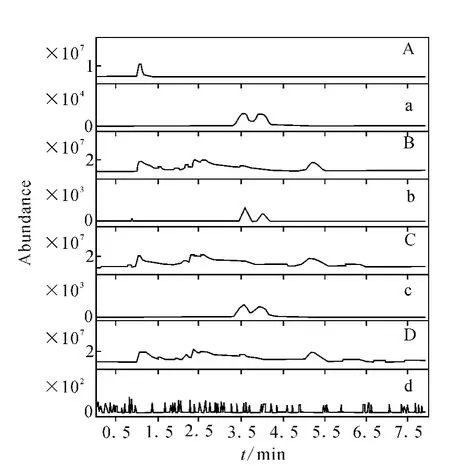
图6 UHPLC-Q-TOF/MS分析绿茶中茚虫威对映体的溶剂标准(A,a)、添加回收(B,b)、基质标准(C,c)和空白(D,d)色谱图Fig.6 The solvent standard(A,a),green tea spiked(B,b),matrix standard(C,c),blank sample(D,d)chromatogram of indoxacarb enantiomers by UHPLC-Q-TOF/MS
3 结论
本研究建立了茶叶中手性农药茚虫威对映体残留的UHPLC-Q-TOF检测方法,该方法快速、定性准确度高、检测限低,能够满足未来茶叶中茚虫威农药手性对映体残留检测筛查的需要,为进一步研究茚虫威手性对映异构体在茶叶中的选择性降解迁移规律提供了分析方法。
[1]陈宗懋.我国茶产业质量安全和环境安全问题研究[J].农产品质量与安全,2011,3:5-7.
[2]WILLIAMS A.Opportunities for chiral agrochemical[J].Pesticide Science,1996,46:3-9.
[3]彭 萍,王晓庆,林 强,等.15%茚虫威防治茶假眼小绿叶蝉田间药效试验[J].茶叶通讯,2010,37(1):27-28.
[4]MCCANN S F,ANNIS G D,SHAPIRO R,et al.The discovery of indoxacarb:oxadiazines as a new class of pyrazoline-type insecticides[J].Pesticide Management Science,2001,57:153-164.
[5]CHEN L,DONG F S,LIU X G,et al.Determination of indoxacarb enantiomer residues in vegetables,fruits,and soil by high-performance liquid chromatography[J].Journal of AOAC International,2010,93(3):1 007-1 012.
[6]刘一平,李晓刚,胡昌弟,等.茚虫威对映体分离及手性拆分热力学研究[J].分析测试学报,2010,29(12):1 130-1 134.
[7]丁 宁,孟庆伟,赵伟杰,等.噁二嗪类杀虫剂茚虫威的研究[J].农药学学报,2005,7(2):97-103.
[8]中华人民共和国秦皇岛出入境检验检疫局.GB/T 23204—2008 茶叶中519种农药及相关化学品残留量的测定 气相色谱-质谱法[S].北京:中国标准出版社,2009.
[9]中华人民共和国秦皇岛出入境检验检疫局.GB/T 23205—2008 茶叶中448种农药及相关化学品残留量的测定 液相色谱-串联质谱法[S].北京:中国标准出版社,2009.
[10]徐 娟,陈 捷,叶弘毅,等.QuEChERS提取与高效液相色谱电喷雾电离串联质谱联用法检测茶叶中的19种农药残留[J].分析测试学报,2011,30(9):990-995.
[11]中华人民共和国福建出入境检验检疫局.SN/T 1971-2007 进出口食品中茚虫威残留量的检测方法 气相色谱法和液相色谱-质谱/质谱法[S].北京:中国标准出版社,2008.
[12]张新忠,罗逢健,陈宗懋,等.超高效液相色谱串联质谱法测定茶叶、茶汤和土壤中氟环唑、茚虫威和苯醚甲环唑残留[J].分析化学,已接收.
[13]YU S,XU X M.Study of matrix-induced effects in multi-residue determination of pesticides by online gel permeation chromatography-gas chromatography/mass spectrometry[J].Rapid Communications in Mass Spectrometry,2012,26,963-977.
[14]CHEN G Q,CAO P Y,LIU R J.A multi-residue method for fast determination of pesticides in tea by ultra-performance liquid chromatographyelectrospray tandem mass spectrometry combined with modified QuEChERS sample preparation procedure[J].Food Chemistry,2011,125(4):1 406-1 411.
Enantioseparation and Quantification of Chiral Pesticide Indoxacarb Residues in Tea by UHPLC-Q-TOF/MS
ZHANG Xin-zhong1,2,LUO Feng-jian1,2,CHEN Zong-mao1,2,LU Mei-ling3
(1.Research Center of Quality Safety for Agricultural Products,Tea Research Institute,Chinese Academy of Agricultural Sciences,Hangzhou310008,China;2.Tea Product Quality and Safety Risk Assessment Laboratory,Ministry of Agriculture,Hangzhou310008,China;3.Agilent Technologies,Inc.,Beijing100102,China)
In order to meet the need of enantioseparation and quantification of chiral pesticide indoxacarb residue determination in tea,an effective reversed phase chiral analytical method was developed for the resolution and determination of indoxacarb enantiomers in tea by ultra-high pressure liquid chromatography-quadrupole-time of flight mass spectrometry(UHPLC-Q-TOF/MS).Indoxacarb enantiomers were extracted by acetonitrile followed byFlorisil and GCB mix-column cleanup from tea,then separated on a Lux 3μCellulose-1column withV(0.10%formic acid)∶V(methanol)=15∶85as the mobile phases at 0.40 mL/min.Over the concentrations in the range of 0.002 5—0.600mg/L for both of indoxacarb enabtiomers,the correlation coefficients(r)of the calibration curves are 0.997 3and 0.993 1for each other,and the estimated limits of detection(LODs)are 0.001mg/L.The average recoveries of two indoxacarb enantiomers in green tea at three spiked concentration levels(0.01,0.10and 1.00mg/kg)range from 80.75%to 101.69%with relative standard deviations(RSDs)lower than 15% (n=6).The limits of quantitation(LOQs)of two indoxacarb enabtiomers are 0.002 5mg/kg in green tea.The result shows that this method is reliable,accurate and suitable for the residue determination of indoxacarb enantiomers in tea.
tea;indoxacarb;chiral pesticide;enantioseparation;residue;ultra-high pressure liquid chromatography-quadrupole-time of flight mass spectrometry(UHPLC-Q-TOF/MS)
O657.63
A
1004-2997(2012)06-0321-06
2012-08-08;
2012-10-16
国家茶叶产业技术体系项目(CARS-23)、国家自然科学青年基金项目(21107137)、安捷伦公司合作项目资助
张新忠(1982~),男(土家族),湖南张家界人,博士,副研究员,从事农药残留色谱质谱联用分析研究。
E-mail:zxz.1982@163.com
陈宗懋(1933~),男,浙江海盐人,中国工程院院士,从事食品安全与化学生态学研究。E-mail:chenzm@mail.tricaas.com

