CD146与Ki67在葡萄胎组织中的表达及临床意义
徐本群 周 琼 邢益祥 陈 翀
1.安徽省肥西县人民医院妇产科,安徽肥西 231200;2.艾迪康医学检验中心,安徽合肥 230022;3.合肥市病理学实验室,安徽合肥 230022;4.徐州医学院附属医院内科,江苏徐州 221002
葡萄胎(hydratidiform mole,HM)作为育龄期妇女最常见的妊娠滋养层疾病(gestational trophoblastic disease,GTD),以滋养层细胞增生和胎盘绒毛过度生长为特征。组织病理学上分为部分性HM和完全性HM,二者均有一定恶变或侵蚀转移的潜在风险,但恶变机率有差异,病理诊断的难点主要集中于水肿性流产与部分性HM或完全性HM的鉴别诊断。早期完全性HM常常被误诊为流产性绒毛水肿或正常妊娠[1-2]。针对HM宫内组织的病理切片开展相关免疫学检测,有助于早期识别、辅助确诊及预后判断[3]。
近期研究发现,CD146蛋白的表达牵涉多种肿瘤细胞的发生、发展与迁移分化[4];Ki67作为一种增殖细胞相关的核抗原,可以作为一种评估恶性肿瘤治疗及预后的分子靶标[5-7]。本研究拟采用免疫组织化学技术检测CD146与Ki67在葡萄胎组织与正常早孕人工流产组织中的表达,探讨CD146与Ki67在GTD发生、发展中的作用,期望为HM病变的早期鉴别诊断提供新靶标。
1 资料与方法
1.1 一般资料
选取2011年1~12月36例手术前B超检查诊断为葡萄胎的育龄期女性,另选取正常早孕人工流产患者18例(对照组);各组患者刮宫手术前的年龄、放射免疫法测定血清β-人类绒毛膜促性腺激素(β-HCG)(>5 IU/L视为阳性)比较,差异无统计学差异(P>0.05)。手术后病理诊断由安徽省合肥艾迪康临床检验所病理实验室进行,收集相应病变组织标本存档蜡块(完全性葡萄胎21例,部分性葡萄胎15例,正常早孕人工流产组织18例)。见表1。

表1 患者年龄及血清β-HCG检测比较
1.2 方法
1.2.1 免疫组织化学方法 所有组织均用10%甲醛固定,石蜡包埋组织作4 μm厚连续切片,免疫组化采用SP法。所用试剂兔抗人CD146(编号ZM0166)及Ki67(编号ZM0046)多克隆抗体,SP试剂盒均购自北京中杉金桥生物技术有限公司,免疫组化染色程序遵照SP试剂盒操作说明进行,根据说明书对抗原进行修复。
1.2.2 结果判定 用0.1 M PBS代替一抗作阴性对照,采用生物公司提供的阳性切片作为阳性对照。免疫组化根据阳性细胞所占比例及染色强度计分。染色强度:未着色或与背景一致浅棕色为0分;浅着色1分;中度着色为2分;深度着色为3分;阳性细胞百分数:高倍镜下随机选取不重复的10个视野,每个视野计数10个细胞,取平均值作为阳性细胞百分数,阳性细胞<5%为0分;5%~25%为1分;26%~50%为2分;>50%为3分。根据这两项指标的积分数分为4级,即阴性(-):0分;弱阳性(+):1~2分;中度阳性(++):3~4分;强阳性(+++):5~ 6分[8]。
1.3 术后随访
对确诊为葡萄胎的患者进行定期门诊随访,行B超检查及抽检血清β-HCG水平,观察预后。
1.4 统计学处理
采用SPSS13.0软件包对数据进行统计学处理,计数资料采用卡方检验或四格表精确概率法检验,双向有序列联表资料采用CMH法作相关分析,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 CD146、Ki67在不同葡萄胎组织中的表达
CD146主要位于细胞膜上,以细胞膜和(或)细胞浆中呈棕黄色颗粒(为阳性细胞),在正常组织中呈阴性或弱阳性表达,在HM组织中根据其病变分类的不同,其表达存在明显差异。见图 1-A1、B1、C1。
Ki67主要定位于鳞状上皮细胞胞质,在组织中,阳性细胞呈片状、灶状或散在分布,在正常组织中呈阴性或弱阳性表达,在HM中根据其病变分类的不同,Ki67的表达也存在明显差异。见图 1-A2、B2、C2。
2.2 CD146 及Ki67在不同HM病变组织中的表达及阳性率分析
CD146在完全性HM病变组织中的表达,中度阳性率为95%(20/21),弱阳性率为5 % (1/21);CD146在部分性HM病变组织中的表达,中度阳性表达率为13%(2/15),弱阳性表达率为87%(13/15);而正常人工流产组织中阴性占89%(16/18),弱阳性仅为11%(2/18);CD146在完全性HM组织中的表达明显高于部分性HM,差异具有统计学意义(P<0.05)。见表2。
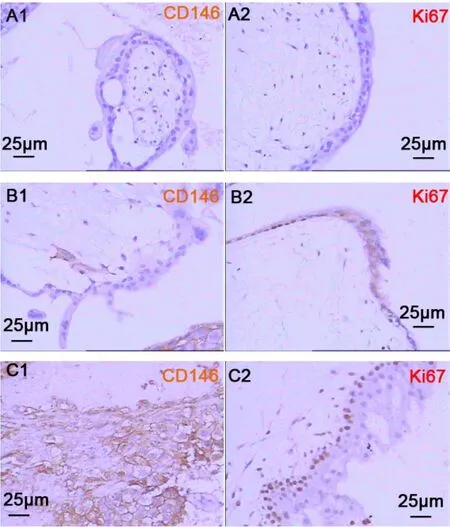
图1 CD146/Ki67在刮宫组织中的表达
Ki67在完全性HM病变组织中的表达率阴性为0,弱阳性为 10%(2/21),中度阳性为 90%(19/21),强阳性为 0;Ki67在完全性HM组织中的表达明显高于部分性HM,部分性HM病变组织中阳性的表达率为7% (1/15),二者差异具有统计学意义(P<0.05)。见表2。
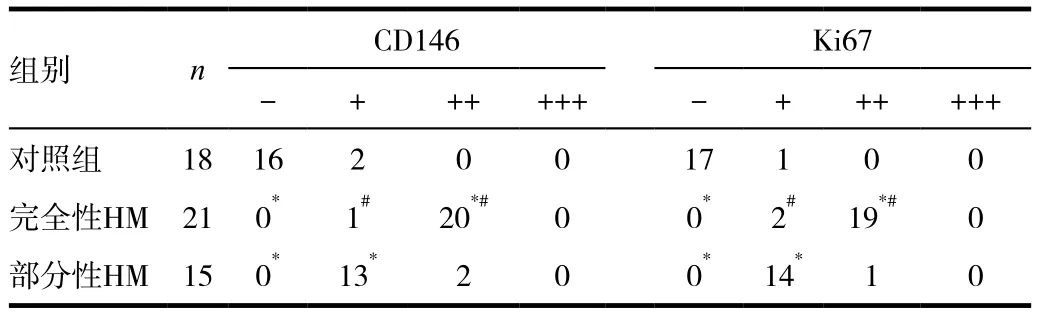
表2 CD146及Ki67在刮宫组织中的表达情况分析(n)
2.3 预后随访结果分析
对患者进行术后随访的结果提示,正常人流后两周血清β-HCG水平迅速降低,1个月时均已正常(<5 IU/L);部分性HM组15例患者术后1个月时血清β-HCG测定未见异常(继续门诊随访);完全性HM组出现1例患者β-HCG术后测定值持续不降:术后2周为5 800 IU/L,术后1个月高达20 000 IU/L,B超提示子宫体增大、宫腔内似有清宫残留;在全身静脉麻醉及超声引导下再次行诊断性刮宫术,并对刮宫组织行常规病理切片及CD146及Ki67免疫组化染色分析,提示CD146及Ki67强阳性(图2),病理诊断为葡萄胎复发、侵蚀子宫壁组织;经患者知情同意,建议术后接受标准联合方案(氟尿嘧啶+更生霉素)化疗,随访1年以来已达到临床治愈标准(已建议继续避孕、每隔4个月门诊定期检查,再续访1年)。
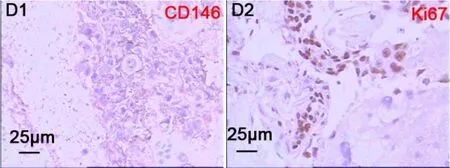
图2 CD146及Ki67在完全性HM复发患者诊断性刮宫组织中的表达(棕色为DAB显色后的免疫阳性表达产物,蓝色为HE染色复染后的细胞核)
3 讨论
HM、侵蚀性HM和绒毛膜癌都是由胚胎滋养细胞变化而来的肿瘤,故统称为滋养细胞肿瘤。预后方面,HM虽属良性疾病,但具有发展为侵袭性滋养细胞病变(侵袭性葡萄胎和绒毛膜上皮癌)的危险性;完全性葡萄胎(15%~20%)比部分性葡萄胎(4%)更容易进展为侵袭性GTD;因此,鉴别HM(与非葡萄胎水肿性流产相鉴别)及对其进行准确分型均具有重要的临床意义[1-2]。
早期形态学鉴别完全性HM、部分性HM和非HM性绒毛水肿缺乏准确性。绒毛膜促性腺激素(HCG)虽能为诊断、疗效评定、随访及预后判断提供帮助,但临床上常在HM排出后B超检查提示子宫增大、血或HCG定量升高或发生侵蚀转移时才出现相应的症状,故HCG不利于早期预警的识别[9]。组织学上对充分发育的完全性HM的诊断基本可靠,但早期完全性HM常常被临床和病理医师误诊为流产性绒毛水肿或正常妊娠。临床实践中,部分性葡萄胎的低诊断和过诊断现象更时有发生[10]。此外,HM过诊断会给患者带来不必要的精神负担和医疗上的不良后果:一旦被诊断为HM,患者即被纳入相关监测和随访计划,这会使患者不得不面临随着年龄的增长、受孕概率降低的困境[11]。因此,借助一些分子标志物来辅助诊断、早期确诊HM分型及预警识别宫内滋养层肿瘤细胞的不良生物学行为发展趋势,是提高HM治愈率的关键[12]。
CD146是一种参与血管生成过程的Ⅰ型膜糖蛋白。最新研究证明,该分子在新生血管中选择性高表达,CD146抗体已成为多种肿瘤组织血管生成和肿瘤细胞转移等方面预警识别的标记分子;Ki67是一种增殖细胞相关的核抗原,其可以作为一种评估恶性肿瘤治疗及预后的分子靶标;有研究[4,7,12,13]提示,CD146/Ki67的表达与HM病程的发生发展有着密切的关系。本研究结果表明,CD146与Ki67在完全性HM组织中的表达明显高于部分性HM;并且术后复发时二者表达强度更显著提高。因此,本研究采用免疫组化技术分析不同类型HM宫内组织中CD146与Ki67的表达情况,能为HM病变分型的早期鉴别诊断及预后判断提供较确信的辅助诊断依据。
综上所述,育龄期妇女若出现停经或不规则阴道流血等症状,都应警惕滋养细胞肿瘤的可能性。早期超声影像学检查或血清β-HCG检测仍缺乏典型诊断依据时,病理检查尤为重要;对诊刮物进行CD146与Ki67表达的筛查,辅助鉴别诊断意义明确,且价格低廉、简便易行,便于推广与常规应用。
[1] 宋鸿钊,杨秀玉,向阳.滋养细胞肿瘤的诊断和治疗[M].第2版.北京:人民卫生出版社,2004:89-92.
[2] Vang R,Gupta M,Wu LS,et al.Diagnostic reproducibility of hydatidiform moles:ancillary techniques(p57 immunohistochemistry and molecular genotyping)improve morphologic diagnosis[J].Am J Surg Pathol,2012,36(3):443-453.
[3] 章沙沙,万小云,周彩云,等.LMP2和PPM1A在妊娠滋养细胞疾病组织中的表达及其意义[J].中华妇产科杂志,2011(46):510-515.
[4] Kaspi E,Chabaud M,George F,et al.Soluble CD146 and APS:a potential biomarker of obstetrical complications?[J].Lupus,2012,21(7):779-780.
[5] Tanei T,Shimomura A,Shimazu K,et al.Prognostic significance of Ki67 index after neoadjuvant chemotherapy in breast cancer[J].Eur J Surg Oncol,2011,37(2):155-161.
[6] Mak VC,Lee L,Siu MK,et al.Downregulation of ASPP1 in gestational trophoblastic disease:correlation with hypermethylation,apoptotic activity and clinical outcome [J].Mod Pathol,2011,24(4):522-532.
[7] Makovitzky J,Radtke A,Shabani N,et al.Invasive hydatidiform mole:immunohistochemical labelling of inhibin/activin subunits,Ki67,p53 and glycodelin A in a rare case[J].Acta Histochem,2009,111(4):360-365.
[8] 徐雅会,王德华,齐广涛.CD147和MMP2在宫颈癌组织中的表达和意义[J].天津医药,2010,38(4):288-290,353.
[9] Cheung AN,Chan KK.Perplexing hCG profile after evacuation of hydatidiform mole [J].Lancet,2012,379(9811):98-100.
[10] Olsen TG,Hubert PR,Nycum LR.Falsely elevated human chorionic gonadotropin leading to unnecessary therapy[J].Obstet Gynecol,2001,98(5 Pt 1):843-845.
[11] Butler SA,Cole LA.Falsely elevated human chorionic gonadotropin leading to unnecessary therapy[J].Obstet Gynecol,2002,99(3):516-517.
[12] Agarwal R,Teoh S,Short D,et al.Chemotherapy and human chorionic gonadotropin concentrations 6 months after uterine evacuation of molar pregnancy:a retrospective cohort study[J].Lancet,2012,379(9811):130-135.
[13] Liu Q,Yan X,Li Y,et al.Pre-eclampsia is associated with the failure of melanoma cell adhesion molecule(MCAM/CD146) expression by intermediate trophoblast[J].Lab Invest,2004,84(2):221-228.

