两种PARP-1抑制剂对羟基喜树碱诱导ECA-109细胞增殖及凋亡的影响
郑永仁 何晓山 王 礡 杨晓密
云南中医学院实验中心,云南昆明 650500
喜树碱(camptothecin,CPT)羟基喜树碱(hydroxy camptothecin,HCPT)是一种植物抗癌药物,在临床上已广泛用于食管癌、胃癌、肠癌、肝癌、肺癌等多种恶性肿瘤的治疗[1-5]。尽管HCPT对于多数肿瘤细胞均有杀伤作用,但其不良反应较多且严重,限制了它的临床应用。因此,探索其影响肿瘤作用的各种相关因素具有十分重要的意义。聚腺苷二磷酸核糖聚合酶[Poly(ADP-ribose)polymerase,PARP]是一种多功能核蛋白,广泛参与DNA损伤的识别和信号转导过程,尤其在DNA的碱基切除修复过程中发挥着无法替代的作用,是当今肿瘤基因治疗的一个新靶点[6]。抑制PARP活性能降低肿瘤细胞的DNA修复功能,从而提高肿瘤放疗和化疗疗效。研究表明,无论对于单一用药或联合化疗药物,PARP抑制剂都显示了在抗肿瘤治疗领域的潜力[7-8]。
NU1025和AG14361分别是第2代和第3代PARP抑制剂的代表,二者均能显著提高化疗药物的细胞毒性作用,即对肿瘤细胞产生很强的化学致敏效果[9-10]。本研究探讨了NU1025和AG14361与食管癌常用化疗药HCPT联用对食管癌细胞ECA-109的增殖与凋亡的影响,并通过彗星实验观察细胞DNA损伤水平的变化,以初步探讨二者与HCPT联用的可能机制,为食管癌的临床治疗提供基础理论依据。
1 材料与方法
1.1 细胞株和试剂
人食管癌细胞株ECA-109购买于中国科学院上海生命科学研究院细胞资源中心。胎牛血清、DMEM培养基为美国Gibco公司生产。HCPT购自深圳万乐药业有限公司(批号:0708G1,2mg/瓶)。NU1025(编 号:493800)和 AG14361(编号:S2178)分别为德国Merck公司和美国Selleck公司产品。Annexin V-FITC/PI细胞凋亡检测试剂盒由南京凯基生物科技发展有限公司提供。四甲基偶氮唑蓝(four methyl thiazolyl tetrazolium,MTT)产自美国Sigma-Aldrich公司。其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养 ECA-109细胞用DMEM培养液培养(含10%胎牛血清、链霉素和青霉素各100 U/mL)于37℃、5%CO2饱和湿度的培养箱中培养。每2天传代1次。
1.2.2 MTT试验 取对数生长期的ECA-109细胞,接种到96孔板(100 μL/孔,约3.0×103/孔),待细胞贴壁后进行实验处理。HCPT浓度参照本课题组预实验结果及国内其他文献报道,选用10 μmol/L。细胞随机分成两组,其中第1组采用以下方式处理:(1)对照组(不加任何处理);(2)1.0 μmol/L NU1025(或 AG14361)处理组;(3)5.0 μmol/L NU1025(或 AG14361)处理组;(4)5.0 μmol/L NU1025(或 AG14361)处理组。第 2 组采用以下方式处理:(1)对照组(不加任何处理);(2)10 μmol/L HCPT 处 理 组;(3)HCPT+1.0 μmol/L NU1025(或 AG14361)处理组;(4)HCPT+5.0 μmol/L NU1025或 AG14361处理组;(5)HCPT+5.0 μmol/L NU1025(或AG14361)处理组。每组设6个平行孔,24 h后,每孔加入6 mg/mL的MTT 20 μL,37℃继续孵育4 h,弃上清,加入150 μL二甲基亚砜溶解甲瓒结晶,后于酶标仪上测定570 nm处的吸光度OD值,计算细胞增值率。计算公式为:细胞增殖率=处理组OD值/对照组OD值×l00%。
1.2.3 流式细胞术检测细胞凋亡 取对数生长期的ECA-109细胞,以6×104个细胞接种于6孔培养板,待细胞贴壁后进行处理。细胞分组按1.2.2第2组,按相应方法处理ECA-109细胞24 h后收集细胞,制备成浓度为3.0×106/mL单细胞悬液,取80 μL细胞悬液,加入320 μL 1×Binding Buffer重悬细胞,分别加入5 μL Annexin V-FITC和10 μL PI混匀,室温避光孵育20 min后,由专业技术人员检测。
1.2.4 彗星实验检测细胞DNA损伤 选取对数生长期的ECA-109细胞,以3×104个细胞接种于6孔培养板,待细胞贴壁后进行实验处理。细胞分组按1.2.2第2组,按相应方法处理ECA-109细胞24 h后收集细胞,制备单细胞悬液,参照文献方法[11],经消化、解旋、电泳后,Gel-red核酸染料染色,荧光显微镜下观察细胞彗星形态,每个浓度制备3张片子,每张片子统计100个彗星样细胞,通过CASP彗星图像分析软件分别计算彗星图像的头部DNA百分率、尾部DNA百分率、尾矩和Olive尾矩,本研究以Olive尾矩作为本实验体系中评价细胞DNA损伤程度的指标。
1.3 统计学处理
应用SPSS13.0版软件包处理数据,计量资料用()的形式表示,行t检验,采用单因素方差分析比较各组间差异的显著性,P<0.05为差异有统计学意义。
2 结果
2.1 MTT实验结果
采用MTT法比较两种PARP抑制剂单独或联合HCPT对ECA-109细胞增值率的影响,见图1。ECA-109细胞被处理24 h后,除1.0 μmol/L NU1025处理组(P>0.05)外的所有NU1025和AG14361处理组细胞增殖率均显著低于对照组,差异有统计学意义(P<0.05);且5.0 μmol/L和10.0 μmol/L的NU1025对细胞增殖的抑制作用分别为5%和9%,明显小于5.0 μmol/L(10%)和10.0 μmol/L(17%)的AG14361对细胞增殖的抑制作用(P<0.05)。MTT法比较两种PARP抑制剂联合HCPT对细胞增值率的影响,见图2。
所有处理组(HCPT单独处理组、HCPT+NU1025处理组和HCPT+AG14361处理组)细胞增殖率均显著低于对照组,差异有统计学意义(P<0.05);且5.0 μmol/L和10.0 μmol/L PARP抑制剂联合HCPT处理组细胞增殖率明显低于HCPT单独处理组,差异有统计学意义(P<0.05);其中5.0 μmol/L和10.0 μmol/L NU1025联合HCPT处理对ECA-109细胞增殖的抑制作用分别为29%和45%,明显高于5.0 μmol/L(18%)和10.0 μmol/L(29%)的AG14361联合HCPT处理,差异有统计学意义(P<0.05)。
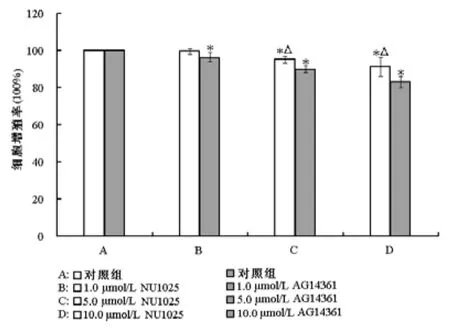
图1 MTT试验分析NU1025和AG14361处理24 h后ECA-109细胞增值率的变化。与对照组比较,*P<0.05;相同浓度下NU1025组与AG14361组比较,△P<0.05
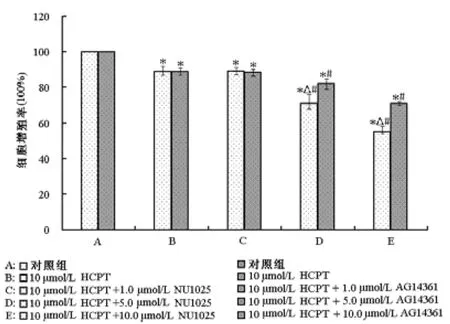
图2 MTT试验分析HCPT联合NU1025或AG14361处理24 h后ECA-109细胞凋亡率的变化。与对照组比较,*P<0.05;与对HCPT处理组比较,#P<0.05;相同浓度下NU1025组与AG14361组比较,△P<0.05
2.2 流式细胞术检测结果
通过流式细胞术Annexin V-FITC/PI双标法进一步分析了HCPT联合NU1025或AG14361对ECA-109细胞凋亡的影响,见图3。ECA-109细胞被处理24 h后,所有处理组(HCPT单独处理组、HCPT+NU1025处理组和HCPT+AG14361处理组)细胞凋亡率均显著高于对照组,差异有统计学意义(P<0.05);且5.0 μmol/L和10.0 μmol/L PARP抑制剂联合HCPT处理组细胞增殖率明显低于HCPT单独处理组,差异有统计学意义(P< 0.05);其中 5.0 μmol/L和 10.0 μmol/L NU1025联合HCPT分别诱导了32%和44%的ECA-109细胞凋亡,明显强于5.0 μmol/L(18%)和10.0 μmol/L(30%)的AG14361联合HCPT处理,差异有统计学意义(P<0.05)。
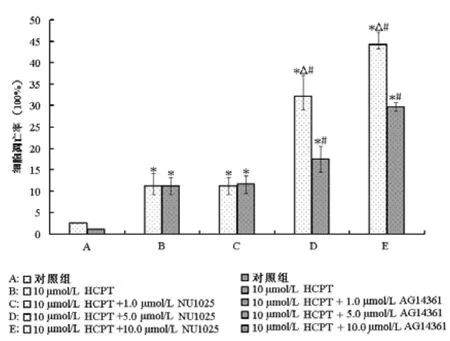
图3 流式细胞术分析HCPT联合NU1025或AG14361处理24 h后ECA-109细胞凋亡率的变化。与对照组比较,*P<0.05;与HCPT处理组比较,#P<0.05;相同浓度下NU1025组与AG14361组比较,△P<0.05
2.3 彗星实验检测结果
为明确NU1025和AG14361是通过何种方式起到增敏作用,通过彗星实验评价了HCPT联合NU1025或AG14361处理后ECA-109细胞DNA损伤程度的影响,见图4。ECA-109细胞被处理24 h后,所有处理组(HCPT单独处理组、HCPT+NU1025处理组和HCPT+AG14361处理组)细胞DNA损伤水平均显著高于对照组,差异有统计学意义(P<0.05);且5.0 μmol/L和10.0 μmol/L PARP抑制剂联合HCPT处理组细胞DNA损伤程度明显高于HCPT单独处理组,差异有统计学意义(P<0.05);其中5.0 μmol/L和10.0 μmol/L NU1025联合HCPT对细胞DNA损伤的诱导作用明显强于5.0 μmol/L和10.0 μmol/L的AG14361联合HCPT处理,前者分别为6.72和9.31,后者分别为5.34和6.91,前者相比与后者,差异有统计学意义(P<0.05)。
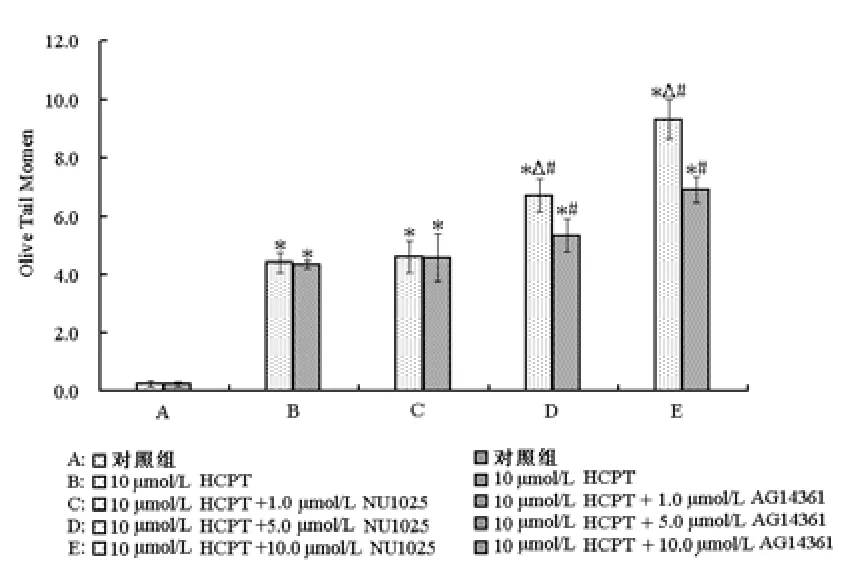
图4 彗星实验分析HCPT联合NU1025或AG14361处理24 h后的ECA-109细胞DNA损伤程度变化。与对照组比较,*P<0.05;与HCPT处理组比较,#P<0.05;相同浓度下NU1025组与AG14361组比较,△P<0.05
3 讨论
NU1025和AG14361均为新型PARP抑制剂,前者在低毒剂量时可使3-甲基吲哚诱导人支气管上皮细胞(NHBE)DNA损伤水平增加1倍,后者在低毒剂量时则可使拓扑替康诱导的人白血病细胞(K562) 凋亡水平上升3倍以上[11-12]。尽管如此,由于不同PARP抑制剂的选择性不同,在不同细胞株或与不同化疗药物(或放疗)联用时表现出的增敏效果也有所不同,因此,在不同实验体系中的具体应用仍需深入研究。
本研究以人食管癌细胞株ECA-109作为研究对象,探讨NU1025和AG14361对HCPT诱导的细胞增殖和凋亡的影响。研究结果表明,NU1025和AG14361在单独使用时,对ECA-109细胞增殖均起到了一定的抑制作用,且前者表现出较低的细胞毒性;但当NU1025和AG14361分别与HCPT联用时,和AG14361相比,NU1025表现出了更强的增敏作用[13]。通过流式细胞术凋亡分析实验证实NU1025和AG14361分别与HCPT联用时,NU1025表现出了更强的增敏作用。研究结果表明,NU1025和AG14361分别与HCPT联用时,在5.0~10.0 μmol/L时,二者均明显加重了HCPT诱导的ECA-109细胞DNA损伤效应,相比于AG14361,NU1025对HCPT诱导的ECA-109细胞DNA损伤效应表现出了更强的促进作用。因此,结合MTT和细胞凋亡研究结果,说明在本研究体系中,NU1025和AG14361通过抑制PARP-1的活性,阻碍了PARP-1对HCPT诱导的DNA损伤的修复作用,进而促进了细胞凋亡,降低了细胞增值率,且NU1025表现出了更强的作用,相关分子机制有待进一步研究。
综上所述,本研究结果表明,在5.0~10.0 μmol/L时浓度范围内的NU1025和AG14361均可显著增强人食管癌细胞株ECA-109对HCPT的药敏作用,且NU1025较AG14361具有更低的细胞毒性和更高的增敏作用的优势,为今后食管癌的药物治疗研究提供了一个可能的治疗靶点[14-15]。
[1] 金学平,金学兰.天然抗肿瘤药物羟基喜树碱的制备方法研究概况[J].中国药业,2006,15(19):63-64.
[2] S.P.Tu,J.Zhong,J.H.Tan,et al.Induction of apoptosis by arsenic trioxide and hydroxy camptothecin in gastriccancer cells in vitro[J].World J Gastroenterol,2000,6(4):532-539.
[3] Y.R.Fu,Z.J.Yi,Y.R.Yan,et al.Hydroxycamptothecin-induced apoptosis in hepatoma SMMC-7721 cells and the role of mitochondrial pathway[J].Mitochondrion,2006,6(4):211-217.
[4] 朱霞,李红,杨峰.羟基喜树碱治疗晚期乳腺癌疗效观察[J].中国肿瘤,2004,13(1):57-59.
[5] 荆孝东,赵积晔,李猛.羟基喜树碱膀胱灌注预防膀胱癌术后复发的疗效分析 [J].临床外科杂志,2010,18(2):131-132.
[6] 韩炜,钟俊,王永峰,等.PARP抑制剂用于肿瘤治疗的研究进展[J].中国新药杂志,2011,20(12):1086-1092.
[7] A.Peralta-Leal,J.M.Rodriguez-Vargas,R.Aguilar-Quesada,et al.PARP inhibitors:new partners in the therapy of cancer and inflammatory diseases[J].Free Radic Biol Med,2009,47(1):13-26.
[8] A.J.Chalmers.The potential role and application of PARP inhibitors in cancer treatment[J].Br Med Bull,2009(89):23-40.
[9] S.Boulton,L.C.Pemberton,J.K.Porteous,et al.Potentiation of temozolomideinduced cytotoxicity:a comparative study of the biological effects of poly(ADP-ribose) polymerase inhibitors[J].Br J Cancer,1995,72(4):849-856.
[10] C.R.Calabrese,R.Almassy,S.Barton,et al.Anticancer chemosensitization and radiosensitization by the novel poly(ADP-ribose)polymerase-1 inhibitor AG14361 [J].J Natl Cancer Inst,2004,96(1):56-67.
[11] L.A.Corcuera,L.Arbillaga,A.Vettorazzi,et al.Ochratoxin a reduces aflatoxin B1 induced DNA damage detected by the comet assay in Hep G2 cells[J].Food Chem Toxicol,2011,49(11):2883-2889.
[12] 赵凌舟,张华北.抗肿瘤药物PARP-1抑制剂及其放射性核素标记的研究进展 [J].同位素,2011,24(S1):45-58.
[13] 李思远.吡柔比星与羟基喜树碱治疗浅表性膀胱癌术后的短期疗效对比[J].中外医学研究,2011,9(15):20-21.
[14] 聂先锋.羟基喜树碱治疗难治复发性阵发性睡眠性血红蛋白尿症的临床分析 [J].中国医学创新,2011,8(7):32-33.
[15] 张徐龙,李海燕.羟基喜树碱膀胱灌注防治膀胱癌术后复发的疗效分析[J].中外医学研究,2010,8(18):373-374.

