广东省宠物源伪中间型葡萄球菌的耐药性调查研究
冯言言,田 伟,罗倩怡,周颖泽,曾振灵,陈杖榴,刘健华
(华南农业大学兽医学院,广东广州510642)
广东省宠物源伪中间型葡萄球菌的耐药性调查研究
冯言言,田 伟,罗倩怡,周颖泽,曾振灵,陈杖榴,刘健华*
(华南农业大学兽医学院,广东广州510642)
为调查广东省宠物源伪中间型葡萄球菌(Staphylococcuspseudintermedius)的携带和耐药情况,从小动物临床采集皮肤、耳部和鼻腔等部位的样品,分离鉴定伪中间型葡萄球菌,并采用琼脂稀释法和纸片扩散法对伪中间型葡萄球菌进行抗菌药物敏感性检测,采用PCR方法检测mec A基因。结果表明,从898个样品中共分离到144株伪中间型葡萄球菌,检出率为16.0%,皮肤、耳部和鼻腔的伪中间型葡萄球菌检出率分别为20%(64/319)、17.8%(64/359)和7.5%(3/40)。抗菌药物敏感性检测和 mec A 基因检测结果显示有89株(61.8%)为耐甲氧西林伪中间型葡萄球菌(MRSP)。伪中间型葡萄球菌对氨苄西林、红霉素、阿奇霉素、克林霉素和四环素的耐药率均在80%以上,对利福平和阿米卡星的耐药率低于8%,对万古霉素、利奈唑胺、喹奴普汀/达福普汀和替考拉宁均敏感。大部分(>69%)MRSP对红霉素、克林霉素、泰乐菌素、阿奇霉素、复方新诺明、四环素、环丙沙星和恩诺沙星等抗菌药物表现耐药。本研究结果表明宠物源伪中间型葡萄球菌的耐药情况严重且MRSP的检出率高,应高度重视宠物源细菌耐药问题。
耐甲氧西林伪中间型葡萄球菌;耐药;伪中间型葡萄球菌;宠物
伪中间型葡萄球菌(Staphylococcuspseudintermedius,SP)是由 Devriese L A 等[1]发现并命名的一种新的凝固酶阳性葡萄球菌,能够引起犬、猫等动物感染和发病,如犬脓皮病、外耳道炎、伤口感染、尿道感染以及其他一些感染。近来来有人感染动物源伪中间型葡萄球菌的病例报道[2-3],表明伪中间型葡萄球菌是一种重要的动物传染性病原菌,并可能对公共健康造成一定威胁。
近年来,宠物源耐甲氧西林伪中间型葡萄球菌(MRSP)菌株的数量急剧增加,更为严重的是,MRSP对兽医临床上使用的多种抗菌药物表现耐药,逐渐成为累积多种不同抗菌药物耐药基因的“蓄水池”[4]。目前,国内已有关于猪源或宠物源耐甲氧西林金黄色葡萄球菌(MRSA)的耐药性调查[5-6],但还少见有宠物源 MRSP药物敏感性的研究[7]。本研究拟调查广东省宠物源伪中间葡萄球菌的携带率和药物敏感性,了解国内华南地区MRSP的发生情况,为指导小动物临床合理用药提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2007年11月至2009年10月,从广东省10家宠物医院采集健康或患病犬猫的耳部、皮肤、伤口、鼻腔、眼角、肛门、外阴以及泌尿道等样品。质控菌株金黄色葡萄球菌ATCC29213和ATCC25923均购自中国药品与生物制品检定所。
1.1.2 药品、培养基以及仪器 青霉素G、氨苄西林、头孢噻肟、头孢曲松、头孢唑啉、硫酸庆大霉素、硫酸阿米卡星、盐酸环丙沙星、氯霉素均为中国药品与生物制品检定所产品;恩诺沙星、四环素、氟苯尼考、红霉素、阿奇霉素、泰乐菌素、克林霉素、利福平、替米考星均为广州威佳生物有限公司产品;苯唑西林钠、泰妙菌素、沃尼妙林、万古霉素为广州翔博生物科技公司产品;复方新诺明(1.25/23.75μg)、利奈唑胺(30μg)、替考拉宁(30μg)、喹奴普汀/达福普汀(15μg)纸片均为英国Oxoid公司产品;MH琼脂、甘露醇高盐琼脂、BP琼脂、NaCl高盐肉汤、亚碲酸卵黄增菌液、过氧化氢、兔血浆均为青岛海博生物有限公司产品;溶葡萄球菌素为美国Sigma公司产品;蛋白酶K、Taq酶等均为宝生物工程(大连)有限公司产品;PCR仪为美国Eppendorf公司产品;电泳凝胶成像系统为美国Bio-Rad公司产品。
1.2 方法
1.2.1 细菌的分离鉴定 将采集的样品接种于75g/L NaCl高盐肉汤中于37℃恒温培养24 h~48 h,然后用接种环蘸取菌液划线于配置好的甘露醇高盐琼脂,37℃培养后,挑取疑似单菌落划线于含亚碲酸卵黄增菌液的BP平板上,37℃培养24 h~48 h后,挑取BP平板上带有黑色透明环的可疑菌落进行纯培养,然后进行革兰染色镜检、触酶试验和血浆凝固酶试验,筛选出疑似伪中间型葡萄球菌。
按照Vanderhaeghen W等[8]报道,制备细菌基因组DNA,贮存于-20℃备用。根据Bannoehr J等[9]报道的16 S rRNA基因和hsp60基因的引物合成和扩增条件,进行PCR扩增确定伪中间型葡萄球菌。
1.2.2 MRSP的确定 按照Jonas D 等[10]报道合成特异性引物扩增mec A基因(310 bp),并将阳性产物测序,ATCC29213作为阴性对照。按照美国临床实验室标准化委员会(CLSI)推荐的操作程序[11],采用琼脂稀释法检测伪中间型葡萄球菌对苯唑西林的敏感性。根据CLSI的判断标准,苯唑西林MIC≥4 mg/L或检测出mec A基因的菌株确定为MRSP。1.2.3 药敏试验 除复方新诺明、利奈唑胺、喹奴普汀/达福普汀和替考拉宁采用纸片扩散法检测药物敏感性外,其余抗菌药物均采用琼脂稀释法,两种方法均按照CLSI推荐的操作程序进行[11],质控菌株分别为ATCC25923和ATCC29213。药物敏感性结果判断按照CLSI标准进行[11]。
2 结果
2.1 伪中间型葡萄球菌的分离鉴定
共采集898个样品,样品经选择性培养,筛选出葡萄串状、触酶试验阳性和血浆凝固酶阳性的疑似伪中间型葡萄球菌,经16 S r RNA、hsp60基因扩增测序确定后,共获得144株伪中间型葡萄球菌,分离率为16.0%(144/898),其中在宠物犬和猫的分离率分别为19.6%(123/629)和7.8%(21/269)。样品数较多的皮肤、耳部和肛门的伪中间型葡萄球菌检出率分别为20%(64/319)、17.8%(64/359)和1.5%(2/132),其他部位的分离率分别为鼻腔7.5%(3/64)、嘴部21.1%(4/19)、伤口6.67%(1/15)、眼部42.9%(3/7)、尿道20%(1/5)和外阴100%(2/2)。含 mec A基因(图1)且苯唑西林MIC≥4μg/m L的伪中间型葡萄球菌有55株,mecA阳性但苯唑西林敏感的菌株有14株,20株菌mec A基因阴性但对苯唑西林耐药。因此,根据CLSI对MRSP的判断标准共检测到89株(61.8%)MRSP。患病宠物 MRSP携带率(54/88,61.4%)比健康宠物 MRSP携带率(35/62,56.5%)稍高,无显著差异(P>0.05)。伪中间型葡萄球菌的分离率见表1。
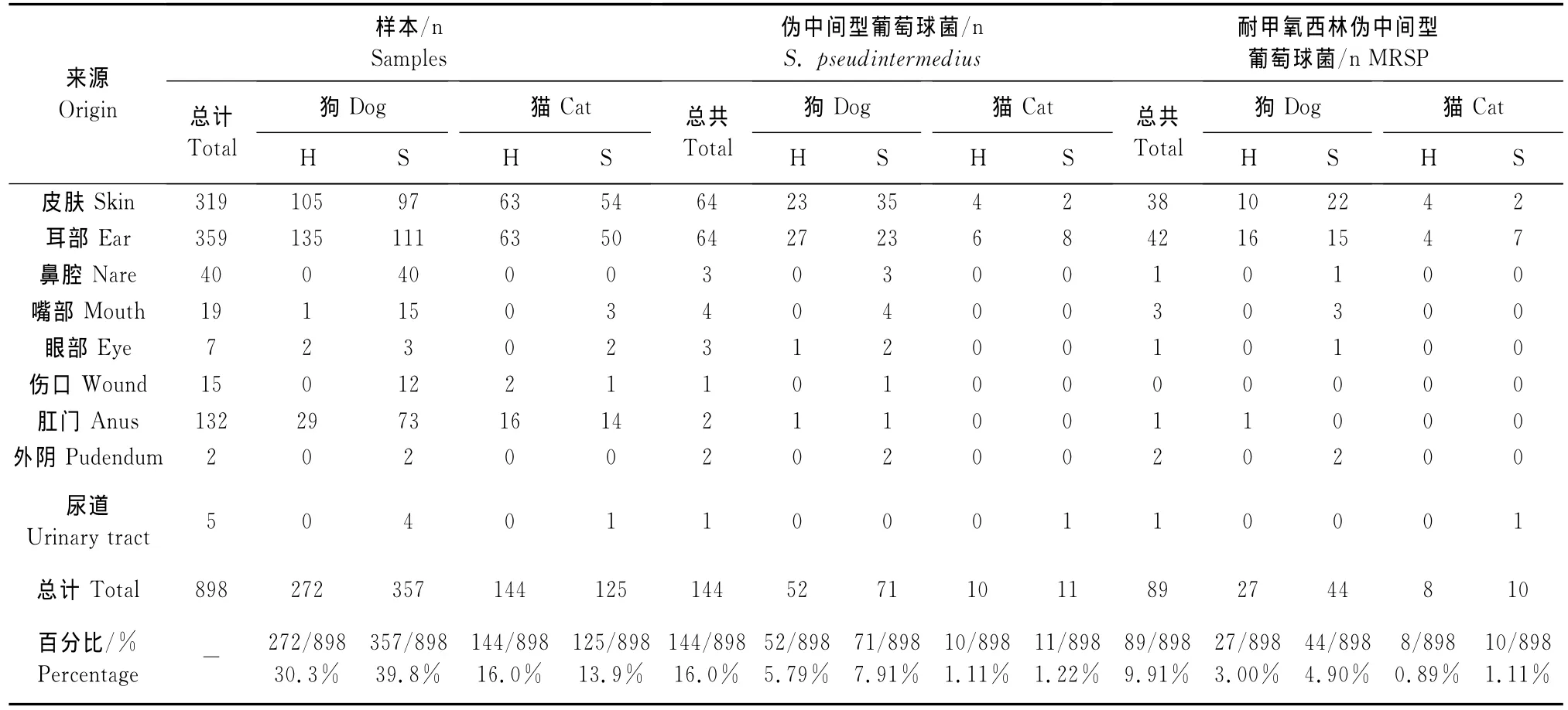
表1 伪中间型葡萄球菌和耐甲氧西林伪中间型葡萄球菌的来源Table 1 Origins of S.pseudintermedius and MRSP
2.2 药物敏感性试验
伪中间型葡萄球菌对氨苄西林、红霉素、阿奇霉素、克林霉素和四环素的耐药率均在80%以上,对利福平和阿米卡星的耐药率低于8%,对万古霉素、利奈唑胺、喹奴普汀-达福普汀和替考拉宁均敏感。大部分(>69%)MRSP对红霉素、泰乐菌素、克林霉素、阿奇霉素、复方新诺明、四环素、环丙沙星和恩诺沙星等抗菌药物表现耐药,且对青霉素、克林霉素、红霉素、复方新诺明和环丙沙星呈现多重耐药。MRSP对庆大霉素、替米考星、氟苯尼考和泰妙菌素呈现一般耐药,耐药率分别为25.8%、50.6%、18.0%和14.6%。除氯霉素和氟苯尼考外,MRSP对抗菌药物的耐药率均高于甲氧西林敏感的伪中间型葡萄球菌(MSSP)。
3 讨论
在当今社会,随着人们生活质量的提高,宠物的饲养率在不断提高,人类与宠物的亲密接触越来越频繁,这就使得动物源病原菌在动物与人类之间传播,导致严重的公共卫生问题。伪中间型葡萄球菌是重要的动物源病原菌之一,耐甲氧西林伪中间型葡萄球菌(MRSP)的多重耐药也为临床合理用药和治疗带来了极大困难。因此,MRSP引起了国内外的广泛关注。

图1 mec A基因电泳图Fig.1 Electrophoresis of mec A gene
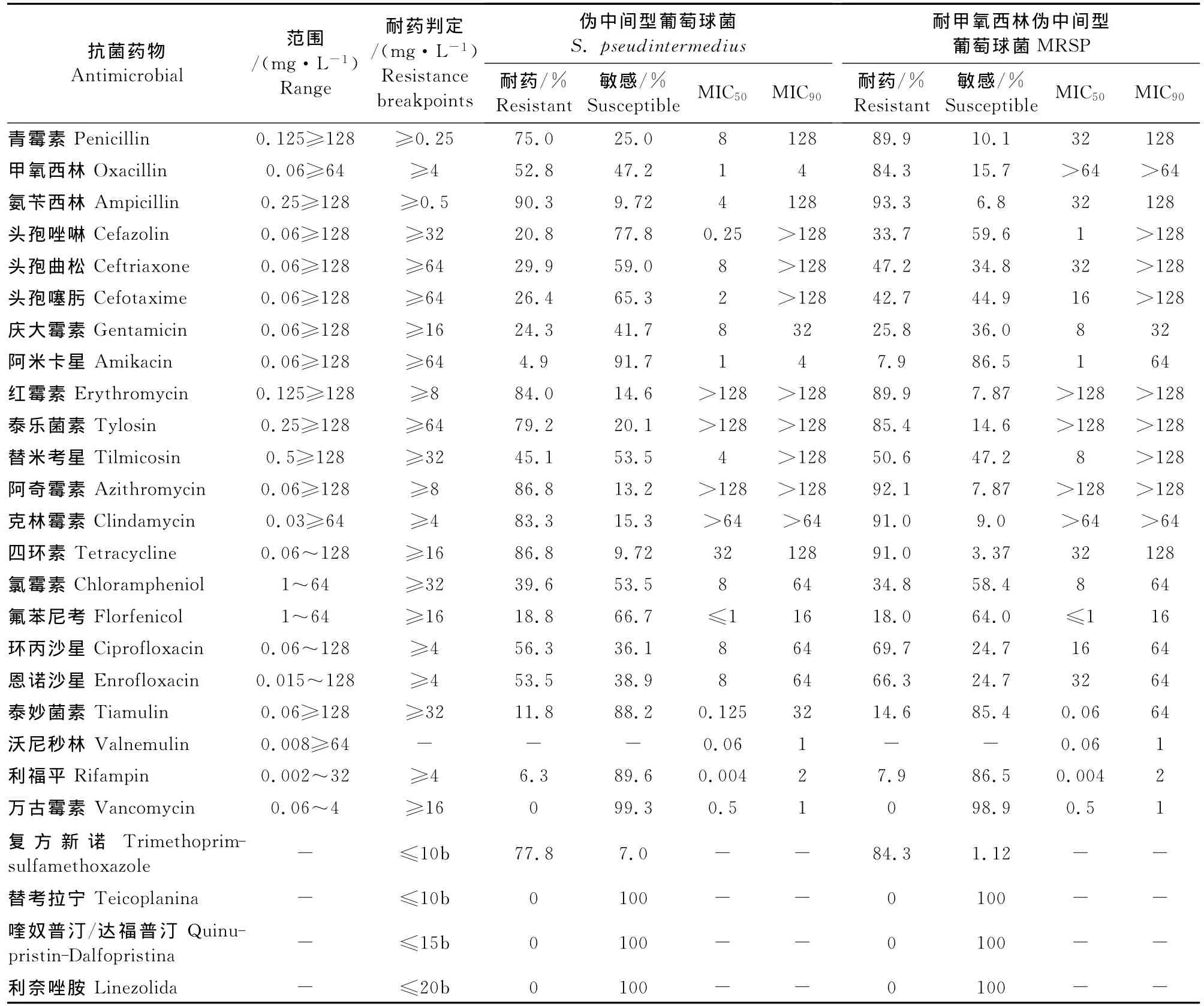
表2 伪中间型葡萄球菌的药物敏感性Table 2 The susceptibilities of antimicrobial agents against S.pseudintermedius isolates
本研究中,伪中间型葡萄球菌的分离率为16.0%(144/898),宠物犬分离率19.6%,高于猫的分离率7.8%,可以看出伪中间型葡萄球菌的宿主主要为宠物犬,这与国外的报道是一致的[12]。伪中间型葡萄球菌在皮肤、耳部和肛门的分离率分别为20%(64/319)、17.8%(64/359)和1.5%(2/132),即在皮肤、耳部的分离率较高,但是在肛门的分离率较低,这与国外的报道[13]略有差异。
由于抗生素的广泛使用,宠物MRSP的分离率增大[14]。本研究中 MRSP的分离率为9.91%(89/898),高于国外的报道[15],可能与国内小动临床抗菌药物的大量使用有关[16]。药敏试验结果表明,伪中间型葡萄球菌对氨苄西林、红霉素、阿奇霉素、克林霉素和四环素的耐药率均在80%以上,对利福平和阿米卡星的耐药率均低于8%。MRSP对青霉素、氨苄西林、红霉素、克林霉素、泰乐菌素、阿奇霉素、复方新诺明和四环素的耐药率均在80%以上,且呈现多重耐药,这与国外的报道是一致的[17-18]。幸运的是,本研究中未发现耐万古霉素、利奈唑胺、替考拉宁和喹奴普汀/达福普汀的MRSP。本研究中宿主宠物(犬和猫)在临床治疗中大多使用过广谱抗菌药物,因此在抗生素选择压力下更容易造成菌株耐药。可以推测,宠物临床治疗中大量抗生素的不规则使用增加了抗生素的选择压力,从而使宠物源细菌耐药情况更加严重。
据我们所知,本文首次报道了广东地区宠物源伪中间型葡萄球菌的耐药情况,可以看出宠物的耐药问题严重,应加强对宠物源细菌耐药性的监测以及对宠物临床用药的指导和监管,避免宠物源耐药菌向人类的传播。
[1] Devriese L A,Vancanneyt M,Baele M,et al.Staphylococcus pseudintermediussp.nov.,a coagulase-positive specieces from animals[J].Int J Syst Evol Microbiol,2005,55:1569-1573.
[2] Hoovels L V,Vankeerbergher A,Boel A,et al.First case ofStaphylococcuspseudintermediusinfection in a human[J].J Clin Microbiol,2006,44(12):4609-4612.
[3] Stegmann R,Burnens A,Maranta C A,et al.Human infection associated with methicillin-resistantStaphylococcus pseudintermediusST71[J].J Antimicrob Chemother,2010,65(9):2047-2048.
[4] Schwarz S,Kadlec K,Strommenger B.Methicillin-resistantStaphylococcusaureusandStaphylococcuspseudintermediusdetected in Bf T-Germ Vet monitoring programme 2004-2006 in Germany[J].J Antimicrob Chemother,2008,61:282-285.
[5] Cui S H,Li J Y ,Hui C Q,et al.Isolation and characterization of methicillin-resistantStaphylococcus aureusfrom swine and workers in China[J].J Antimicrob Chemother,2009,64:680-683.
[6] Zhang W Z,Hao Z H,Wang Y,et al.Molecular characterization of methicillin-resistantStaphylococcusaureusstrains from pet animals and veterinary staff in China[J].Vet Microbiol,2011;190:e125-e129.
[7] Wang Y,Yang J,Loque C M,et al.Methicillin-resistantStaphylococcuspseudintermediusisolated from canine pyoderma in North China[J].J Appl Microbiol,2012,doi:10.1111/j.1365-2672.2012.05233.x.
[8] Vanderhaeghen W,Cerpentier T,Adriaensen C,et al.Methicillin-resistantStaphylococcusaureus(MRSA)ST398 associated with clinical and subclinical mastitis in Belgian cows[J].Vet Microbiol,2010,144:166-171.
[9] Bannoehr J,Zakour N L B,Waller A S,et al.Population genetic structure of theStaphylococcusintermediusgroup:insights into agr diversification and the emergence of methicillinresistant strains[J].J Bacteriol,2007,189(23):8685-8692.
[10] Jonas D,Speck M,Daschner D,et al.Rapid PCR-based identification of methicillin-resistantStaphylococcusaureusfrom screening swabs[J].J Clin Microbiol 2002,40:1821-1823.
[11] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:twentieth informational supplement M100-S20[S].CLSI,Wayne,PA,USA,2010.
[12] Frank L A,Black C,Kania A,et al.Carriage of methicillinresistantStaphylococcuspseudintermediusin dogs[C].In:Abstracts of the First ASM/ESCMID Conference on Methicillin-Resistant Staphylococci in Animals:Veterinary and Public Health Implications,London,UK,2009.Abstract 24A.American Society for Microbiology,Washington,DC,USA.
[13] Devriese L A,De Pelsmaecker K.The anal region as a main carrier site ofStaphylococcusintermediusandStreptococcus canisin dogs[J].Vet Rec,1987,121:302–303.
[14] Sasaki T,Kikuchi K,Tanaka Y,et al.Methicillin-resistantStaphylococuspseudintermediusin a veterinary teaching hospital[J].J Clin Microbiol,2007,45:1118-1112
[15] Hanselman B A,Kruth S A,Rousseau J,et al.Coagulase positive staphylococcal colonization of humans and their household pets[J].Can Vet J,2009,50:954-958.
[16] Lei T,Tian W,He L,et al.Antimicrobial resistance inEscherichiacoliisolates from food animals,animal food products and companion animals in China [J].Vet Microbiol,2010,146:85-89.
[17] Perreten V,Kadlec K,Schwarz S,et al.Clonal spread of methicillin-resistantStaphylococcuspseudintermediusin Europe and North America:an international multicentre study[J].J Antimicrob Chemother,2010,65:1145-1154.
[18] Nienhoff U,Ladlec K,Chaberny I F,et al.Methicilin-resistantStaphylococcuspseudintermediusamong dogs admit-ted to a small animal hospital[J].Vet Microbiol,2011,150:191-197.
Antimicrobial Resistance ofStaphylococcuspseudintermediusIsolated from Pets in Guangdong Province
FENG Yan-yan,TIAN Wei,LUO Qian-yi,ZHOU Ying-ze,ZENG Zhen-ling,
CHEN Zhang-liu,LIU Jian-hua
(CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong,510642,China)
The purpose of this study was to investigate the carriage rate and antimicrobial resistance ofStaphylococcuspseudintermedius(SP)isolated from pets in Guangdong province.S.pseudintermediuswere isolated from samples collected from skin,ear,nasal cavity and other parts of pets.The antimicrobial susceptibility test was carried out by agar dilution method and disk diffusion method.PCR was carried out to detectmec Agene.A total of 144(16.0%)S.pseudintermediusstrains were obtained from the 898 samples collected from pets.The detection rates of skin,ear and nasal cavity were 20% (64/319),17.8%(64/359)and 7.5% (3/40),respectively.The antimicrobial susceptibility test results andmec Adetection result showed that 89(61.8%)were methicillin-resistantS.pseudintermedius(MRSP).Resistance rates of the 144S.pseudintermediusto ampicillin,erythromycin,azithromycin,clindamycin and tetracycline were over 80%.Resistance rates to amikacin and rifampicin was under 8%.All of the 144S.pseudintermediuswere susceptible to vancomycin,linezolid,quinupristin/dalfopristin and teicoplanin.Most(more than 69%)MRSP resisted to erythromycin,clindamycin,tylosin,azithromycin,trimethoprim-sulfamethoxazole,tetracycline,ciprofloxacin,and enrofloxacin.In conclusion,the high level antimicrobial resistance and high detection rate of MRSP was observed among theS.pseudintermediusisolates from companion animals.More attention should be addressed to the serious bacterial resistance in companion animals.
MRSP;antimicrobial resistance;Staphylococcuspseudintermedius
S852.611
A
1007-5038(2012)06-0006-05
2012-02-20
高等学校博士学科点专项科研基金项目(20104404110008)
冯言言(1986-),女,山东枣庄人,硕士研究生,主要从事兽医药理与毒理学研究。*通讯作者

