产蛋下降综合征病毒纤突蛋白Knob-S区原核表达及其活性分析
陈 滔,唐应华,陆吉虎,高 峰,于 漾,何家惠,黎满香,侯继波*
(1.湖南农业大学动物医学院,湖南长沙410128;2.江苏省农科院 国家兽用生物制品工程技术研究中心,江苏南京210014)
产蛋下降综合征病毒纤突蛋白Knob-S区原核表达及其活性分析
陈 滔1,2,唐应华2,陆吉虎2,高 峰1,2,于 漾2,何家惠2,黎满香1*,侯继波2*
(1.湖南农业大学动物医学院,湖南长沙410128;2.江苏省农科院 国家兽用生物制品工程技术研究中心,江苏南京210014)
通过PCR扩增得到产蛋下降综合征病毒(EDSV)纤突蛋白Knob-S区基因,将其克隆至原核表达载体p ET-32(a)的多克隆位点构建了原核表达载体p ET-32(a)-Knob-S,将其转化至感受态细胞 BL21中,经IPTG诱导,SDS-PAGE分析,结果获得了42 ku的融合蛋白,用纯化的融合蛋白免疫鸡制备抗血清,通过血凝试验、Western blot和血凝抑制试验分析,表明该融合蛋白不能凝集鸡红细胞,无血凝活性;但可与EDSV阳性血清发生特异反应,并诱导机体产生特异性抗体,具有很好的抗原性。
产蛋下降综合征病毒;原核表达;Knob-S区
减蛋综合征(Egg drop syndrome,EDS-76)是由腺病毒引起的一类以产蛋率下降,产软壳蛋为特征的急性传染病,分类上属于富AT腺病毒属(Atadenovirus)鸭腺病毒A型。由11种大小从14 ku到97 ku不等的蛋白组成[1],纤突蛋白位于病毒基因组的L5区,全长1 758 bp,编码585个氨基酸,有3个典型结构域[2],即tail(1~35)、shaft(36~436)、knob(437~585),而位于C末端的Knob区在病毒感染过程中起吸附宿主细胞的作用[3],tail区在空间上与五邻体基座紧密相连,EDSV的每个五邻体基座上只连接一个纤突蛋白[4]。
本试验通过对EDSV纤突蛋白Knob-S区及相邻shaft区34个氨基酸进行原核表达、纯化及抗原分析,并对纯化的Knob-S蛋白进行活性鉴定,用其作为抗原对动物进行免疫,检测诱导的抗体是否具有血凝作用,为研究产蛋下降综合征的诊断抗原和基因工程苗的候选蛋白奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒种、菌株和非免疫鸡 EDSV-127国际标准毒株;E.coli菌株 DH5α、BL21、pET-32a(+)由本实验室保存;6周龄非免鸡购自江苏某种鸡场。
1.1.2 试剂 质粒pMD18T、各种酶、DNA Marker、琼脂胶回收试剂盒、蛋白Marker等均为宝生物工程(大连)有限公司产品;抗鸡EDSV高免血清由本实验室保存;羊抗鸡酶标二抗为北京索莱宝科技有限公司产品;PVDF膜为联科生物有限公司产品;其余试剂均为国产或进口分析纯。
1.2 方法
1.2.1 目的基因的获得 引物设计与合成:根据文献报道[5]以及 NCBI(基因号 Z86065.1)上发表的EDSV-127纤突蛋白序列,设计一对引物用于扩增Knob-S区,于上下游引物分别加入BamHⅠ、HindⅢ酶切位点,下划线部分为酶切位点,上游引物:5′–TAAGGATCCATGTTGACTTTGGCTTATGATTCCAC–3′,下游引物:5′– CAGAAGCTTGCTACTGTGCTCCAACATATG –3′,扩增片段长708bp,引物由金斯瑞生物科技公司合成。
采用蛋白酶K消化法提取EDSV基因组DNA,并将其做为PCR扩增模版。PCR的循环参数为:94℃预变性5min;94℃45s,57℃45s,72℃45s,共30个循环;72℃10min,4℃结束反应。将PCR产物于10g/L的琼脂糖凝胶电泳进行检测。
1.2.2 重组表达载体的构建及鉴定 将PCR回收产物与pMD19-T载体进行连接,将连接产物加入制备的感受态细胞中用热休克法转化,构建重组克隆质粒。将上述转化的重组菌培养后,碱裂解法提取质粒,对提取的质粒采用PCR和酶切方法鉴定,鉴定正确的质粒送美吉测序部测序。序列正确的质粒和pET-32(a)同时用BamHⅠ、HindⅢ进行双酶切,构建重组表达载体,并命名为pET-32(a)-Knob-S。
1.2.3 外源蛋白于E.coliBL21中表达、纯化和抗血清的制备 将重组的E.coliBL21接种于LB液体培养基中,加入1mmol/L IPTG(异丙基-β-D-半乳糖苷)诱导表达,收集菌体超声破碎,取沉淀进行SDS-PAGE电泳,明确蛋白是否表达。优化表达条件,对重组细菌扩大培养,采用Ni2+离子亲和层析纯化重组蛋白。纯化后的融合蛋白制备成油包水疫苗免疫鸡,三免后采血制备血清备用。
1.2.4 重组蛋白与鸡红细胞的血凝试验 在96孔V形微量反应板中每孔加入PBS 25μL,左侧第一孔加入纯化蛋白25μL,依次倍比稀释至倒数第二孔,弃去25μL,加入10mL/L的鸡红细胞,室温放置30min,观察结果。
1.2.5 Western blot分析 将纯化的蛋白样品经100mL/L SDS-PAGE电泳后,采用半干转印法将蛋白转印到PVDF膜上,50g/L脱脂乳封闭过夜,然后加入以1∶100稀释的EDSV高免血清,二抗为HRP标记羊抗鸡IgG,孵育1h,DAB显色。
1.2.6 鸡抗Knob-S蛋白阳性血清与鸡红细胞的血凝抑制试验 根据EDSV的血凝价,配制4个血凝单位的病毒液。在96孔V形微量反应板中,每孔加入PBS 25μL,第1孔加入鸡抗Knob-S蛋白阳性血清25μL,依次倍比稀释至每10孔,弃去25 μL,加入4单位病毒至倒数第2孔,室温作用30 min,最后一孔补25μL PBS,加入10mL/L的红细胞,室温放置30min后,观察结果。
2 结果
2.1 目的基因的PCR扩增
利用设计的引物,通过PCR反应,扩增得到了708bp的目的片段,与预期的结果相符,电泳结果见图1。
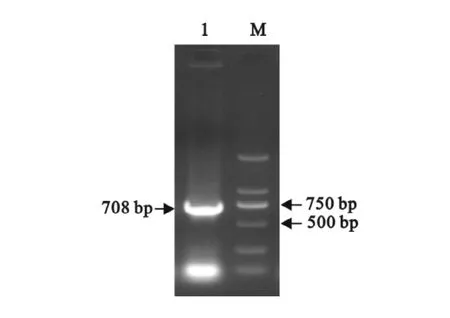
图1 EDSV纤突蛋白Knob-S基因的PCR产物电泳图Fig.1 Electrophoresis of PCR products of EDSV fiber Knob-S gene
2.2 重组质粒pET-32(a)-Knob-S的鉴定
重组质粒pET-32(a)-Knob-S经 PCR 和BamHⅠ、HindⅢ双酶切后,进行琼脂糖电泳,可见插入片段与目的大小相符,得到708bp和5 900bp的2个片段(图2和图3)。
2.3 重组蛋白表达分析和纯化
将诱导前和诱导后的重组表达菌BL21/pET-32(a)-Knob-S 进 行 SDS-PAGE 分析,结果显示,BL21/pET-32(a)-Knob-S在诱导后比诱导前多表达了分子质量约42ku的蛋白(图4),且该重组蛋白以包涵体的形式表达。
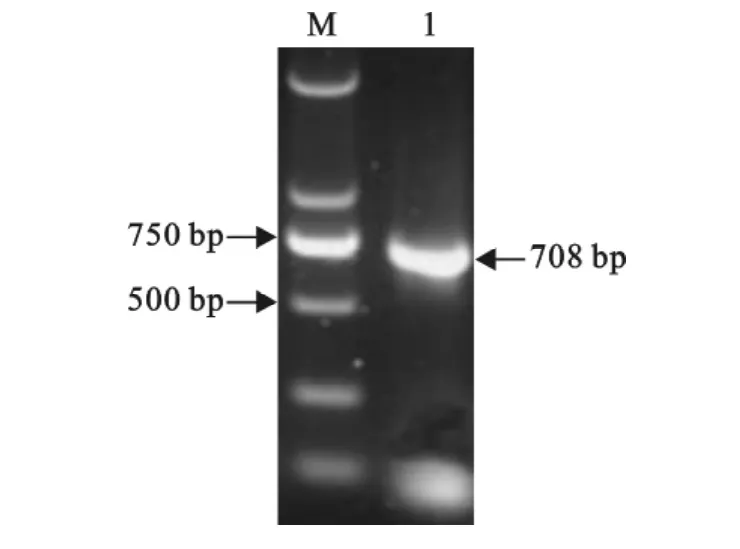
图2 重组质粒p ET-32(a)-Knob-S的PCR鉴定结果Fig.2 Identification result of recombinant plasmid p ET-32(a)-Knob-S by PCR
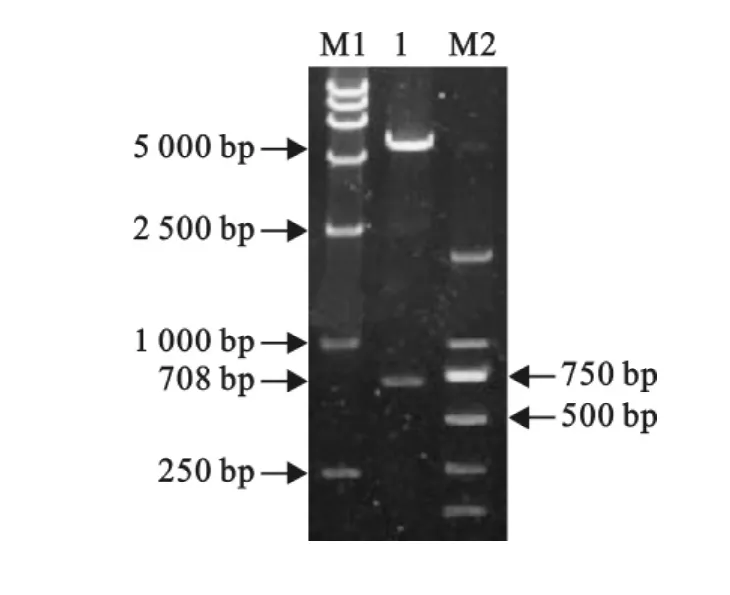
图3 重组质粒p ET-32(a)-Knob-S酶切鉴定Fig.3 Identification of recombinant plasmid pET-32(a)-Knob-S by enzyme digestion
2.4 重组Knob-S蛋白的活性分析
表达的重组Knob-S经纯化并复性后不能与鸡红细胞发生凝集,说明重组蛋白无血凝活性。利用全病毒免疫制备的高免血清与重组Knob-S蛋白进行Western blot分析,在42 ku处出现清晰的印迹带,而不与其他杂蛋白反应(图4),表明重组蛋白有很好的反应活性。将该重组蛋白制备成油包水苗后免疫鸡,三免后采血HI检测抗体效价为1∶512,说明重组蛋白免疫原性亦很好。
3 讨论
纤突蛋白是EDSV的主要结构蛋白之一,它与五邻体和六邻体一起构成病毒衣壳,决定病毒大小,五邻体蛋白在腺病毒的内化过程中起重要作用[6-7],六邻体主要是带有属和亚属的特异性抗原决定簇和次要的种特异性抗原决定簇,还与病毒的型特异性有关[8-9],国内外学者对这两种蛋白的表达研究较多,纤突蛋白的Knob区不但可识别宿主细胞受体而且能增强病毒的吸附,若病毒的Knob区遭到破坏,即可阻止病毒的感染[5-10],因而,用 EDSV 纤突蛋白Knob-S区作为免疫原,研究其诱导机体产生有效抗体来阻止病毒感染是可行的。为保证Knob区构象的正确性所以加入了邻近shaft区的34个氨基酸。本试验通过PCR方法扩增EDSV AV-127国际标准株Knob-S区基因,构建了原核表达载体p ET-32a-Knob-S,在大肠埃希菌中实 现了 高效表达,通过血凝试验、Western blot和血凝抑制试验对其抗原性进行了分析。
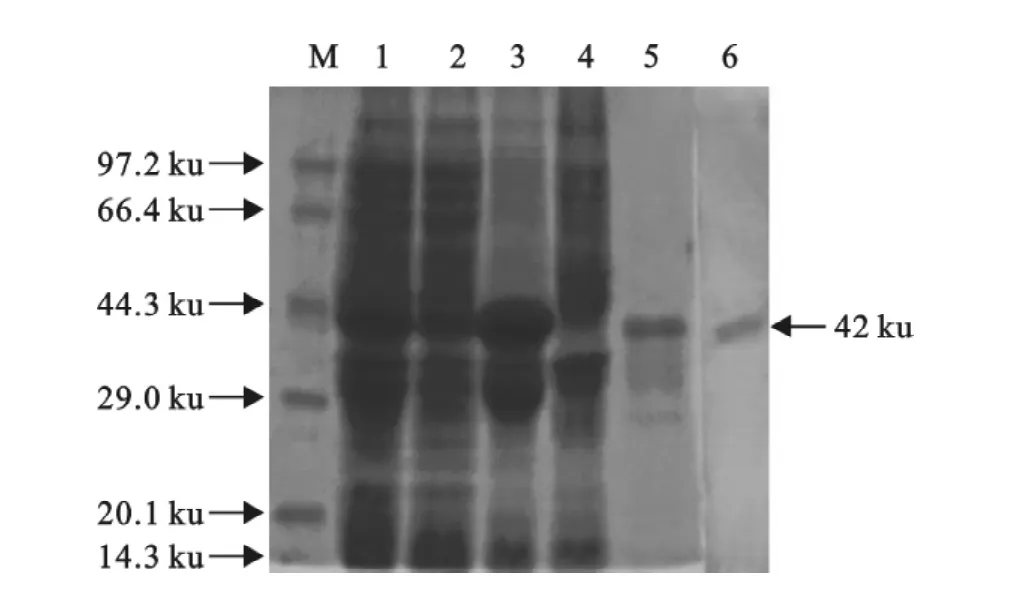
图4 重组大肠埃希菌BL21表达EDSV Knob-S重组蛋白的SDS-PAGE和 Western blot分析Fig.4 SDS-PAGE and Western-blot analysis of expression of recombinant EDSV Knob-S protein in E.coil BL21
对纯化并复性的重组蛋白进行血凝,结果发现,并无血凝活性,分析原因,可能是本试验采用的是大肠杆菌的高效表达,虽然对表达诱导时间和诱导剂浓度进行了优化,但仍然以包涵体的形式表达,而在表达的过程中蛋白不能正确折叠和修饰,无法形成与天然蛋白一致的构象导致重组蛋白的活性偏低[11-12],另外重组蛋白在复性纯化过程中损失较大,使最终获得的蛋白含量较低,这可能是影响试验结果的另一个原因[13]。
在本试验中,纯化的Knob-S蛋白电泳后转到PVDF后进行Western blot,结果表明,重组蛋白能与抗鸡的EDSV阳性血清发生反应,并出现清晰的蛋白印迹,而不与阴性血清反应,说明表达的蛋白有很好的特异性和反应活性。以重组蛋白免疫鸡制得的抗血清可抑制EDSV的血凝性,并可诱导机体产生很高的血凝价,说明Knob-S蛋白可以作为诊断抗原和基因工程疫苗的候选蛋白。
[1] Nazerian K,Lee L F,Payne W S.Structural polypeptides of type II avian adenoviruses analyzed by monoclonal and polyclonal antibodies[J].Avian Dis,1991,35(3):572-578.
[2] Pitcovski J,Fingerut E,Gallili G,et al.A subunit vaccine against hemorrhagic enteritis adenovirus[J].Vaccine,2005,23:4697-4702.
[3] Wang H J,Li Z Y,Yumul R,et al.Multimerization of adenovirus serotype 3 fiber Knob domains is required for efficient binding of virus to desmoglein 2 and subsequent opening of epithelial junctions[J].Virology,2011,85(13):6390-6402.
[4] Lynda J.Characterization of the knob domain of the adenovirus type 5 ber protein expressed inE.coli[J].Virology,1994,68(8):5239-5246.
[5] Fingerut E,Gutter B,Gallili G,et al.A subunit vaccine against the adenovirus egg-drop syndrome using part of its fiber protein[J].Vaccine,2003,21:2761–2766.
[6] Lindert S,Silvestry M,Mullen T M,et al.Cryo-electron microscopy structure of an adenovirus-integrin complex indicates conformational changes in both penton base and integrin[J].Virology,2009,83(22):11491-11501.
[7] Christopher M.Computational analysis of human adenovirus type 22 provides evidence for recombination among species D human adenoviruses in the penton base gene[J].Virology,2009,83(17):8980-8985.
[8] Bradley R R.Adenovirus serotype 5 neutralizing antibodies target both hexon and fiber following vaccination and natural infection[J].Virology,2012,86(1):625-629.
[9] Zandvliet M L.Combined CD8+and CD4+adenovirus hexon specific T cells associated with viral clearance after stem cell transplantation as treatment for adenovirus infection[J].Haematologica,2010,95(11):1943-1951.
[10] Gutter B,Fingerut E,Gallili G.Recombinant egg drop syndrome subunit vaccine offers an alternative to virus propagation in duck eggs[J].Avian Pathol,2008,37(1):33-37.
[11] 李向涛,施开创,陈宏备,等.猪脑心肌炎病毒GXLC株VP1基因的原核表达及鉴定[J].动物医学进展,2011,32(2):6-9.
[12] 娜仁高娃,呼和巴特尔,王文龙.牛皮蝇幼虫抗原基因原核表达条件的优化[J].动物医学进展,2011,32(3):32-36
[13] 杨 华,刘晓民,于志丹,等.减蛋综合征病毒五邻体基因的原核表达及其表达蛋白的部分活性分析[J].中国兽医科学,2010,40(7):688-691.
Prokaryotic Expression of Egg Drop Syndrome Virus Knob-S and Its Activity Analysis
CHEN Tao1,2,TANG Ying-hua2,LU Ji-hu2,GAO Feng1,2,YU Yang2,HE Jia-hui2,LI Man-xiang1,HOU Ji-bo2
(1.CollegeofVeterinaryMedicine,HunanAgricultureUniversity,Changsha,Hunan,410128,China;
2.JiangsuAcademyofAgriculturalSciences,NationalVeterinaryBiologicalMedicineEngineeringResearchCenter,Nanjing,Jiangsu,210014,China)
The Knob-S gene of egg drop syndrome virus(EDSV)was amplified by PCR,and then cloned into the polyclonal sites of p ET-32(a)vector.The recombinant prokaryotic expression plasmid was constructed,and named p ET-32(a)-Knob-S.The recombinant plasmid was transformed into competent cells BL21 for expression and induced with IPTG.The fusion protein of 42 ku was expressed.Chickens were immunized with the purified fusion protein to prepare polyclonal anti EDSV serum.The hemagglutination test showed that protein could not agglutinate chicken erythrocytes.Western blot test and hemagglutination inhibition test indicated that the expressed protein had good antigenicity.
EDSV;prokaryotic expression;Knob-S
S852.659.1
A
1007-5038(2012)06-0041-04
2012-02-15
江苏省农业科技自主创新项目(cx(10)450;cx(11)4072;cx(10)216)
陈 滔(1985-),男,湖南澧县人,硕士研究生,主要从事动物传染病的诊断与预防。*通讯作者

