大孔树脂纯化紫花地丁中γ-氨基丁酸的研究
黄美娥,董爱文,郭小玲,林永慧
(1.吉首大学林产化工工程湖南省重点实验室,湖南张家界427000;2.吉首大学生物资源与环境学院,湖南吉首416000)
紫花地丁Viola yedoensisMakino,又名光萼堇菜、地丁菜等,为堇菜科堇菜属植物[1-2],是我国传统中药材,其野生资源丰富。紫花地丁中含有大量生物活性成分[2-9],其中γ-氨基丁酸(γ-aminobutyric acid)是一种重要的功能性非蛋白组成氨基酸,参与体内的多种代谢活动,具有很高的生理活性,γ-氨基丁酸在医药、食品、饲料中具有广阔的应用前景,2009年9月29日已被中华人民共和国卫生部批准为可用于食品生产加工的新资源。开发γ-氨基丁酸产品及其功能性食品、保健品是当前食品及医药领域的研究热点之一。本实验拟采用大孔树脂法分离纯化紫花地丁中γ-氨基丁酸,提高其含有量,为进一步开发紫花地丁资源奠定基础。
大孔树脂具有高效、低毒的特点,被广泛应用于中药材活性成分的提取纯化。本实验首次采用大孔树脂法对紫花地丁中γ-氨基丁酸进行纯化,比较7种不同型号树脂吸附特性,筛选出最佳树脂。考察了上样质量浓度、洗脱剂用量、洗脱剂体积流量等工艺参数,确定了最佳纯化工艺条件。
1 材料与仪器
紫花地丁鲜样采于湖南省张家界市沙堤紫花地丁种植基地,将其洗净后沥干,置恒温干燥箱中50℃干燥,粉碎过筛,密封保存备用。
γ-氨基丁酸对照品SIGMA公司,批号BCBC3246V;乙醇、苯酚、硼酸、硼砂、氢氧化钠等均为分析纯;D941、LX—17树脂由西安蓝晓科技有限公司提供;SA—2、732、001×16、AB—8、330树脂由安徽三星树脂科技有限公司提供。AEG—220分析天平,日本SHIMADZU公司;UV757紫外可见分光光度计,上海精密科学仪器有限公司;R—215旋转蒸发仪瑞士BUCH公司。
2 方法与结果
2.1 γ-氨基丁酸的测定
2.1.1 对照品溶液的配制取γ-氨基丁酸对照品50.0 mg,精密称定,置于50 mL量瓶中,用60%乙醇溶解并定容至刻度,摇匀,制成1.0 mg/mL的对照品溶液,备用。
2.1.2 供试品溶液的制备称取紫花地丁样品粉末1 kg,加15倍量60%乙醇溶液于40℃浸提2 h,过滤;重提一次,合并滤液,减压浓缩,备用。
2.1.3 检测波长的确定取对照品溶液于紫外分光光度计上,自200~800 nm范围内自动扫描,γ-氨基丁酸溶液在600~700 nm区间有很强的吸收,最大吸收波长为644 nm,故选择644 nm作为测定波长。
2.1.4 标准曲线的绘制分别吸取1.0 mg/mL对照品溶液0、2、4、6、8、10 mL至10 mL量瓶中,定容至刻度,配成0.0、0.2、0.4、0.6、0.8、1.0 mg/m L的对照品溶液。分别吸取0.0、0.2、0.4、0.8、1.0 mg/mL γ-氨基丁酸对照品溶液600 μL,加入硼酸缓冲液(pH9.0)400 μL,6%重蒸酚1 000 μL,混匀,再加入5%NaClO溶液混匀,沸水水浴10 min,冰水冷却20 min,加入60%乙醇4.0 mL,混匀,于644 nm下测定吸光度,以质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,试验重复进行3次,得回归方程A=0.709 6C+0.004 5,R2=0.999 6,表明γ-氨基丁酸质量浓度在0.2~1.0 mg/mL范围内呈良好线性关系[10]。
2.1.5 紫花地丁中γ-氨基丁酸的测定取2.1.2项中供试品溶液,按标准曲线绘制方法,测定紫花地丁供试品液吸光度,试验重复进行3次,计算样液中γ-氨基丁酸的质量分数得0.298%。
2.2 树脂的预处理取一定体积的树脂,先以蒸馏水浸泡12 h,再用40%的NaCl溶液浸泡12 h,然后用2%NaOH搅拌浸泡5 h,水洗至中性,再用5%HCl搅拌浸泡5 h,水洗至中性,最后用70%乙醇浸泡12 h,水洗至无絮状物。
2.3 树脂对紫花地丁γ-氨基丁酸的静态实验
2.3.1 静态吸附试验准确称取预处理好的7种树脂各1.00 g,装入具塞磨口三角瓶中,准确加入0.5 mg/mL的紫花地丁提取液20 mL,于25℃恒温振荡24 h,充分吸附后,过滤,测定滤液中γ-氨基丁酸的浓度,按下列公式计算各树脂在室温条件下的吸附量和吸附率。
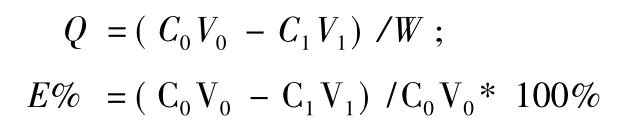
式中:Q为吸附量(mg/g);E为吸附率(%);C0为吸附前溶液的质量浓度(mg/mL);C1为吸附后溶液的质量浓度(mg/mL);V0为吸附前溶液的质量体积(mL);V1为吸附后溶液的体积(mL);W为树脂质量(g)。
2.3.2 静态解吸试验取按2.3.1项方法吸附饱和的树脂,用pH值8.5的NaOH溶液10 mL解析24 h后,过滤,测定滤液中γ-氨基丁酸的含有量,按下列公式计算解吸率。

式中:D为解吸率(%);C0为吸附前溶液的质量浓度(mg/mL);C1为吸附后溶液的质量浓度(mg/mL);C2为解吸后溶液的质量浓度(mg/mL);V0为吸附前溶液的体积(mL);V1为吸附后溶液的体积(mL);V2为解吸后溶液的体积(mL)[11]。见表1。
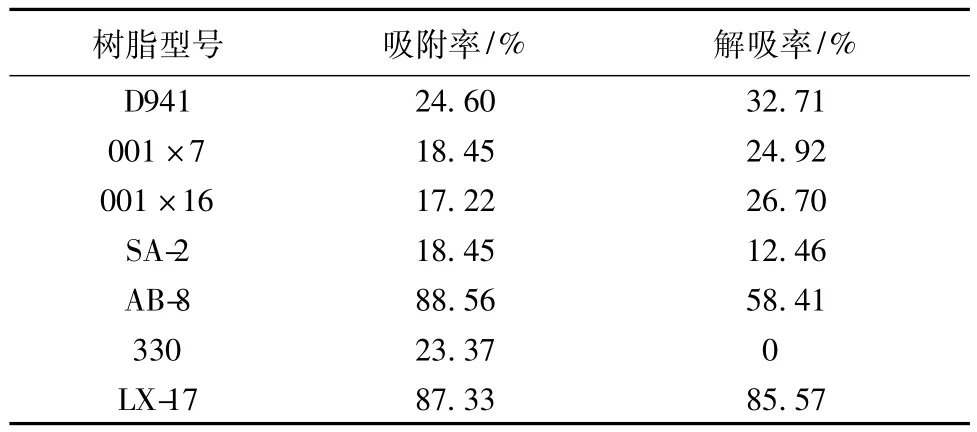
表1 7种树脂对紫花地丁γ-氨基丁酸的吸附率和解吸率(n=3)
由表1通过比较7种树脂对紫花地丁中γ-氨基丁酸吸附率和解吸率的差异可以看出,LX-17树脂对紫花地丁中γ-氨基丁酸有较好的吸附率和解吸率。故选用LX-17树脂为紫花地丁γ-氨基丁酸纯化用吸附剂。
2.4 LX-17树脂对紫花地丁中γ-氨基丁酸吸附动力学试验
在静态吸附的基础上选择LX-17树脂进行吸附动力学试验。精密量取10 mL LX-17树脂湿法装柱,以1.0 BV/10 min流速将质量浓度为0.123 mg/mL的紫花地丁提取液上柱,吸附后开始收集流出液,每份收集10 mL,共收集8份,重复3次,以流出液体积为横坐标,吸附率为纵坐标,作LX-17树脂对紫花地丁中γ-氨基丁酸的动态吸附曲线。见图1。
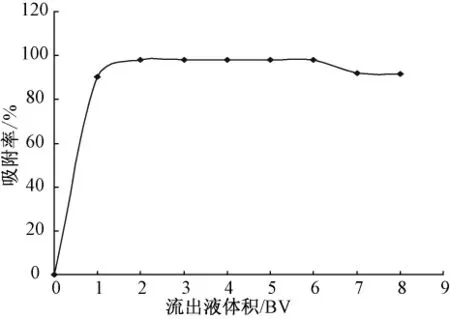
图1 动态吸附曲线图
由图1的动态吸附曲线可以看出,LX-17树脂对紫花地丁γ-氨基丁酸的吸附较快,当收集第二管时吸附率达94%以上,从吸附达饱和的时间和吸附率考虑,LX-17树脂适宜对紫花地丁γ-氨基丁酸进行纯化。
2.5 LX-17树脂对紫花地丁中γ-氨基丁酸动态吸附条件的选择
2.5.1 样液质量浓度的选择准确量取10 mL处理好的LX-17树脂湿法装柱,分别将质量浓度为0.123、0.133、0.156、0.189、0.216、0.257 mg/mL的紫花地丁提取液,以1.0 BV/10 min上样,重复3次,考察不同上样液质量浓度时,LX-17树脂对紫花地丁γ-氨基丁酸吸附性能的影响[12]。见图2。
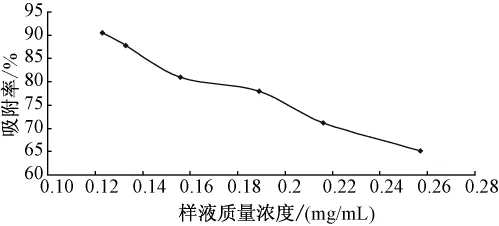
图2 样液质量浓度对吸附率的影响
由图2可见,上样液质量浓度对吸附率有影响,随着样液质量浓度的增大,LX-17树脂对紫花地丁γ-氨基丁酸的吸附率逐渐降低,当样液质量浓度为0.123 mg/mL时,吸附率较大,吸附效果较好,故选择上样液质量浓度为0.123 mg/mL。
2.5.2 上柱样液pH值的选择准确量取10 mL处理好的LX-17树脂湿法装柱,分别将质量浓度为0.123 mg/mL不同pH值的紫花地丁提取液,以1.0 BV/10 min上样吸附流速上样,重复3次,考察不同pH值时,LX-17树脂对紫花地丁中γ-氨基丁酸吸附性能的影响[13]。见图3。
由图3可见,上样液的pH值对吸附率有影响,当样液pH为3.0时,吸附率较大,吸附效果较好,故选择上样液的pH值为3。
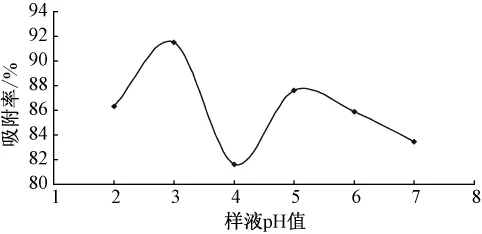
图3 样液pH值对吸附率的影响
2.5.3 上柱样液流速的选择准确量取10 mL处理好的LX-17树脂湿法装柱,将质量浓度为0.123 mg/m L的紫花地丁提取液,分别以0.5、1.0、1.5、2.0 BV/10 min的流速上柱,重复3次,考察不同上柱流速时,LX-17树脂对紫花地丁中γ-氨基丁酸吸附性能的影响。见图4。
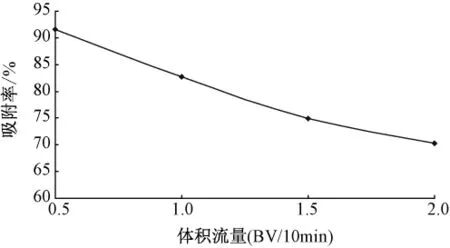
图4 上柱体积流量对吸附率的影响
由图4可见,随着上柱流速的增加,吸附率逐渐下降。由于流速过快目标成分分子来不及扩散并吸附到树脂内表面就已流出,因此上柱流速慢有利于吸附,故选取上样吸附流速为0.5 BV/10 min。
2.6 紫花地丁中γ-氨基丁酸动态洗脱效果的影响
2.6.1 洗脱剂pH值对洗脱效果的影响按照最优动态吸附条件上柱,充分吸附达饱和后,依次用pH值为7.5、8.0、8.5、9.0的NaOH溶液洗脱,重复3次,根据解吸率的大小确定洗脱剂的最佳pH值。见图5。
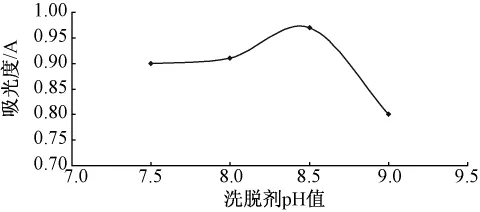
图5 洗脱剂pH值对解吸的影响
由图5可见,洗脱剂pH值对洗脱效果有影响,洗脱剂pH值在7.5~8.5的范围内,随着洗脱剂pH值的升高,洗脱液吸光度值逐渐升高,当洗脱剂pH值为8.5时,吸光度值达最大值,超过8.5以后,随着洗脱剂pH值的升高,吸光度值又降低,故选择洗脱剂pH值为8.5。
2.6.2 不同洗脱流速对洗脱效果的影响按照最优动态吸附条件上柱,充分吸附达饱和后,用pH8.5的NaOH溶液分别以0.5 BV/10 min、1.0 BV/10 min、1.5 BV/10 min、2.0 BV/10 min的流速进行洗脱,重复3次,根据解吸率的大小确定最佳洗脱流速。见图6。
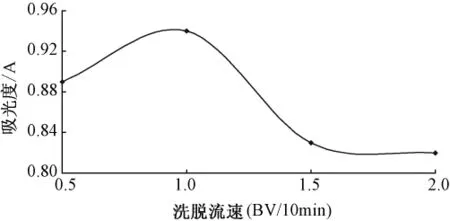
图6 洗脱流速对解吸的影响
由图6可见,当洗脱流速为1.0 BV/10 min时,洗脱液吸光度值过最大值,故选择洗脱剂流速为1.0 BV/10 min。2.6.3洗脱曲线的制作按照最优动态吸附条件上柱,充分吸附达饱和后,让树脂充分吸附γ-氨基丁酸。用pH=8.5的NaOH溶液以1.0 BV/10 min流速洗脱,每份收集10 mL,共收集8份,重复3次。以流出液体积为横坐标,γ-氨基丁酸浓度为纵坐标,作洗脱曲线图。见图7。
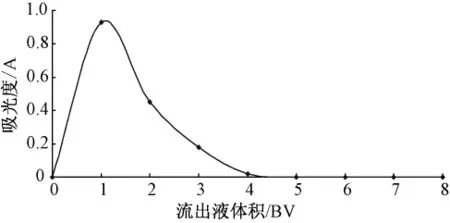
图7 洗脱曲线图
由图7可见,当收集第一管洗脱液时,洗脱液吸光度值最大。随着洗脱液体积的增加,吸光度值逐渐降低。用3倍树脂床体积的洗脱剂基本上可将γ-氨基丁酸洗脱下来,且洗脱峰较集中。
2.7 验证实验量取LX-17树脂50 mL共3份,预处理后,装柱。调整上样液pH值3.0后,以0.5 BV/10 min的流速上样500 mL,用pH值8.5的NaOH溶液洗脱3 BV,洗脱流速1.0 BV/10 min,收集洗脱液,减压浓缩,50℃干燥得γ-氨基丁酸质量分数分别为15.16%、15.21%、15.30%的产品。以此提取纯化工艺制备γ-氨基丁酸平均收率为5.34%。
3 讨论
大孔树脂技术在中药研究中已日趋成熟,应用前景日益广泛。紫花地丁中含有大量生物活性成分,所以γ-氨基丁酸的富集纯化存在一定的困难。本实验首先通过静态试验,比较了7种大孔树脂对γ-氨基丁酸的吸附和解吸特性,随后通过单因素对比试验,考察了最佳动态吸附和洗脱条件。验证试验结果表明,LX-17树脂适宜紫花地丁中γ-氨基丁酸的纯化,按最佳条件进行紫花地丁中γ-氨基丁酸的纯化可得质量分数为15.22%的产品,为后续精制高纯度的γ-氨基丁酸产品打下了重要基础。
[1]任仁安主编.中药鉴定学[M].上海:上海科技出版社,1986:466.
[2]全国中草药汇编编写组.全国中草药汇编(上册)[M].北京:人民卫生出版社,1978:553-554.
[3]肖永庆,毕俊英,刘晓宏,等.地丁化学成分的研究[J].植物学报,1987,29(5):532.
[4]Xie C,Veitch N C,Houghton P J,et al.Flavone C-glycosides fromViola yedoensisMakino[J].Chem Pharm Bull,2003,51(10):1204-1207.
[5]刘湘新,刘进辉,刘自逵,等.紫花地丁的有效成分分析及抗菌作用研究[J].中兽医医药杂志,2004(3):16.
[6]白殿罡.紫花地丁挥发性化学成分的分析[J].长春大学学报,2008,18(5):69-71.
[7]Zhou Haiyan,Qin Minjian,Hong Junli,et al.Chemical Constituents ofViola yedoensis[J].Chin J Nat Med,2009,7(4):290-292.
[8]陈胡兰,董小萍,张梅,等.紫花地丁化学成分研究[J].中草药,2010,41(6):847-877.
[9]徐金钟,曾珊珊,瞿海斌,等.紫花地丁化学成分研究[J].中草药,2010,41(9):1423-1425.
[10]魏珍珍,赵明,李双容,等.比色法测定茶叶GABA含量的可行性研究[J].江西农业学报,2010,22(8):56-58.
[11]刘江波,傅婷婷,吕秀阳.大孔树脂分离纯化三叶青总黄酮的工艺研究[J].中国药学杂志,2011,46(4):287-292.
[12]周建军,曹亮.大孔树脂分离纯化虎杖中蒽醌类化合物工艺研究[J].中成药,2011,33(7):1267-1269.
[13]彭亮,李知敏,祝珍芳.大孔吸附树脂纯化蒺藜中总皂苷工艺的优化[J].中成药,2011,33(5):886-889.

