脑源性神经营养因子修饰的神经干细胞移植对阿尔茨海默病大鼠的学习及p75表达的影响
杨华山 , 王金国
阿尔茨海默病(Alzheimer’s disease,AD)又称为老年性痴呆,是一种与年龄相关的进行性记忆丧失和高级认知功能减退的神经系统退行性疾病,临床主要表现为认知和记忆功能不断恶化,日常生活能力进行性减退,并伴有各种神经精神症状和行为障碍,给社会和家庭带来了沉重的负担[1]。因此,人们进行了大量的研究去探索该病的发病机制及治疗该病的新的有效的方法。一些学者在研究该病的发病机制及病理改变中发现p75蛋白与AD病理过程密切相关,海马CA1区的p75大量表达往往伴随着大量神经细胞的在量丢失[2]。进一步研究发现高表达的p75引起了学习记忆的障碍[3],这些结果提示p75促进了AD的发展,有效地抑止p75的表达,可以起到治疗的作用。
目前,神经干细胞在神经系统中的作用日益受到研究人员的重视,国内外的大量文献报道神经干细胞移植可以有效地延缓AD病的发展或者减轻AD病的症状[4]。而经BDNF修饰后的神经干细胞是否具有更好的治疗作用目前还没有相关的报道。在本实验中,我们拟通过移植经脑源性神经营养因子(BDNF)修饰过的神经干细胞来观察其对AD大鼠的学习及海马区p75的表达影响,从而为AD的治疗寻找新的治疗方法与途径。
1 材料与方法
1.1 实验动物与主要试剂及材料 36只健康雄性SD大鼠(3~4月龄,体重260~320g),由郑州大学实验动物中心提供。通过Y型水迷宫和跳水试验,从中筛选出24只反应迅速、动作灵敏的大鼠作为试验对象。淀粉样β蛋白1-40(Aβ1-40购自Sigma公司),BDNF及p75抗体均购自武汉博士德公司。内参GAPDH购自杭州贤至生物有限公司。Y型电迷宫(张家港生物医学仪器厂)、荧光显微镜(日本尼康E600)、大鼠立体定向仪SN-2型(日本东京成茂科学器械研究所)。
1.2 实验方法
1.2.1 AD 模型的制作与分组 Aβ1-40溶于无菌生理盐水(2μg/μl),用前37℃孵育1w以上,使其变为聚集状态。按35mg/kg的剂量腹腔注射戊巴比妥钠麻醉SD大鼠,参照包新民等编著大鼠脑立体定位图谱,使用立体定向器定位大鼠的海马注射点,每侧海马注射5μl淀粉样β蛋白,10min内注完,并留针10min[5]。造模成功后随机将AD大鼠分为3组:溶剂对照组(vehicle)、神经干细胞移植组(NSC)和经BDNF修饰的神经干细胞(BDNF-NSC)移植组。
1.2.2 带有BDNF基因的细胞转染 BDNFNSC组移植前1d,将带有BDNF基因片段的质粒12μg加入500μl不含血清的DMEM培养基中,同时再配制含12μl脂质体和500μl DMED培养基的混合液体,然后将两液体混合到一起,同时用吹管吹打均匀,45min后加入2ml含2×105个神经干细胞的悬液中[6]。孵育24h后采用RT-PCR技术检测BDNF基因在NSC中的表达,效果满意后进行下一步实验。
1.2.3 BDNF修饰的神经干细胞移植 在3个实验组中,BDNF-NSC组和NSC组分别经立体定位器向侧脑室注入5μl(约3×105)的 BDNF-NSC和NSC细胞悬液,溶剂对照组只给予相同剂量的细胞培养液。注射选定的侧脑室坐标为:前卤后0.6mm、中线左 1.5mm、硬膜下 4mm,注射速度为 0.5μl/mm,留针10min。
1.2.4 AD大鼠行为学检测 于脑内移植细胞或培养基后4w进行Y型电迷宫试验,用于检测各组AD大鼠的学习和记忆能力。(1)学习能力测试:将大鼠受电击后从起步区直接逃至安全区作为正确反应,而以连续10次试验中大鼠做出9次(9/10)正确反应所需总的电击次数(即尝试次数)表示其学习获得能力;(2)记忆再现测试:上述达标大鼠休息24h后,同法检测其记忆力。以达到9/10标准前的尝试次数表示记忆再现能力[7]。
1.2.5 免疫组织化学法检测BDNF-NCS在各组中的表达 迷宫试验结束后各组大鼠经10%水合氯醛腹腔麻醉(3ml/kg)后,经主动脉相继灌注生理盐水100ml、40g/L多聚甲醛(4℃)350ml。快速取脑,固定后于移植点附近做层厚10μm冰冻切片,进行BDNF免疫组织化学(一抗:兔抗BDNF抗体;二抗:羊抗兔 IgG)。DAB显色 5min,苏木素复染2min,染色后进行脱水、透明、封片。以PBS作为阴性对照。
1.2.6 Western blot法检测p75 检测各组AD大鼠的行为学能力后,采用10%水合氯醛腹腔注射(6ml/kg)过量麻醉致死后取脑,分离海马区的组织并用预冷的PBS洗涤后加细胞裂解液提取总蛋白,经定量后,将蛋白浓度调整为一致。加等量的3×SDS上样缓冲液,配制12%的聚丙烯酰胺分离胶,每孔上样50μg蛋白,电泳分离蛋白,转膜,5%脱脂牛奶封闭1h后,加入相应的一抗4℃孵育过夜,以GAPDH作内参照。洗涤3次,加入相应二抗,37℃孵育1h,洗膜3次,用ECL发光法检测目的条带的表达。采用Image J分析软件对目的条带进行分析。
1.3 统计学分析 采用SPSS 17.0统计学软件处理,多组均数之间的两两比较采用单因素方差分析,P<0.05有统计学意义,计量数据用数据±标准差(±s)表示。
2 结果
2.1 3组行为学评分 3组Y迷宫的行为学评分结果显示BDNF-NSC组较NSC组和溶剂对照组具有更少的尝试次数,并且单因素方差分析显示这种差异具有统计学意义(F=31.62,P<0.05);比较NSC组和Vehicle组行为学结果发现NSC组尝试的次数亦明显少于对照组,且差异有统计学意义(P<0.05)(见表 1)。
2.2 BDNF修饰的神经干细胞在AD大鼠脑中的表达 免疫组化结果显示BDNF修饰的神经干细胞移植组大鼠在海马可见较多的棕黄色阳性细胞,主要分布在海马CA1、CA3区多形层和分子层及齿状回,呈点状沿多形层和分子层长轴分布(见图1C)。而NSC和Vehicle组则末显示明显的阳性细胞(见图1A、B)。
2.3 Western blot检测p75蛋白在各组中的表达 在BDNF-NSC和NSC移植4w后,Western blot检测结果显示p75蛋白在BDNF-NSC和NSC移植组的表达明显降低,而以BDNF-NSC降低的较为明显。与BDNF-NSC和NSC移植组相比,Vehicle组显示了更高的p75表达(见图2)。统计分析结果显示BDNF-NSC移植组与NSC移植组和Vehicle组在p75蛋白的表达上具有显著的统计学差异(P<0.05)。同时,NSC移植组和Vehicle组两组在p75蛋白表达上也有显著的统计学差异(P<0.05)(见图3)。
表1 3组AD大鼠空间学习能力与再现记忆能力的比较(±s)
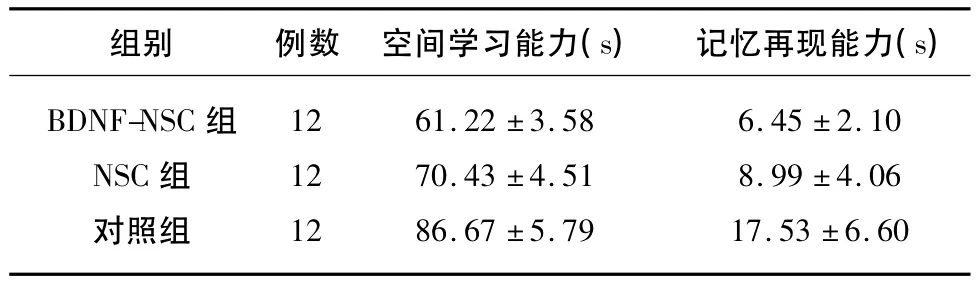
表1 3组AD大鼠空间学习能力与再现记忆能力的比较(±s)
组别 例数 空间学习能力(s) 记忆再现能力(s)BDNF-NSC组NSC组对照组12 12 12 61.22 ±3.58 70.43 ±4.51 86.67 ±5.79 6.45 ±2.10 8.99 ±4.06 17.53 ±6.60

图1 BDNF-NSC在3组AD大鼠脑中的表达(×100)
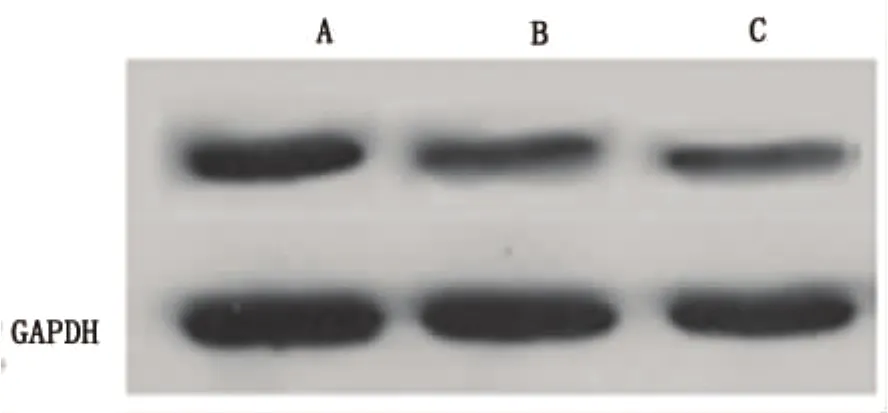
图2 p75蛋白在各组中的表达
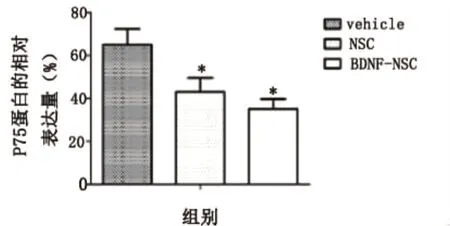
图3 p75蛋白表达的统计分析与其他两组比较有统计学差异*P<0.05
3 讨论
本实验结果显示经BDNF修饰过的神经干细胞能够显著提高AD大鼠的学习与记忆能力,同时研究发现BDNF-NSC抑制了p75的表达。这些结果提示BDNF-NSC发挥了神经保护作用,而这种保护作用可能是通过抑制p75的表达来实现的。
AD是一种常见的老年性疾病,该病的标志性病理变化是神经细胞内神经原纤维缠结和前脑、海马内出现斑块,β淀粉蛋白(Aβ)是该斑块的主要成份。大量研究显示无论Aβ的单体还是多聚体都是可以对脑神经产生损害作用,而另一些研究表明Aβ的神经损害作用是与 p75的功能密切相关[8~10]。p75是一种具有多功能的肿瘤坏死因子超家族受体,它的功能与细胞凋亡、分化与存活有关[11]。最近研究表明p75经常作为Aβ受体来凋节Aβ的神经毒性作用。Aβ与p75结合后引起了下游的炎症信号通路的改变,如JNK、NFKβ和PI3K等,从而造成神经细胞的损伤[12,13]。另有文献报道表达p75的细胞对Aβ的毒性的敏感程度显著增加[14]。这些研究均提示在AD的过程中,p75发挥了主要的神经损害作用,因此,我们将BDNF-NSC对p75表达的抑制效果作为判断疗效的标准。
神经干细胞(NSC)是一种具有分化潜能的原始细胞,由于其具备自我更新和增殖的能力,并在特定因素影响或诱导下向神经元或胶质细胞分化,所以近些年来成为许多领域的研究热点。国外有研究发现将人来源的神经干细胞移植入脑出血的小鼠体内,神经干细胞可分化为神经元或胶质细胞,从而使该小鼠的神经功能得到显著改善[15]。国内学者吴树亮研究发现脑内移植的神经干细胞不仅可以提高AD大鼠的学习和记忆能力,而且可减少海马中老年斑的沉积和神经元纤维缠结的形成[16]。另外,有文献报道BDNF对神经元的生长、分化及损伤后修复有促进作用,而且BDNF可以抑制AD大鼠脑内神经细胞从有丝分裂G2期向M期的转换,从而抑制了由4倍体神经元引起的凋亡[17]。然而经BDNF修饰的神经干细胞是否对AD中p75的表达具有抑制作用目前尚未见相关的报道。
因此,为了检测BDNF-NSC在AD中的作用及作用机制,我们将BDNF-NSC采用立体定向注射的方法注入AD大鼠脑内,然后通过Y迷宫试验来评定3组AD大鼠的空间学习和记忆能力。评定结果显示BDNF-NSC组和NSC组较Vehicle组具有更好的行为学评分,而且BDNF-NSC组较NSC组在行为学上改善更为明显,这些结果表明BDNF-NSC不仅具有保护神经元免受Aβ损伤的作用。同时为了证明BDNF-NSC的存在,为了证实行为学的改善是由于BDNF-NSC作用的结果,我们检测了BDNF-NSC的表达,免疫组织化学的检测结果显示BDNF-NSC大量存在于海马的颗粒细胞层。海马颗粒层神经细胞与空间学习和记忆密切相关,免疫组织化学的结果间接证明了AD大鼠行为学的改善是BDNF-NSC移植造成的结果。为了进一步揭示BDNF-NSC作用机制,我们检测了3组海马区 p75蛋白的表达,Western blot结果显示BDNF-NSC组的p75蛋白表达较NSC组和Vehicle组明显降低,并且有显著的统计学差异。这一结果提示BDNF-NSC可能通过抑制p75的表达起到神经保护作用,当然,具体的机制还需要进一步的研究。
总之,我们的实验提示BDNF-NSC通过抑制p75的表达起到了神经保护的作用,从而提高了AD大鼠的行为学能力。该研究可能为AD的治疗提供新的途径和靶点,可能为进一步研究AD的治疗方法提供理论依据。
[1]Geula C,Nagykery N,Nicholas A,et al.Cholinergic neuronal and axonal abnormalities are present early in aging and in Alzheimer disease[J].J Neuropathol Exp Neurol,2008,67(4):309 - 318.
[2]Defreitas MF,Mcquillen PS,Shatz CJ.A novel p75NTR signaling pathway promotes survival,not death,of immunopurified neocortical subplate neurons[J].J Neurosci,2001,21(14):5121 -5129.
[3]Friedman WJ.Neurotrophins induce death of hippocampal neurons via the p75 receptor[J].J Neurosci,2000,20(17):6340 -6346.
[4]赵志英,胡海涛,冯改丰,等.人脑源性神经营养因子基因修饰神经干细胞移植对痴呆大鼠学习记忆的改善[J].中国修复重建外科杂志,2005,19(5):331 -334.
[5]Abrous DN,Koehl M,Le Moal M.Adult neurogenesis:from precursors to network and physiology[J].Physiol Rev,2005,85(2):523 -569.
[6]庄 菁,曾园山,罗超权,等.神经前体细胞的分离培养及绿色荧光蛋白基因的转染[J].中山医科大学学报,2001,5:342-344.
[7]李子艳,马慧冬.阿尔茨海默病转基因小鼠的行为学检测方法[J].中国医药导报,2011,16:13 -15.
[8]Chen Y,Zeng J,Cen L,et al.Multiple roles of the p75 neurotrophin receptor in the nervous system[J].J Int Med Res,2009,37(2):281-288.
[9]Friedman WJ.Neurotrophins induce death of hippocampal neurons via the p75 receptor[J].J Neurosci,2000,20(17):6340 -6346.
[10]Frade JM,Rodriguez-Tebar A,Barde YA.Induction of cell death by endogenous nerve growth factor through its p75 receptor[J].Nature,1996,383(6596):166 -168.
[11]Diarra A,Geetha T,Potter P,et al.Signaling of the neurotrophin receptor p75 in relation to Alzheimer’s disease[J].Biochem Biophys Res Commun,2009,390(3):352 -356.
[12]Kuner P,Schubenel R,Hertel C.Beta-amyloid binds to p57NTR and activates NFkappaB in human neuroblastoma cells[J].J Neurosci Res,1998,54(6):798 -804.
[13]Yaar M,Zhai S,Pilch PF,et al.Binding of beta-amyloid to the p75 neurotrophin receptor induces apoptosis.A possible mechanism for Alzheimer's disease[J].J Clin Invest,1997,100(9):2333 - 2340.
[14]Perini G,Della-Bianca V,Politi V,et al.Role of p75 neurotrophin receptor in the neurotoxicity by beta-amyloid peptides and synergistic effect of inflammatory cytokines[J].J Exp Med,2002,195(7):907-918.
[15]Jeong SW,Chu K,Jung KH,et al.Human neural stem cell transplantation promotes functional recovery in rats with experimental intracerebral hemorrhage[J].Stroke,2003,34(9):2258 -2263.
[16]吴树亮,金连弘,李竹英,等.阿尔茨海默病动物模型的建立及神经干细胞对阿尔茨海默病的治疗作用[J].中国临床康复,2004,19:3734 -3736.
[17]Frade JM,Lopez-Sanchez N.A novel hypothesis for Alzheimer disease based on neuronal tetraploidy induced by p75(NTR)[J].Cell Cycle,2010,9(10):1934 -1941.

