陕西秦艽药源植物及秦艽药材HPLC的比较研究
汪叶庭,刘斯婷,丁 凡,魏朔南
(西北大学生命科学学院,陕西西安710069)
秦艽(Gentiana macrophylla)为龙胆科(Gentianaceae)植物,其根是我国重要的传统中药材之一,始载于《神农本草经》,主寒热邪气,寒湿风痹,肢节痛、下水、利小便。陕西和甘肃为秦艽药材的地道产区[1]。秦艽化学成分分析结果表明其主要成分为裂环环烯醚萜苷类[2],其中龙胆苦苷含量最高,具有保肝、利胆、抗炎的生物活性,其次是獐牙菜苦苷,具有助消化和镇痛作用,二者都已成功开发出中药新药。前人对陕西秦艽的化学成分和HPLC指纹图谱、秦艽药材 HPLC 指纹图谱进行了研究[3-5],但对于不同地方的秦艽以及药材与药源植物的HPLC指纹图谱和龙胆苦苷的含量比较研究尚无报道。为此,我们采用HPLC指纹图谱分析结合统计聚类分析,对陕西太白、陇县所产秦艽药原植物和西安市售秦艽药材进行了系统的比较分析,其结果可为深入开展秦艽化学成分与产地相关性以及秦艽地道药材的特点,控制秦艽药材质量提供依据。
1 材料与方法
1.1 实验材料
秦艽药原植物于2010年10月8日和11月4日分别采自陕西太白县嘴头镇强里川村和陕西陇县八渡镇三年生人工栽培秦艽,各采集10株个体。秦艽药材于2010年11月14日购于西安市药材市场10个不同药材商铺,每个商铺购200 g。
1.2 实验仪器
日本岛津LC-10ATvp高效液相色谱仪,Millipore纯水器(Elix-3),Millipore超纯水器(Synergy),小型高速粉碎机(ZN-02),电热鼓风干燥箱(WGL-45B),高功率数控超声波清洗器(KH-2000KHD)。
1.3 试剂
乙腈、甲醇(天津市科密欧化学试剂有限公司)均为色谱纯,水为超纯水,龙胆苦苷标准品购自中国药品生物制品检定所。
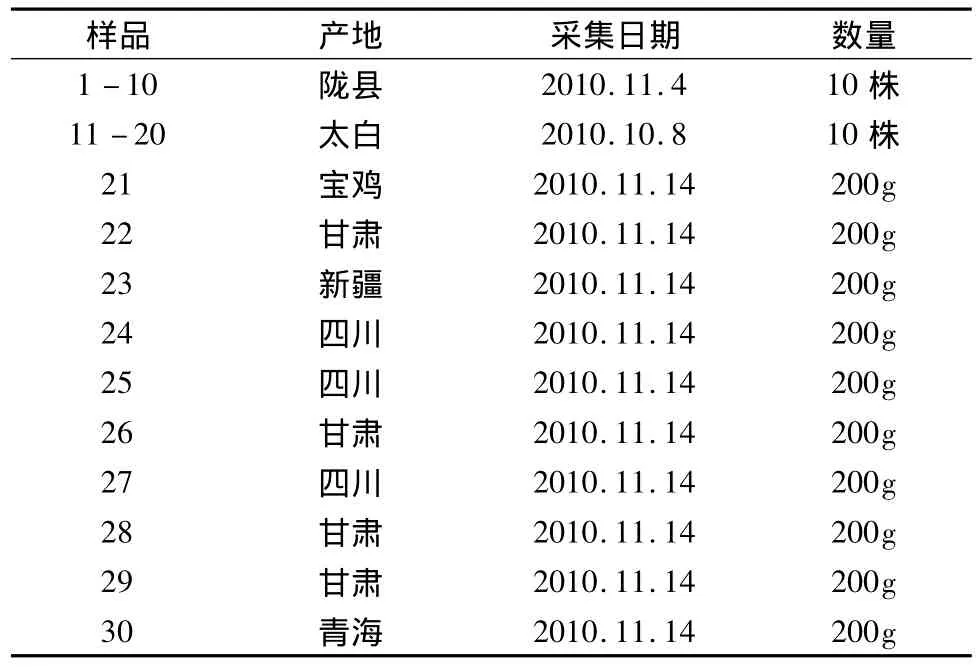
表1 秦艽药源植物和药材
1.4 色谱条件
Diamonsil C18色谱柱(200 mm ×4.6 mm,5 um);流速:0.5 ml·min-1;柱温:30℃;检测波长:240 nm:进样量:20 uL。流动相选择乙腈(A)一水(B),梯度洗脱程序0 min:97%B,7 min:92%B,12 min:88%B,15 min.85%B,18 min:88%B,50 min:stop。
1.5 标准品溶液制备
精密称取龙胆苦苷对照品0.025 g,置于50 mL容量瓶中,加甲醇溶解定容,取溶液12.5mL,加甲醇于50 mL容量瓶中定容,摇匀,0.22 μm微孔滤膜过滤,即得。
1.6 样品溶液制备
将采集的秦艽药源植物根在100℃鼓风干燥箱中干燥至恒重,粉碎(市购药材直接粉碎),精密称取0.5 g样品粉末,置于50 mL三角瓶中,加入约20 mL甲醇溶液,超声波振荡30 min,过滤。滤液用甲醇定容于50 mL容量瓶中,再取1 mL用甲醇溶液定容于10 mL容量瓶中,摇匀,0.22 um微孔滤膜过滤,即得。
1.7 HPLC相似度分析
采用中药色谱指纹图谱相似度评价系统研究版(2004A),将色谱工作站数据输入中药指纹图谱相似度计算软件进行分析。
1.8 聚类分析
采用STATISTICA6.0统计分析软件,以欧氏距离为测度,对秦艽药源植物的7个共有峰的峰面积和各峰面积占总峰面积的百分数进行聚类分析。
2 结果
2.1 龙胆苦苷含量的测定
2.1.1 精密度试验 精密吸取标准品溶液20 μL,重复进样5次,计算其龙胆苦苷峰面积的RSD=0.87%。
2.1.2 重复性试验 取同一样品5份,按照“样品溶液配制”项制备供试溶液,每份进样20 μL,计算其龙胆苦苷峰面积的RSD=0.72%。
2.1.3 稳定性试验 将供试溶液分别放置0、3、6、9、12 h进样测定,记录色谱图,并计算峰面积的RSD。结果表明龙胆苦苷峰面积无明显变化(RSD=1.73%,)表明样品溶液在12 h内稳定性良好。
2.1.4 回收率试验 精密称取己知龙胆苦苷含量的样品适量,定量加入对照品,制备供试溶液5份,测定龙胆苦苷含量,计算回收率。结果表明平均回收率为 100.5%,RSD=2.58%。
2.1.5 龙胆苦苷含量测定 运用外标法对秦艽药源植物、秦艽药材样品的龙胆苦苷含量进行测定,其色谱图和分析结果见图1和表2。
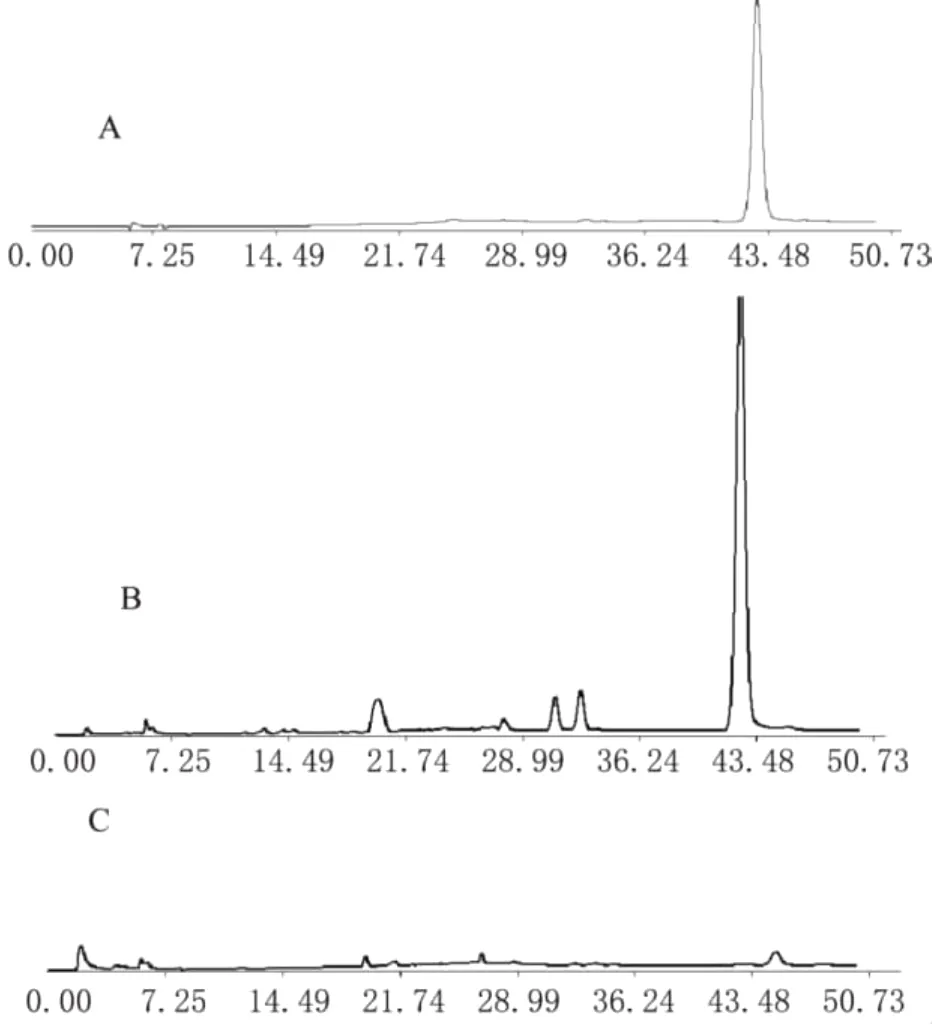
图1 龙胆苦苷和秦艽样品高效液相色谱图
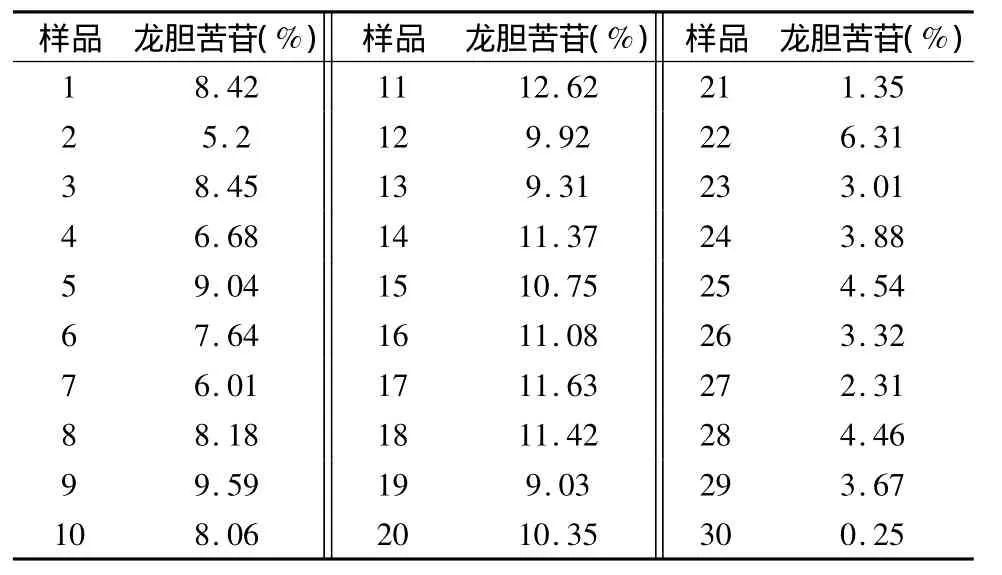
表2 秦艽样品中龙胆苦苷含量
从表2可知,陇县栽培秦艽龙胆苦苷含量为5.2% ~9.59%,平均含量为 7.73%,标准差为1.372%,太白栽培秦艽龙胆苦苷含量9.03% ~12.62%,平均含量为10.75%,标准差为1.110%,市售秦艽药材龙胆苦苷含量为0.25% ~6.31%,平均含量为3.31%。
2.2 秦艽药原植物及市售秦艽药材HPLC指纹图谱的测定
2.2.1 稳定性试验 取同一批供试品溶液,分别放置0、12、24、36、48 h 进行指纹图谱分析,其结果各特征峰表观丰度无明显差异。比较色谱峰保留时间,各色谱共有峰保留时间RSD在0.15% ~0.32%之间,计算相似度均大于0.995,表明样品溶液在48 h内稳定。
2.2.2 精密度试验 取同一供试品溶液,连续进样5次,比较各色谱峰的保留时间,结果表明5次进样各共有峰保留时间RSD在0.27% ~1.31%之间,计算相似度均大于0.996,表明供试品进样分析精密度良好。
2.2.3 重复性试验 取同一批秦艽药材5份,按
2.3 项下方法制备供试品溶液,考察HPLC指纹图谱各特征峰的表观丰度,结果表明各共有峰保留时间RSD在0.06% ~2.54%之间,计算相似度均大于0.993,表明本法测定的重复性良好。
2.2.4 秦艽药源植物HPLC指纹图谱的建立 取1~20号样品,按1.6项下方法制备供试品溶液,在已确定的色谱条件下取样品溶液20 μL进样,记录50 min色谱图,采用中药色谱指纹图谱相似度评价系统研究版(2004A)进行各样品色谱图指纹图谱分析(见图2),确定了7个共有峰,7号峰龙胆苦苷的含量最高。
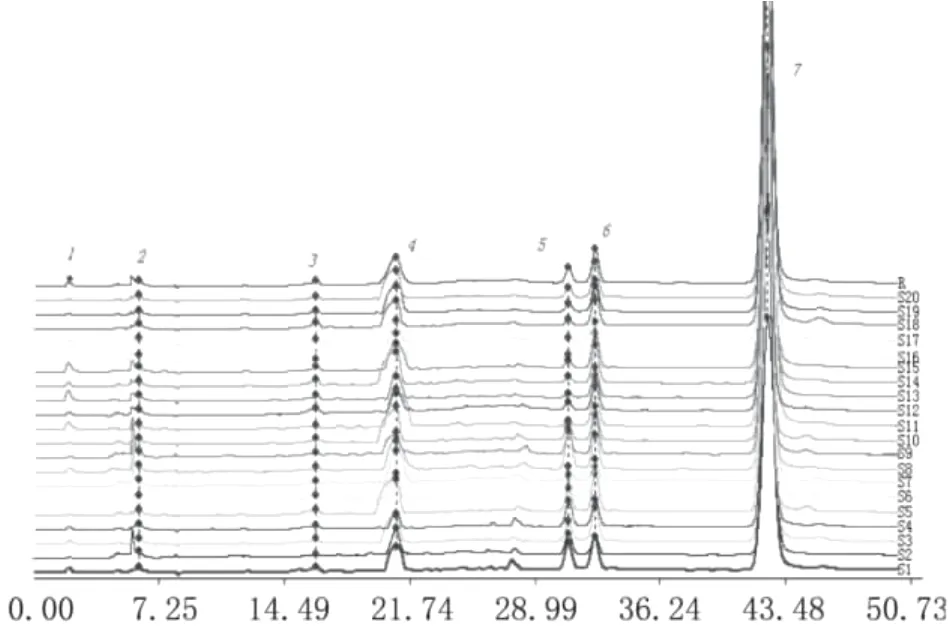
图2 陕西秦艽药源植物的HPLC指纹图谱
2.2.5 市售秦艽药材HPLC指纹图谱的建立 对21~30号样品进行HPLC指纹图谱测定,发现只有30号样品(见图2(C))各种峰出现的位置及相对峰面积与前20号样品具有明显差异。
2.2.6 相似度计算 采用中药色谱指纹图谱相似度评价系统研究版(2004A),将色谱工作站数据输入中药指纹图谱相似度计算软件,以1号样品为对照药材,选定上述7个共有峰进行谱峰匹配,通过中位数矢量计算得出秦艽样品指纹图谱的共有模式,并以此共有模式为标准,计算各批样品的相似度其结果见表3。由表3可见,用于建立指纹图谱的1-20秦艽药原植物其相似度为0.997~1,平均相似度为0.998。用指纹图谱适用性检验的市售秦艽药材21~29号样品的相似度为0.911~0.999,平均相似度为0.982,而30号青海秦艽药材的相似度为0.555。
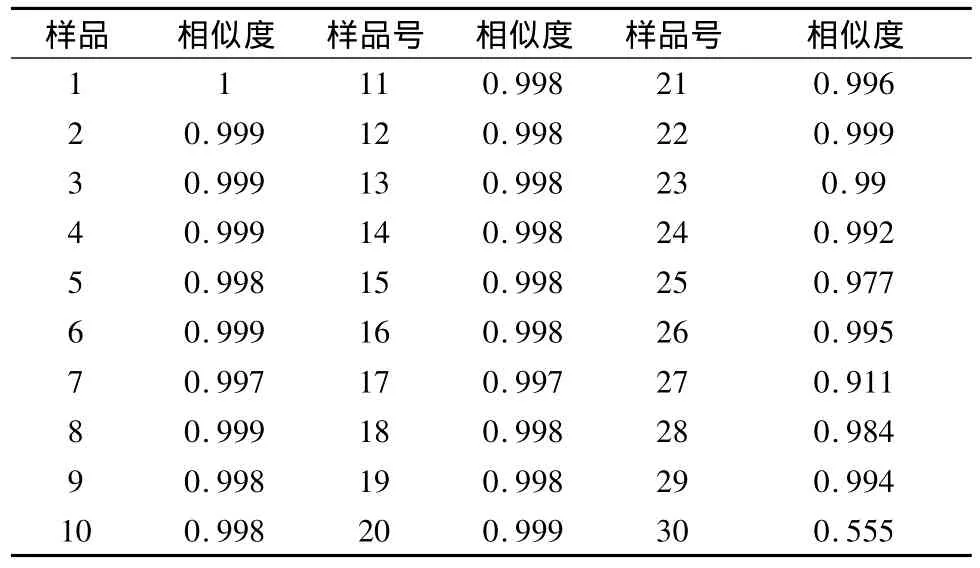
表3 30批秦艽药材的相似度
2.2.7 共有峰峰面积的差异 分别将不同产地秦艽药原植物以及市售秦艽药材HPLC 7个共有峰的峰面积变异系数计算列于表4、5、6。
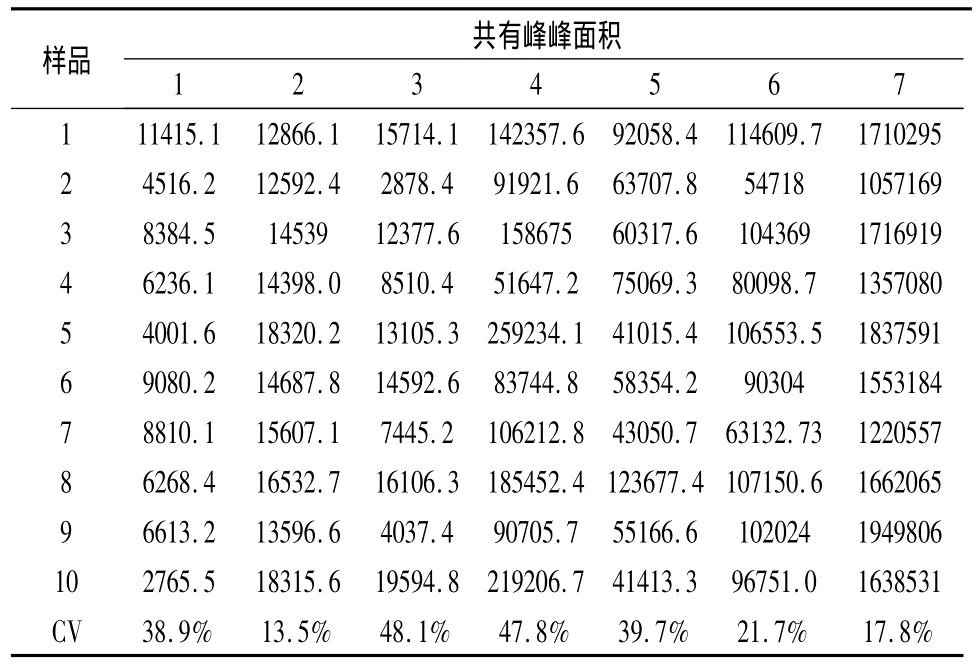
表4 陇县秦艽共有峰面积的变异系数
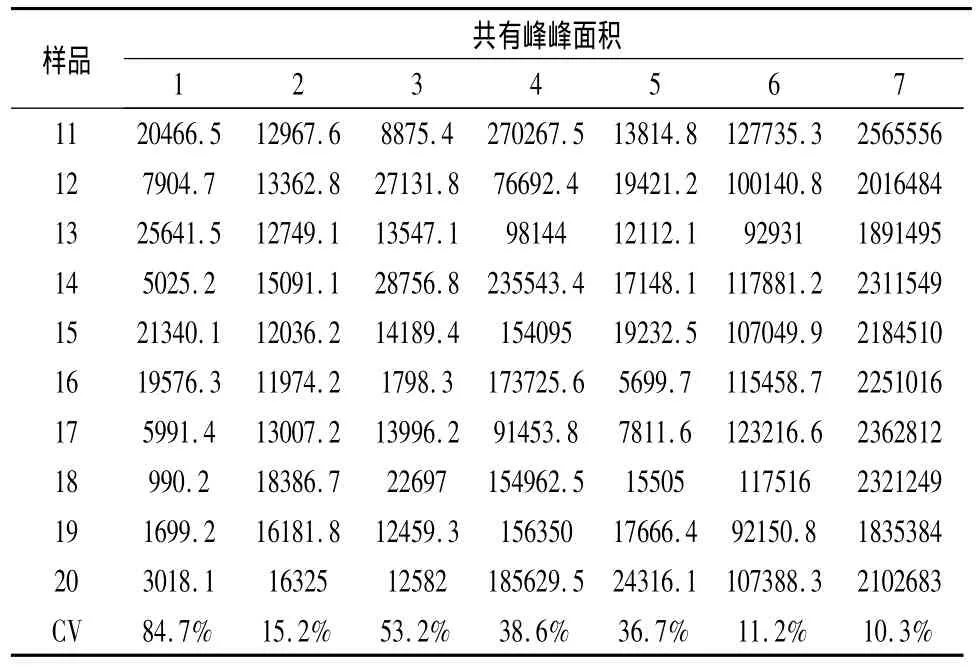
表5 太白秦艽共有峰面积的变异系数
由表4、5可见,两个栽培地中20个样品的7个共有峰的面积之间均存在差异。对于同一个生长地,陇县栽培秦艽2号峰的面积在不同样品之间差异最小,变异系数的为13.5%,3号峰的面积差异最大,变异系数的为48.1%,其余5个共有峰的面积变异系数由小到大依次是7号峰、6号峰、1号峰、5号峰和4号峰;太白栽培秦艽7号峰的面积在不同样品之间差异最小,变异系数的为10.3%,1号峰的面积差异最大,变异系数的为84.7%,其余5个共有峰的面积变异系数由小到大依次是6号峰、2号峰、5号峰、4号峰和3号峰。由此可见,对于同一栽培地的秦艽药原植物中不同个体之间同一个峰的峰面积除太白栽培秦艽中的1号峰和3号峰CV表现出较大的变化外,其余变异系数均在50%以内,表明同一个栽培地秦艽药原植物各共有峰峰面积差异不显著。
因为太白秦艽10株个体之间1号峰和3号峰的变异系数大于50%,表现出在同一生长地内存在较大差异,故为确保实验结果的可靠性,只取2、4、5、6和7号峰5个共有峰与陇县秦艽进行不同生长地药源植物之间的比较,其结果列于表6。
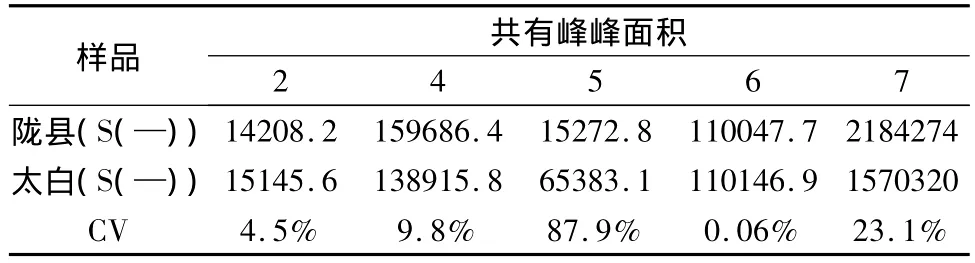
表6 药源植物之间共有峰的变异系数
由表6结果可见,对于陇县和太白两个不同产地的药源植物之间峰面积变异系数最大为5号峰CV为87.9%,其余变异系数均小于25%,表明太白和陇县两地的秦艽药原植物化学成分的差异主要为5号峰。
取2、4、5、6和7号5个共有峰进行药源植物和药材之间共有峰差异的比较,结果见表7。
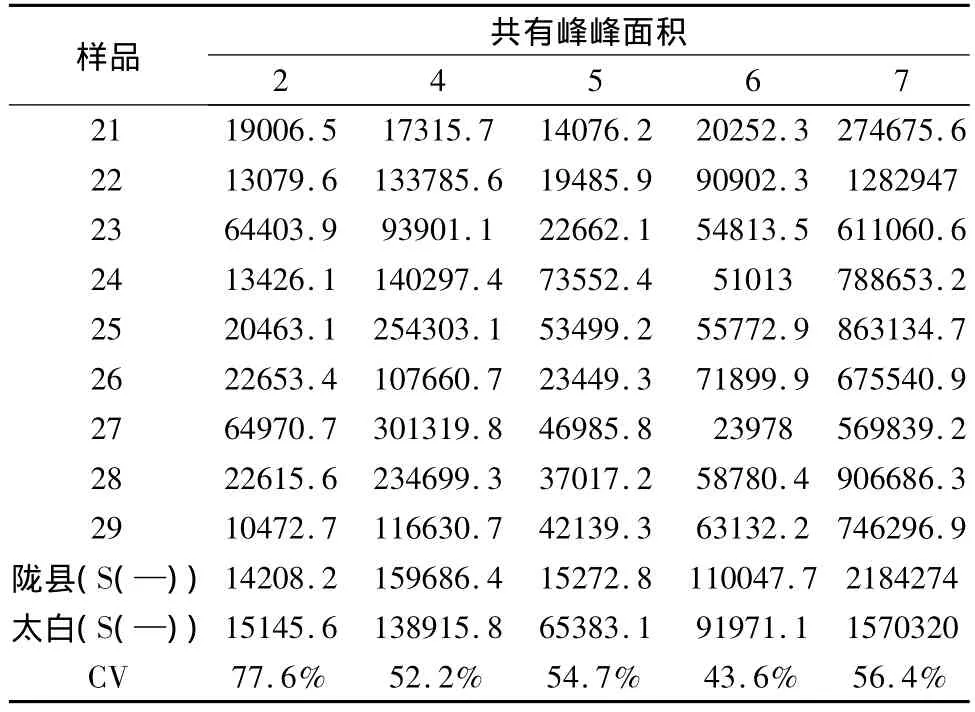
表7 药源植物与药材之间共有峰的变异系数
由表7可见,市售秦艽药材与秦艽药原植物各共有峰面积变异分析结果显示,6号峰的差异最小,变异系数的为46.2%,2号峰的差异最大,变异系数的为77.6%,其余3个共有峰的变异系数由小到大依次是4号峰、5号峰和7号峰。表明市售秦艽药材与药原植物各共有峰之间存在较大差异。
2.3 聚类分析
以1~20个样品的7个共有峰的峰面积和各峰面积占总峰面积的百分数为依据,采用STATISTICA6.0软件,以欧氏距离为测度,进行聚类分析,结果见图3。由图3可见当L=740124.9时,所有20个样本分别聚为两组,陇县栽培秦艽 1、2、3、4、6、7、8、10号样本聚为一组,太白的11~20号样本聚为另一组。特殊的是陇县栽培秦艽5号和9号样本也聚在这一组。
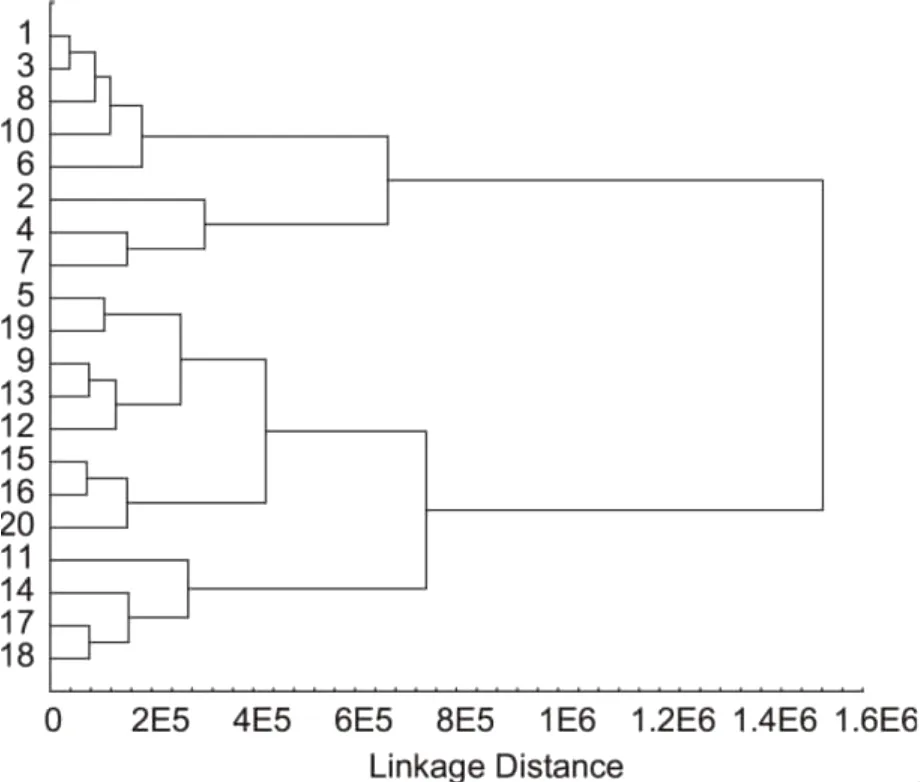
图3 成分指纹图谱聚类图
3 讨论
3.1 龙胆苦苷是秦艽中的主要有效成分,其含量的高低可用于衡量秦艽药材质量的优劣。由太白、陇县药原植物及市售秦艽药材的龙胆苦苷含量分析结果显示,龙胆苦苷含量最高是太白栽培秦艽,其次是陇县栽培秦艽,表明陕西太白、陇县是秦艽的地道产区,而太白更适合于秦艽的生长和栽培。市售秦艽药材龙胆含量远低于太白和陇县秦艽药原植物,推断其原因我们认为:龙胆苦苷为裂环烯醚萜类化合物,该类化合物化学性质活泼,不稳定,易被植物中的酶分解[6]。随着秦艽药材贮存时间的延长这种酶分解结果将逐渐累积,最终可能导致龙胆苦苷含量下降,使得市售秦艽药材与秦艽药原植物之间含量差异。由此反映出秦艽药材应该愈新鲜愈好。
3.2 中医药理论与实践的非线性特点要求综合评价中药质量,色谱指纹图谱(图像)分析是对中药及其制剂进行综合宏观分析的可行性手段之一[7,8],能够较全面地反映药材的成分及特征。本实验通过对秦艽地道产区陕西太白县和陇县秦艽药原植物的高效液相色谱指纹图谱分析,建立陕西秦艽药原植物指纹图谱,并以建立的指纹图谱比较分析了西安药材市场的市售秦艽药材,结果表明,本HPLC指纹图谱分析方法,不仅可以区分和鉴别秦艽药材的真伪,而且还可以判断秦艽药材的质量好坏,可以作为秦艽质量控制的方法。
3.3 石张燕等人对陕西产秦艽质量变异与遗传多样性进行研究,发现陕西省不同产区秦艽药材的质量具有一定的差异[9]。吴迪等人对西部地区濒危药用植物秦艽的质量进行比较研究,发现不同地区秦艽药材的龙胆苦苷含量具有较大差异[10]。吴玉泓等人对不同产地秦艽的质量和遗传多样性进行研究,发现龙胆苦苷的含量有一定的差异[11]。本文研究结果显示,两个不同生长地秦艽药原植物根中无论是龙胆苦苷含量还是其他化合物含量之间均存在差异,差异最大的为5号峰,其次为7号峰龙胆苦苷,与文献报道相同。依据这些差异变化,采用聚类分析可以鉴别陇县和太白两地的秦艽药原植物,判断秦艽药原植物的产地来源。
[1] 权宜淑.中药秦艽的本草学研究[J].西北药学杂志,1997,12(3):113-115.
[2] 刘艳红,李兴丛,刘玉清,等.秦艽中的环烯醚萜甙成分[J].云南植物研究,1994,16(1):85 -89.
[3] 陈千良,石张燕,涂光忠,等.陕西产秦艽的化学成分研究[J].中国中药杂志,2005,30(19):1519 -1522.
[4] 陈千良,石张燕,孙文基.陕西产秦艽高效液相指纹图谱研究[J].西北大学学报:自然科学版,2007,37(2):253 -256.
[5] 李晓蒙,何新荣.秦艽药材HPLC指纹图谱研究[J].中成药,2004,26(1):4 -7.
[6] 罗玉燕,卢成瑛,陈功锡,等.裂环烯醚萜类化合物研究概况[J].食品科学,2010,31(21)431 -436.
[7] 谢培山.中药制剂色谱指纹图谱(图像)鉴别[J].中成药,2000,22(6):391 -395.
[8] 谢培山.中医药传统文化与现代质量控制[J].中国中西医结合杂志,1998,18(11):645 -647.
[9] 石张燕,陈千良,赵宇玮,等.陕西产秦艽质量变异与遗传多样性研究[J].中草药,2010,41(10):1705 -1709.
[10] 吴迪,晋玲,崔治家,等.西部地区濒危药用植物秦艽的质量研究[J].时珍国医国药,2011,22(5):1212 -1213.
[11] 吴玉泓,吴迪,崔治家,等.不同产地秦艽的质量和遗传多样性研究[J].中药材,2011,34(4):517 -519.

