腹泻病人隐孢子虫及其他原虫感染粪样检测分析*
陈韶红,艾 琳,田利光,张永年,童小妹,李 浩,陈家旭
肠道原虫是导致人体腹泻的主要原因之一。临床上引起腹泻的常见肠道原虫病有溶组织阿米巴病、隐孢子虫病、蓝氏贾第虫病等。但近年来,人群隐孢子虫的感染率正逐步上升,由隐孢子虫(cryptosporidium)引起的腹泻逐步增多,我国腹泻病人中隐孢子虫的感染率为0.32%~15.22%[1-2]。自1976年我国报道人隐孢子虫感染后,发现本病是引起旅游者腹泻和夏季腹泻的常见病原,多数表现为慢性腹泻,主要见于免疫功能缺陷者,特别是艾滋病患者中。现临床上检测粪便中隐孢子虫感染的病原学方法主要为改良抗酸染色法和荧光染色法[3-5]。随着免疫和分子检测技术的推广,免疫测定法和PCR技术在检测原虫感染上取得了很大的进展[6-9],本文将经典的传统的病原学检测的金标准,同时运用ELISA法、免疫试条法和FTA巢式PCR法,对临床109例腹泻病人进行隐孢子虫及其他原虫感染情况进行粪样检测分析,进而为该病的诊断、防治提供科学依据。
1 材料与方法
1.1 主要试剂 0.9%生理盐水;2.5%碘液;改良抗酸染色试剂盒(珠海贝索生物技术有限公司BA-4091);金胺酚染色试剂盒(珠海贝索生物技术有限公司BA-4018);隐孢子虫粪抗原检测ELISA试剂盒(德国-R-Biopharm公司);隐孢子虫粪抗原快速检测条(德国-R-Biopharm 公司)。FTA 卡(Whatman公司);FTA 卡洗液 TE buffer(0.01mol/L Tris-HCl,pH 8.0;0.1mmol/L EDTA)(Whatman公司);2×TaqPCR Master Mix(0.1UTaq Polymerase/L、500mol/L dNTP、20mmol/L Tris-HCl (pH8.3)、100mmol/L KCl、3mmol/L MgCl2、其它稳定剂和增强剂)由上海生工生物制品有限公司提供;TAE电泳缓冲液(储备液50×),使用时稀释成(0.5×)即可。
1.2 主要仪器 PCR仪(美国ThermoPX2);凝胶分析成像系统(Bio-RAD公司 Quantity on 4.6.6);低温离心机(美国Thermo公司);直径6mm打孔机(Whatman公司);OLYMPUS BX51显微镜。
1.3 隐孢子虫引物合成 第一轮PCR引物为Ex-Cry1Fa(正向)引物序列为TTCTAGAGCTAATACATGCG(5′-3′),ExCry2Rb(反向)引物序列为CCCACTTCTTCGAAGCAGGA,扩增片段大小为1 330bp;第二轮PCR引物为NesCry3Fa(正向)引物序列为GAAGGGTTGTATTTATTAGATAAA(5′-3′),NesCry Rb(反向)引物序列为 CTCATAAGGTGCTGAAGGAGTA;扩增片段大小为830bp。
1.4 粪便来源 2011年本所检测中心肠道门诊送检腹泻病人粪便109例,其中男性65人,女性44人,年龄在6~65岁,20名上海交通大学学生体检粪便作为正常人对照。
1.5 直接涂片法 滴1滴生理盐水于洁净的载玻片中央,用棉签或牙签挑取绿豆大小的粪便,在生理盐水中调匀,剔除粗大的颗粒和纤维,涂抹成边缘整齐的椭圆形粪膜,镜检。
1.6 碘液染色法 在生理盐水直接涂片上加盖玻片,然后从盖玻片一侧滴1滴碘液,待其渗入后观察;或在同一载玻片上,一侧作生理盐水直接涂片,另一侧作碘液涂片,分别检查滋养体和包囊。
1.7 改良抗酸染色法 滴加A液于粪膜,数分钟后自来水缓慢冲洗;滴加B液于粪膜上,脱色至粉红色为止,自来水缓慢冲洗;滴加C液于粪膜上,1min后自来水缓慢冲洗,自然干燥,油镜检查。
1.8 金胺酚染色法 空气干燥粪便涂片,甲醇固定,金胺酚染液染色10min,自来水漂洗,3%酸性甲醇脱色,0.1%高锰酸钾复染30min,空气干燥,荧光显微镜镜检。
1.9 隐孢子虫粪抗原的ELISA法 在试管中加入1mL样品稀释液,取固态粪便取约50mg置入稀释液中混匀(若液体粪便则取100μL),静置数分钟后,取上清液直接用于检测,在微孔反应板中加入100μL粪便样本的上清液,之后在每个微孔中加入100μL酶标记抗体,室温孵育60min,洗涤液洗5次,加入100μL的底物,避光孵育15min后,加终止液50μL终止反应。同时设有阴性和阳性质控。在酶标仪测定在450nm读取OD值。判断标准:检测值/阴性参考值(P/N)≥2.0为阳性临界值。
1.10 隐孢子虫粪抗原快速试条法 在试管内加1mL粪抗原提取液,加入50mg固态粪便样本(若液态粪便取100μL),沉淀3min,取200μL上清液置于另一干净试管中,浸入检测条,5min后读取结果。结果判断:从粪便样本吸收侧开始依次出现:一条红色检测带,一条蓝色质控带,隐孢子虫阳性可见蓝带和红带;隐孢子虫阴性,仅见蓝带。
1.11 FTA巢式PCR法 用FTA卡提取隐孢子虫DNA,进行巢式PCR
1.11.1 初始PCR(Primary PCR) 反应体系为DNA模板 (制得的FTA滤膜片1片);2×Taq PCR Master Mix 50μL;1%BSA 4μL;10μmol/L引物各2.5μL;ddH2O 41μL。反应条件:94℃预变性4min,94℃变性1min,54℃退火45s,72℃延伸1min,35个循环,72℃延伸8min。扩增产物长度为1℃330bp。
1.11.2 巢式 PCR (Nested PCR) 反应体系为DNA模板 (第一轮PCR产物)1μL;2×Taq PCR MasterMix 50μL;10μmol/L引物各5μL;ddH2O 39μL。反应条件:94℃预变性4min,94℃变性1 min,58℃退火45s,72℃延伸1min,35个循环,72℃延伸8min。扩增产物长度为830bp。
PCR产物琼脂糖电泳凝胶电泳鉴定。结果判断:隐孢子虫PCR扩增产物为830bp。
1.12 统计学分析 采用SAS 9.1软件进行卡方检验和t检验分析。
2 结 果
2.1 109例腹泻病人隐孢子虫及其他原虫的感染情况 109例腹泻病人中男性为65人,女性为44人,年龄在6~65岁,原虫检出阳性率为45%(49/109),感染对男女性别之间感染无显著性差别,(χ2=1.1901,P=0.2753,P>0.05);儿童和成年之间感染无显著性差别(χ2=1.0247,P=0.3144,P>0.05)。
用直接涂片加碘液染色法检测隐孢子虫感染的阳性率为5.5%,溶组织阿米巴原虫感染的阳性率为2.8%,人芽囊原虫感染的阳性率为34.9%,未查见蓝氏贾第鞭毛虫;用改良抗酸加金胺酚染色法(图1,2)检测隐孢子虫的阳性率为8.3%,微孢子虫阳性率为1.8%;隐孢子虫ELISA试剂盒检测隐孢子虫的阳性率为6.4%;免疫试条法(图3)检测隐孢子虫的阳性率为1.8%;巢式PCR法检测隐孢子感染的阳性率为9.1%;同时用5种方法检测隐孢子虫都为阳性的病例只有4例,其余的表现为单项或2项阳性,正常人对照都为阴性;引起腹泻的原虫主要是人芽囊原虫、隐孢子虫和少量的阿米巴原虫及微孢子虫(表1)。
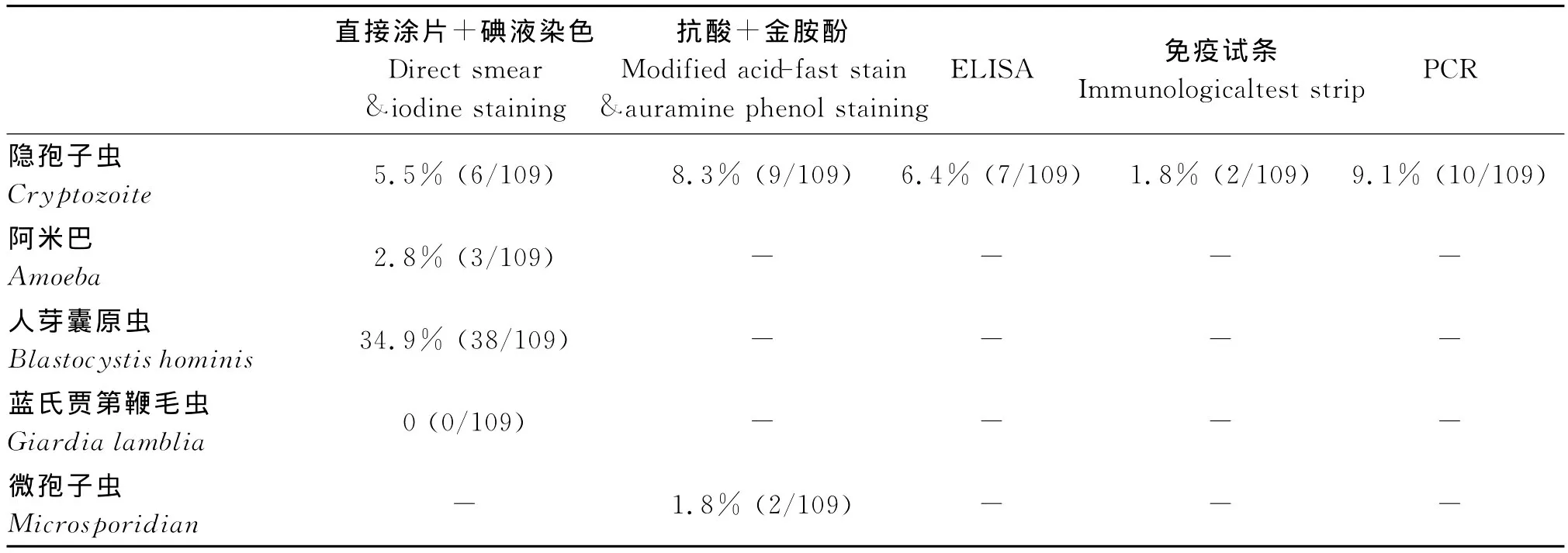
表1 腹泻病人隐孢子虫及其他原虫的感染情况Tab.1 Cryptozoite and other protozoon infection situation from stool of diarrhea patients
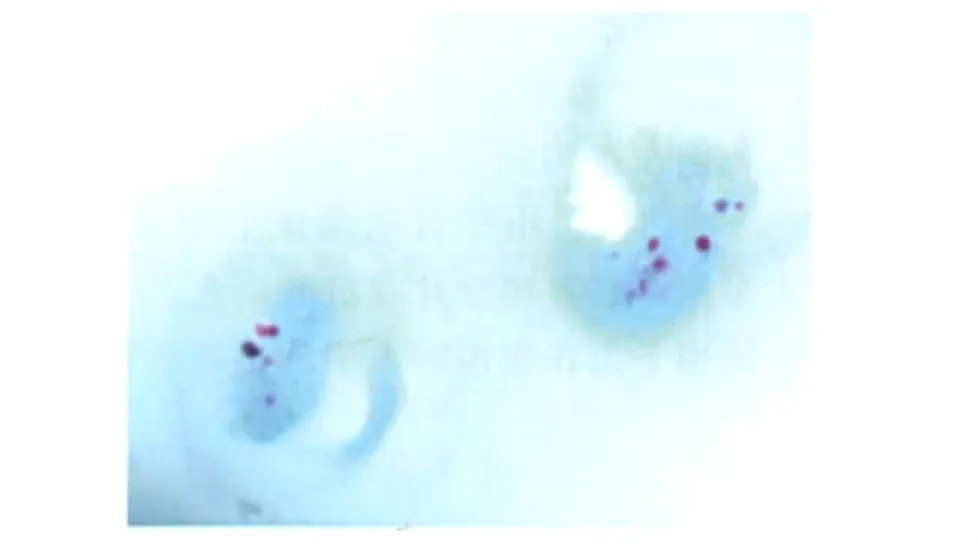
图1 隐孢子虫改良抗酸染色×100Fig.1 Modified acid-fast stain of Cryptosporidium (×100)
2.2 隐孢子虫巢式PCR测序结果 109例临床腹泻病人经巢式PCR检测隐孢子虫感染阳性率为9.1%,10例感染者粪便样品经PCR扩增后进行测序,结果与GenBank中隐孢子虫的序列比对,为微小隐孢子虫(Cryptosporidiumparvum)和猫隐孢子虫(Cryptosporidiumfelis)感染(表2),各样本间序列差异结果比对如图4。

图2 隐孢子虫金胺酚染色×100Fig.2 Auramine phenol staining of Cryptosporidium (×100)

图3 试纸条检测隐孢子虫粪抗原(1,2为阳性,3为阴性)Fig.3 Colloidal gold test paper of fecal antigen of Cryptosporidium1,2:Positive;3:negative.

表2 隐孢子虫感染者粪便样品PCR测序结果Tab.2 PCR and sequencing results of Cryptosporidiuminfection by stool samples
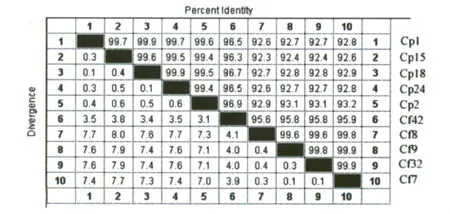
图4 序列比对结果Fig.4 Results of sequence alignment
3 讨 论
人体肠道感染性腹泻大多是由细菌、病毒引起,但近年来由肠道寄生原虫引起的腹泻逐渐增多,肠道寄生原虫属于原生动物亚界,广泛分布于自然界的各种生态环境中,不少原虫既可感染人类,又寄生于一些动物,大多以水作为主要传播载体,是引起腹泻的主要病原体之一。其致病性除了与原虫的种类、寄生数量及毒力有关外,还与个体免疫机能状态有关系。
从2011年本所检测中心门诊的109例肠道腹泻病人粪样的检测分析,发现寄生原虫的虫种主要为人芽囊原虫、隐孢子虫、溶组织内阿米巴原虫和少量的微孢子虫感染,其中人芽囊原虫的感染率最高达到34.9%,说明人芽囊原虫普遍易感,这与地理气候、卫生条件、饮食习惯、营养状况和精神压力度有关[10];从感染阿米巴原虫的患者情况分析,由于多数溶组织内阿米巴感染者临床症状不显著[11],这些慢性病人除腹泻外都无明显的脓血便,仅表现为稀烂便或蛋花样便,因此,临床上应多注意反复多次检测,否则非常容易漏诊;近年来,隐孢子虫病在发达国家和发展中国家的腹泻病人中呈反复上升趋势,对于隐孢子虫的诊断,病原学检查简单方便,但检出率低;而免疫学检查法能提高敏感性,但对抗原要求较高,且很难区分既往感染和现症感染,而隐孢子虫的检测主要是针对粪抗原,免疫酶法和免疫印迹的检出率相对较底。目前采用分子生物学检测具有提高敏感性和特异性[12],但要一定的仪器设备与试剂,检测费用较高,因此,我们同时采用多种联合检测手段进行互补检测,发现联合检测法有利于提高隐孢子虫的阳性检出率,其中以巢式PCR法的检出率最高,经测序分析,病人感染的隐孢子虫为人隐孢子虫和猫隐孢子虫,这可能与患者的饮食习惯和现在盛行的家庭饲养宠物有关。
临床上免疫功能正常的患者,隐孢子虫感染后常表现为“自限性腹泻”,有症状者以腹痛、稀便、水样便多见,若在抗生素治疗无效或低效时,应考虑隐孢子虫感染。有研究者曾对上海某地区的人群进行隐孢子虫感染调查,正常无腹泻人群中隐孢子虫感染率在4.8%[13],结合我们的实验观察结果分析,在腹泻病人中除人牙囊原虫感人率较高外,其次就为隐孢子虫,我们在腹泻病人中发现隐孢子虫感染率高达8.3%~9.1%。由于目前临床上未采用联合检测法,大多用的是直接涂片或抗酸染色,十分容易漏检,预示隐孢子虫在腹泻病人中的感染率将更高。
[1]Wu GL.Parasitology of humans[M].3rd edition.Beijing:People's Medical Publishing House,2005:272.(in Chinese)吴观陵.人体寄生虫学[M].3版.北京,人民卫生出版社,2005:272.
[2]Cai R,Li CP,Wang J,et al.Huainan area withCryptosporidiuminfection in patients with diarrhea of survey[J].Trop Dis Parasitol,2003,1(1):26-28.(in Chinese)蔡如,李朝品,王健,等.淮南地区腹泻患者因孢子虫感染的调查[J].热带病和寄生虫学,2003,1(1):26-28.
[3]Hou WD,Jian FC,Zhang LX,et al.An acid dyes to waterborne cryptosporidium infection inspection of the capsule [J].Husbandry Vet Henan,2006,27(11):6-8.(in Chinese)侯卫东,菅复春,张龙现,等.抗酸染色法对隐孢子虫卵囊的检查[J].河南畜牧兽医,2006,27(11):6-8.
[4]Rusnak J,Hadfield TL,Rhodes MM,et al.Detection ofCryptosporidiumoocysts in human fecal specimens by an indirect immunofluorescence assay with monoclonal antibodies[J].J Clin Microbiol,1989,2795:1135-1136.
[5]Montemayor M,Galofre B,Ribas F,et al.Comparative study between two laser scanning cytometers and epifluorescence microscopy for the detection ofCryptosporidiumoocysts in water[J].Cytometry A,2007,71(3):163-169.DOI:10.1002/cyto.a.20373
[6]Rimhanen-Finne R,Enemark HL,Kolehmainen J,et al.Evaluation of immunofluorescence microscopy and enzyme-linked immunosorbent assay in detection ofCryptosporidiumandGiardiainfections in asymptomatic dogs[J].Vet Parasitol,2007,145(3):345-348.DOI:10.1016/j.vetpar.2007.01.008
[7]Ungar BL.Enzyme-linked immunoassay for detection ofCryptosporidiumantigens in fecal specimens[J].J Clin Microbiol,1990,28(11):2491-2495.
[8]Rosenblatt JE,Sloan LM.Evaluation of an enzyme-linked immunosorbent assay for detection ofCryptosporidiumspp.in stool specimens[J].J Clin Microbiol,1993,3(6):1468-1471.
[9]Spano F,Putignanil M,Clauchin J,et al.PCR-RFLP analysis of theCryptosporidiumoocyst wall protein COWP gene discriminates betweenC.wrairiandC.parvumand betweenC.Parvumisolates of human and animal origin[J].FEMS Microbiol Lett,1997,150:209-217.
[10]Li CP,Wang J.Epidemiology investigation ofBlastocystis hominisin Huainan areas[J].J 4th Military Med Univ,2002,23(16):1480-1482.(in Chinese)李朝品,王健.淮南地区人芽囊原虫感染的流行病学调查[J].第四军医大学学报,2002,23(16):1480-1482.
[11]Gathiram V,Jackson TF.A longitudinal study of asymptomatic carriers of pathogenic zymodemes ofEntamoebahistolytica[J].S Afr Med J,1987,72(10):669-672.
[12]Li W,Wu K,Zhang XC,et al.Detection ofCryptosporidiumby nested PCR assay[J].Chin J Vet Sci,2010,6(30):779-783.(in Chinese)李巍,吴康,张西臣,等.应用巢式PCR检测隐孢子虫[J].中国兽医学报,2010,6(30):779-783.
[13]Zhou HF,Zhu M,Yuan JL,et al.A survey onCryptosporidiumparvumcryptosporidiosis in different people of Luwan district,Shanghai[J].Shanghai J Prev Med,2005,11(9):21-23.(in Chinese)周红芳,朱民,袁家麟,等.上海市卢湾区不同人群隐孢子虫感染情况调查[J].上海预防医学杂志,2005,11(9):21-23.

