肝硬化患者外周血IL-8及其mRNA表达与HBV载量相关性*
王 健,毕惠娟
肝硬化(cirrhosis)是一种以肝细胞弥漫性变性坏死,伴大量炎症细胞浸润,继而出现纤维组织增生和肝细胞结节状再生的慢性肝病。HBV感染肝细胞后,启动以细胞免疫为主的免疫应答[1],当免疫应答过强,呈现免疫损伤;当免疫应答过弱,呈现免疫耐受。IL-8是首个被发现ELR+CXC趋化因子,不仅对中性粒细胞有趋化作用,还对T细胞、单核细胞等有趋化作用。单核-巨噬细胞、T淋巴细胞、中性粒细胞以及HBV感染的肝细胞等均能分泌IL-8,LPS、IL-1、TNF-α可刺激其大量表达。肝内单核-巨噬细胞和血窦内皮细胞可释放多种促炎症性细胞因子如IL-6、IL-8等,在清除HBV感染及介导肝细胞免疫损伤和修复中起重要作用[2-4]。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)是多种免疫细胞的集合体,含有多种免疫活性细胞,主要为T淋巴细胞,可分泌IL-8等多种细胞因子。为探讨外周血IL-8在肝硬化炎性损伤机制中的作用,本文选择典型的肝硬化患者65例,检测其外周血IL-8及其mRNA表达,探讨其与HBV载量相关性,现将结果报道如下。
1 材料和方法
1.1 临床资料 65例慢性乙肝肝硬化患者系2009年12月至2010年10月我校教学医院收治的病人,其中男36例,女29例,年龄(34~67)岁,平均(53.4±9.1)岁。肝硬化代偿期36例,男21例,女15例,年龄(34~61)岁,平均年龄(51.7±9.2)岁。肝硬化失代偿期29例,男15例,女14例,年龄(39~67)岁,平均年龄(55.5±8.5)岁。临床诊断均符合中华医学会肝病学分会2010年推荐的慢性乙型肝炎防治指南的诊断标准[5]。另选36例本市中心血站体检正常的献血者为正常对照,其中男22例,女14例,平均年龄(32±6.1)岁。
1.2 试剂与仪器 Ficoll-Hypaque液(上海试剂二厂);Trizol试剂(美国Invitrogen公司);cDNA 合成试剂盒(上海申能博彩生物科技有限公司);Light Cycler Fast Start DNA Master SYBR GreenⅠ(德国Roche公司);IL-8酶联免疫检测试剂盒(法国DIACLONE公司);752-B型紫外可见光分光光度计(上海光学仪器厂);Eppendorf 5415D高速离心机(德国Eppendorf公司);TaKaRa梯度PCR仪TP600(日本 TaKaRa公司);iCycle○R荧光实时定量PCR仪(美国Bio-Rad公司);Hema-2000凝胶扫描分析系统(珠海Hema公司);EXL-808全自动酶标分析仪(美国Bio-Teck公司)。
1.3 方法
1.3.1 标本采集 分别采集入选患者晨起空腹静脉血5mL,分别置2支含肝素的无菌Eppendorf管和2支洁净的Eppendorf管。肝素抗凝血以Ficoll-Hypaque常规分离PBMCs,普通管常规分离血清备检。
1.3.2 HBV-DNA检测 取50μL待测血清加等体积的细胞裂解液,常规提取模板DNA,分别采用梯度PCR法、荧光定量PCR法检测HBV-DNA,具体按试剂盒操作说明操作。HBV上下游引物见表1。PCR扩增参数依次为94℃预变性5min,94℃30s,55℃30s,72℃30s,共30个循环,72℃延伸5min,4℃保存,置1.2%TAE琼脂糖凝胶(含0.51 μg/mL EB)常规电泳,紫外透视仪下判断结果,核酸凝胶图像分析系统密度扫描摄像。
1.3.3 血清IL-8检测 采用ELISA法。以试剂盒提供标准品绘制标准曲线,每批检测设空白、阴性、阳性对照各2孔,取100μL待测血清和100μL辣根过氧化物酶标记的抗趋化因子单克隆抗体,分别加至包被有相应趋化因子单克隆抗体的酶标反应孔内,37℃孵育1h,磷酸盐(PBS)缓冲液洗涤5次,加100μL底物3-3甲基苯并噻唑啉-6-磺酸盐,室温30min,加2mol/L H2SO4终止反应,置EXL-808全自动酶标分析仪上(450±2)nm处读取吸光度(A)值,每孔测定2次,取均值,依标准曲线确定血清IL-8含量。
1.3.4 PBMCs分离纯化及其总RNA提取 取1 mL肝素抗凝全血,加入等体积Hank’s液稀释后置含2mL Ficoll-Hypaque分离液试管中,2 500r/min密度梯度离心20min,收集云雾状单个核细胞层,用RPMI 1640完全培养液1 500r/min离心10 min洗涤细胞2次,收集沉淀细胞,以RPMI 1640完全培养液调整悬浮细胞至(1-2)×106/mL。以Trizol抽提PBMCs总RNA,操作严格按照RNA提取试剂盒说明书进行,分别通过1.2%琼脂糖凝胶电泳和紫外分光光度仪,检测所得总RNA的质量与浓度。
1.3.5 总RNA浓度及纯度鉴定 取上述提取的总RNA 3μL加1μL溴酚蓝,置1.2%TAE琼脂糖凝胶(含0.51μg/mL EB)上样孔内,常规电泳,5~6V/cm,25min,紫外透射仪下核酸凝胶图像分析系统密度扫描摄像,鉴定总RNA完整性。以紫外分光光度法检测 OD260/OD280值,检测总 RNA纯度。
1.3.6 引物、探针设计与合成根据GenBank中人IL-8mRNA序列,以Primer Express软件设计基因的特异性引物和探针,以磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase (GAPDH))为内参;HBV引物选自其C区及前C区,引物和探针序列(见表1)。所有引物和探针均购自上海生工生物工程技术服务有限公司。
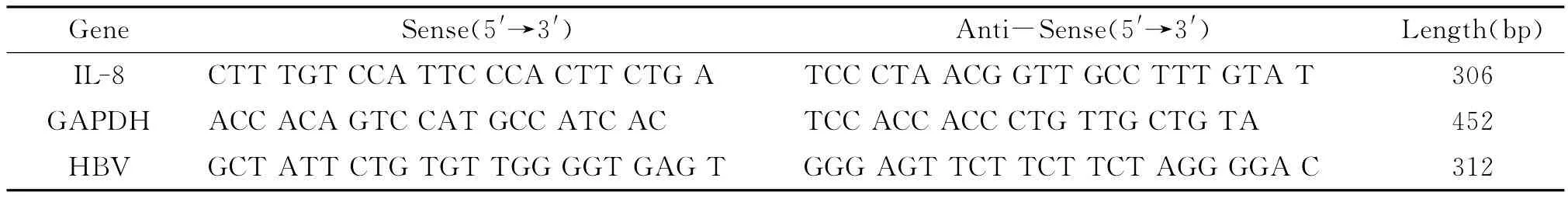
表1 IL-8和GAPDH引物和探针序列Tab.1 The primer sequences of the IL-8and GAPDH
1.3.7 cDNA合成 采用上海申能博彩公司的AMV第一链cDNA合成试剂盒,以随机引物,将从PBMC中提取的总RNA逆转录为cDNA。反应体系为:RNase free water 2μL,5×RT buffer 4μL,dNTP Mix(10mmol/L)2μL,RNase inhibitor(20 U/μL)1μL,Oligo(dT)18(0.5μg/μL)1μL,总RNA 8μL,AMV RT(10U/μL)2μL,共20μL。37℃60min,70℃10min,瞬时离心,将逆转录的cDNA分装,置-20℃冰箱备用。
1.4 IL-8mRNA检测 采用荧光定量PCR法,取逆转录的cDNA1∶5稀释,以此为模板,采用SYBR GreenⅠ荧光标记法检测PCR产物,总反应体系为25μL,包括上下游引物各0.4mmol/L,MgCl22.5 mmol/L,Ex-Taq 1.25U,dNTPs 2mmol/L,1×PCR buffer(500mmol/L KCl,100mmol/L Tris,2 μg/L gelatin,pH8.3),2×SYBRTMGreenⅠ液。2 μL标准品或模板cDNA。PCR扩增反应参数依次为94℃预变性5min,94℃30s,55℃30s,72℃30 s,共30个循环,然后72℃延伸5min。为克服系统误差,设GAPDH为参照,以logcDNA/logGAPDH比值代表其最终mRNA水平。
1.5 统计学处理 计量资料以(x±s)表示。两组间差异比较采用t检验或t’检验,多组间差异比较采用单因素方差分析,以α=0.05为检验水准,当P<0.05时有统计学意义。计数资料以百分率表示,采用χ2检验,以α=0.05为检验水准,当P<0.05时有统计学意义。以上数据均采用SPSS16.0统计软件分析。采用SPSS16.0统计软件分别对IL-8、IL-8mRNA与HBV载量间相关性进行作图。相关性分析:0﹤|r︱≦0.3为微弱相关,0.3﹤|r︱≦0.5为低度相关,0.5﹤|r︱≦0.8为显著相关,0.8﹤|r︱≦1为高度相关。
2 结 果
2.1 总RNA鉴定 取上述提取的总RNA 3μL加1μL溴酚蓝,置1.2%TAE琼脂糖凝胶(含0.51 μg/mL EB)上样孔内,常规电泳,5~6V/cm,25 min,核酸凝胶图像分析系统紫外透射仪下密度扫描摄像,可见清晰的28S、18S、5.8S三条带,且28S条带密度是18S条带密度的2倍以上,无DNA杂带,提示所得总RNA完整性好,可满足后续实验要求。取1μL总RNA,用DEPC水按1:250稀释,紫外分光光度计测定OD260/OD280值,该值介于1.8~2.0,表示RNA纯度较高,可满足后续实验要求。
2.2 IL-8及其mRNA表达 肝硬化患者外周血IL-8及其mRNA水平较对照组显著升高,差异有显著性(P<0.01),且失代偿期较代偿期水平明显升高,差异有统计学意义(P<0.05,P<0.01),见图1-2。
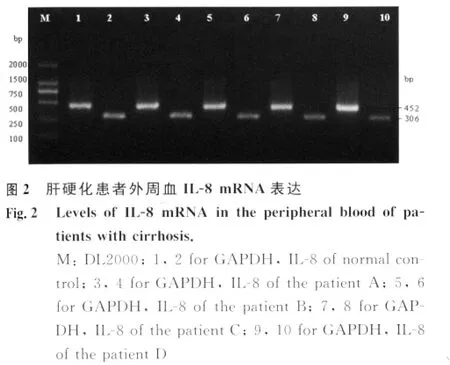
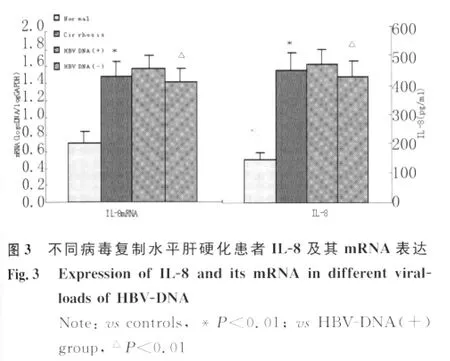
2.3 IL-8及其 mRNA与外周血 HBV-DNA关系肝硬化患者 HBV-DNA(+)组血清IL-8及PBMCs内IL-8mRNA表达水平均显著高于 HBVDNA(-)组(P<0.01),见图3。
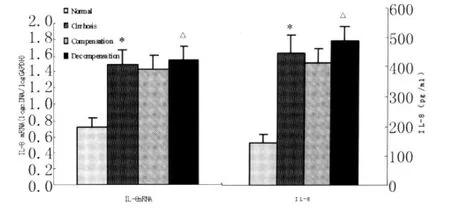
图1 肝硬化患者外周血IL-8及其mRNA表达Fig.1 Levels of IL-8and its mRNA in the peripheral blood of patients with cirrhosis.Note:vs controls,*P<0.01;vs compensate,△P<0.05
3 讨 论
IL-8是一种具有高度活性的小分子多肽,是参与抗病毒、抑细菌等炎性反应的重要调节因子,单核-巨噬细胞、T淋巴细胞及中性粒细胞及HBV感染的肝细胞等均可分泌IL-8,LPS、IL-1、TNF-α及HBX蛋白等可刺激其大量表达[6],其与 CXCR1、CXCR2结合可趋化表达相应受体的炎症细胞定向迁移至感染部位活化聚集,产生免疫应答或炎症反应,发挥抗炎作用[7];同时,亦可伴随着一定组织的损伤[8]。HBV感染引起的肝硬化的发病机制极其复杂,现多认为宿主的细胞免疫调节紊乱所致的免疫病理损伤是其主要致病机制。国内外一些研究表明,肝硬化患者肝细胞损害与肝内单核-巨噬细胞、淋巴细胞、血窦内皮细胞等释放的促炎性细胞因子密切相关,在清除HBV感染及炎症介导的免疫损伤中起重要作用[9]。
本文研究结果显示,肝硬化患者血清IL-8及PBMCs内IL-8mRNA水平较对照组明显升高,差异有统计学意义(P<0.01),进一步研究发现肝硬化失代偿组较代偿组升高更明显,差异有统计学意义(P<0.05),提示IL-8及其mRNA表达与肝硬化病程有关。通常情况下,门静脉系统和体循环中细胞内毒素主要由肝脏解毒、排泄。肝硬化时,局部存在明显的肝内坏死灶和纤维分隔带,还伴随一定的门脉高压,使门脉血流动力学发生紊乱,有利于肠道菌和抗原性异物侵入,这些肠道菌释放内毒素(LPS),LPS作用于肝内Kupffer细胞,使其释放IL-8、IL-6、TNF-α、内皮素等,这些因子共同参与激活肝脏星形细胞,不仅介导局部和全身的炎症反应,还使细胞外间质合成分泌增加,加速肝硬化进程,此与Zimmermann等[10]报道结果类似。IL-8是一种多源性来源的促炎反应细胞因子,除肝细胞本身合成分泌IL-8外,HBV可诱导肝细胞合成大量TNF-α,过量的TNF-α可进一步刺激肝细胞、Kupffer细胞、PBMCs、内皮细胞等合成和释放大量的IL-8。同时肝硬化患者存在一定程度肠内菌群紊乱,部分肠道菌群产生LPS释放入血,其与TNF-α共同刺激单核细胞、巨噬细胞、血管内皮细胞等合成分泌IL-8,使血清IL-8水平偏高[11]。此外,肝硬化患者肝脏纤维组织增生可合成多种细胞外基质(ECM),并释放致纤维化因子 TGF-β和 MCP-1、MIP-2、IL-8等趋化因子,使血清IL-8水平进一步升高,呈现明显炎症表现。随着疾病进程进展,肝细胞受损加重,全身高动力循环,门脉高压,多系统受累,血清IL-8水平不断升高,以失代偿期水平最高。在外周血高浓度IL-8的趋化作用下,大量淋巴细胞、单核细胞等炎症细胞聚集至肝脏感染部位,产生免疫应答或炎症反应[12],在清除病毒感染的同时,又可分泌更多IL-8等炎症因子,进一步诱导单核细胞、淋巴细胞等在肝脏内的聚集活化,反复的炎症可刺激肝星状细胞分泌大量胶原蛋白,促进肝脏纤维化进程,参与肝硬化疾病的进展[13]。
HBV复制是诱导炎症的关键因素。进一步实验结果显示,肝硬化患者病毒复制组外周血IL-8及其mRNA水平较非复制组明显升高,差异有统计学意义(P<0.01),提示IL-8表达水平升高与病毒复制诱导的局部炎症反应程度有一定关系。HBVDNA作为机体免疫系统抗炎免疫应答的启动因素,除可诱导肝细胞大量合成TNF-α外,还可作为强刺激剂,直接刺激肝脏内皮细胞及单核-巨噬细胞分泌过量的TNF-α,进而诱导肝细胞、枯否细胞及PBMCs、内皮细胞等合成和释放大量的IL-8。此外,HBV-DNA还可侵染 PBMCs[14],可导致 Th1、Th2细胞数量及细胞功能的改变,主要表现为Th1细胞数量减少、Th1/Th2细胞比例降低,Th1细胞功能低下,Th2细胞功能相对亢进[15]。Th1细胞功能低下有利于侵染入PBMCs内病毒的继续增殖,持续复制的病毒进一步诱导IL-8表达,使血清IL-8维持在较高水平,高水平IL-8诱导单核细胞、淋巴细胞等在肝脏内的聚集活化,使肝脏纤维组织增生,并合成分泌多种ECM,使肝硬化迁延反复、递进发展。Bonecchi等[16]体外研究证实,在细胞培养初期的4h,基于6.2ng/mL的 CXCR1和8.3ng/mL的CXCR2浓度的情况下,Th2细胞因子如IL-4和IL-13可显著增强转录活性,诱导并上调体内单核细胞、淋巴细胞等表面CXCR1的表达,促进IL-8的分泌和释放。
综上所述,肝硬化患者外周血IL-8及其mRNA水平明显升高,并与病毒复制及肝硬化病程有一定关系。HBV作为启动炎症的关键因素,诱导局部和全身的单核-巨噬细胞、淋巴细胞活化,促进炎症反应的形成。IL-8一方面通过趋化中性粒细胞、单核细胞等,释放其它促炎性因子,加重炎症反应;另一方面通过激活Kupffer细胞、单核细胞、淋巴细胞等,在清除HBV感染肝细胞的同时,刺激纤维组织增生,加重肝细胞损伤和炎症反应,在肝炎后肝硬化发病机制中起重要作用。抑制或减少IL-8过度表达,可减轻炎性损伤,延缓肝硬化进程。
[1]Roman S,Panduro A,Aguilar-Gutierrez Y,et al.A low steady HBsAg seroprevalence is associated with a low incidence of HBV-related liver cirrhosis and hepatocellular carcinoma in Mexico:a systematic review[J].Hepatol Int,2009,3(2):343-355.DOI:10.1007/s12072-008-9115-9
[2]Oo YH,Shetty S,Adams DH.The role of chemokines in the recruitment of lymphocytes to the liver[J].Dig Dis,2010,28(1):31-44.DOI:10.1159/000282062
[3]Bizzarri C,Beccari AR,Bertini R,et al.ELR+CXC chemokines and their receptors(CXC chemokine receptor 1and CXC chemokine receptor 2)as new therapeutic targets[J].Pharmacol Ther,2006,112(1):139-149.DOI:10.1016/i.pharmthera.2006.04.002
[4]Wang J,Wang PP,HU XB,et al.Expression of IL-8mRNA in liver biopsy tissue of patients with hepatocirrhosis[J].Chin J Microbiol Immunol,2008,28(3):269-272.(in Chinese)王健,王平平,胡孝彬,等.肝硬化患者肝活检组织中IL-8mRNA表达[J].中华微生物学和免疫学杂志,2008,28(3):269-272.
[5]Chinese Society of Hepatology and Chinese Society of Infectious Diseases,Chinese Medical Association.The guideline of prevention and treatment for chronic hepatitis B (2010version)[M].Chin J Hepatol,2011,19(1):13-24.DOI:10.3760/cma.j.issn.1007-3418.2011.01.007 (in Chinese)中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南[M]2010版.中华肝脏病杂志,2011,19(1):13-24.DOI:10.3760/cma.j.issn.1007-3418.2011.01.007
[6]Bi HJ,Wang J.Expression of ELR+CXC chemokines and their receptors in patients with chronic hepatitis B[J].Chin J Public Health,2010,26(10):1333-1335.(in Chinese)毕惠娟,王健.慢性乙肝患者ELR+CXC趋化因子及其受体表达[J].中国公共卫生,2010,26(10):1333-1335.
[7]Bi HJ,Wang J.Structure and function of CXCR1,CXCR2and their ligands[J].Immunol J,2010,26(12):1091-1095.DOI:CNKI:SUN:MYXZ.0.2010-12-024(in Chinese)毕惠娟,王健.CXCR1、CXCR2及其配体的结构和功能[J].免疫学杂志,2010,26(12):1091-1095.DOI:CNKI:SUN:MYXZ.0.2010-12-024
[8]Murdoch C,Finn A.Chemokine receptors and their role in inflammation and infectious deisease[J].Blood,2000,95(10):3032-3043.
[9]Wang J,Zhao JH,Wang PP,et al.Expression of CXC chemokine IP-10in patients with chronic hepatitis B[J].Hepatobiliary Pancreat Dis Int,2008,7(1):45-50.
[10]Zimmermann HW,Seidler S,Gassler N,et al.Interleukin-8is activated in patients with chronic liver diseases and associated with hepatic macrophage accumulation in human liver fibrosis[J].PLoS One,2011,6(6):e21381.DOI:10.1371/journal.pone.0021381
[11]Goral V,Atayan Y,Kaplan A.The relation between pathogenesis of liver cirrhosis,hepatic encephalopathy and serum cytokine levels:what is the role of tumor necrosis factor alpha[J]?Hepatogastroenterology,2011,58(107-108):943-948.
[12]Zhang JY,Zou ZS,Huang A,et al.Hyper-activated pro-inflammatory CD16monocytes correlate with the severity of liver injury and fibrosis in patients with chronic hepatitis B[J].PLoS One, 2011, 6 (3): e17484. DOI: 10.137/journal.pone.0017484
[13]Clement S,Pascarella S,Conzelmann S,et al.The hepatitis C virus core protein indirectly induces alpha-smooth muscle actin expression in hepatic stellate cells via interleukin-8[J].J Hepatol,2010,52(5):635-643.DOI:10.1016/j.hep.2009.10.035
[14]Wang J,Wang Yu,Xiang GJ.Influence of PBMC infected by HBV on the expression of CD25mRNA[J].Chin J Microbiol Immunol,2007,27(6):523-524.(in Chinese)王健,王瑜,项桂菊.HBV感染PBMC后对宿主细胞CD25 mRNA表达的影响[J].中华微生物学和免疫学杂志,2007,27(6):523-524.DOI:CNKI:SUN:ZHINS.0.2007-06-013
[15]Li WY,Jiang YF,Jin QL,et al.Immunologic characterization of posthepatitis cirrhosis caused by HBV and HCV infection[J].J Biomed Biotechnol,2010,2010:138237.DOI:10.1155/2010/138237
[16]Bonecchi R,Facchetti F,Dusi S,et al.Induction of functional IL-8receptors by IL-4and IL-13in human monocytes[J].J Immunol,2000,164(7):3862-3869.

