人棘球蚴病血清学诊断试剂检测效能评价*
王立英,田 添,伍卫平,曹建平
棘球蚴病(echinococcosis)是由带科棘球属的棘球绦虫的幼虫寄生所致的人兽共患寄生虫病,俗称包虫病(hydatidosis)。该病潜伏期较长,早期无明显临床症状,所以多数患者发现便是中晚期,给治疗带来很大困难。血清学诊断是进行人群筛检、早期发现患者的重要手段[1]。为了解我国现有血清学诊断试剂现状,为全国中央转移支付地方棘球蚴病防治项目进行人群血清流行病学调查与监测,筛选适宜的检测试剂提供参考。中央补助地方棘球蚴病防治项目办公室对现有的棘球蚴病血清学诊断试剂检测效能进行评价,报告如下。
1 材料与方法
1.1 标本血清 共收集400份,其中阳性标本血清288份。其中186份为手术诊断病例,手术病人血清要求术前采血或术后3天内进行采血;其余102份为临床诊断病例,即具有棘球蚴病典型影像特征,用B超进行了明确诊断分型,而且用2种以上血清学方法同时进行辅助诊断为阳性的病例。阳性血清中包括囊型包虫病病人血清191份,其中100份来自新疆自治区,另外91份来自青藏高原地区;泡型包虫病病人血清95份,来自青藏高原;混合型包虫病病人血清2份,来自青藏高原。阴性血清72份,为采自棘球蚴病非流行区的正常人血清。另外,为考察检测试剂的交叉反应性,收集确诊囊虫病病人血清40份,其中29份来自山东、11份来自河南。
所有测试用标本血清均及时严格按要求进行处理保存,在测试前未经反复冻融。
1.2 参评试剂 在全国范围内收集已经应用于防治实践或者实验室研制比较成熟的血清学诊断试剂,同时收集参评试剂的有关信息,包括试剂盒/方法名称、免疫学方法、个体检测所需血清量、检测所需特殊试剂或仪器设备、单价、年产量等信息。最后共确定相对较优的9种试剂参加测评。
1.3 方法
1.3.1 组织方法 本次测评遵循公开、公平、公正的原则。采用双盲法进行测评,即测评工作小组人员和参加测试人员均不知道待测血清的真实信息。由项目办公室人员预先建立待测血清原始数据库,将所有血清样本信息录入后进行随机编号,将编号后的待测血清序号交给测评工作小组作为本次测试样本的原始序号,然后由测评工作小组组织人员按照参评试剂的血清用量对400份待测血清样本进行分装,共分成A、B、C、D、E、F、G、H、I共9组,为体现公平对每组血清采用不同随机数字编号。分装好之后进行集中封存。
1.3.2 检测方法 测评工作小组负责提供各参评单位提出的测评所需的场地要求和设备条件。每种试剂由各试剂公司或研制单位的专门技术人员随机抽取组号,严格按照试剂说明书要求进行各自的规范化检测操作。血清用量:A~F为10mL;G~J为20mL。
1.3.3 质量控制 成立由非参评单位人员组成的测评工作小组,负责测评工作的组织实施和测试现场监督工作。测评工作小组的核心机构为试剂测评评委会,由3人组成。其中来自试剂采购使用方的代表两人,非试剂生产方亦非试剂使用方的第三方代表一人。测评开始前,评委会主席宣读测评程序和注意事项。每种测评试剂以抽签方式分配测试样本和工作台。评委会每人随机抽取3个组负责测试监考工作,并记录每个组测出的有效样本数、所用人时数、以及相关大型设备的使用情况等。对照有关试剂的技术指标全程考察,对测试结果进行复核,必要时重复进行测试。各参评单位的实验操作人员记录测试结果,结果只能为阳性或者阴性,没有结果的样本数原则上不得多于2%,否则结果作废。测试结束,测试人员认真核对结果签字后送至测评工作小组,在测试人员的监督下,由工作组人员采取一人录入、两人核对的方式将数据按每个组的顺序录入测试结果数据库。同时对各组的原始记录结果进行封存,由本次测评主办单位棘球蚴病项目防治办公室归档。
1.3.4 数据分析 数据录入后,由项目办公室人员用SPSS软件统计分析。计算了反映试剂检测效能的有关指标:敏感性、特异性、正确指数、阳性预测值、阴性预测值、一致率以及与囊虫病的交叉反应率。由于参评的试剂中目前还没有较为成熟的可以区分囊型包虫病和泡型包虫病的检测试剂,所以没有进行分型统计。另外,每种试剂对于不同来源的囊型包虫病病人血清的检测结果没有统计学差异,所以没有区分标本血清来源地进行统计。以试剂A的检测结果为例(表1),各项指标的计算方法如下。
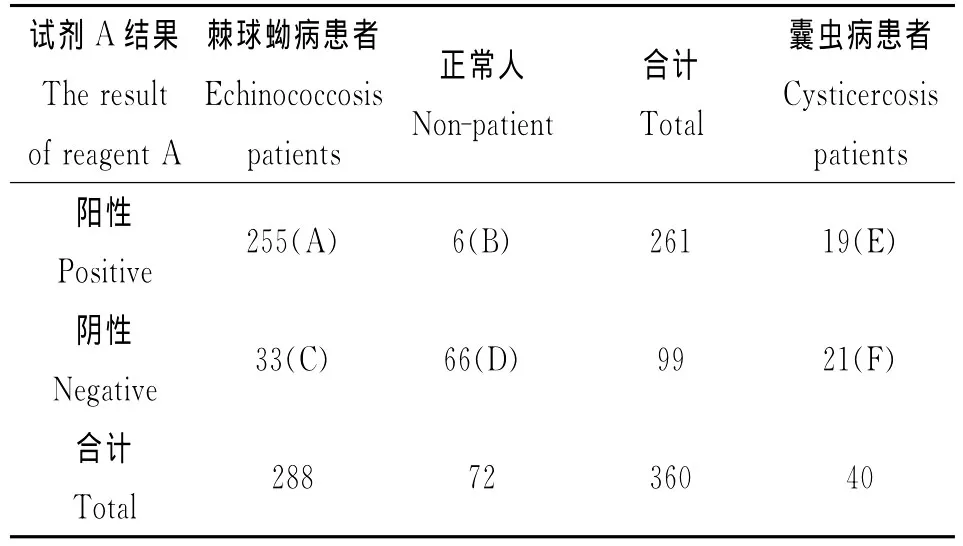
表1 试剂A的检测结果Tab.1 The result of reagent A
灵敏度=A/(A+C)=255/288×100%=88.5%;
特异度=D/(B+D)=66/72×100%=91.7%;
阳性预测值=A/(A+B)=255/261×100%=97.7%;
阴性预测值=D/(C+D)=66/99×100%=66.7%;
正确指数=灵敏度+特异度-1=0.802;
一致性=[A×(B+D)+D×(A+C)]/[2×(A+C)×(B+D)]=90.1%(考虑到阳性样本与阴性样本的数量不同,对此指标的计算进行了加权调整,更能综合反映敏感性和特异性);
囊虫病交叉反应率=E/(E+F)=19/40×100%=47.5%。
2 结 果
共有9种棘球蚴病血清学诊断试剂参加了本次测评。方法包括ELISA、IHA、金标层析法、免疫层析试条、胶体金渗滤法等多种方法。各试剂的检测结果见表2。如用“正确指数”评价,试剂A(ELISA间接法)的检测效能最高。
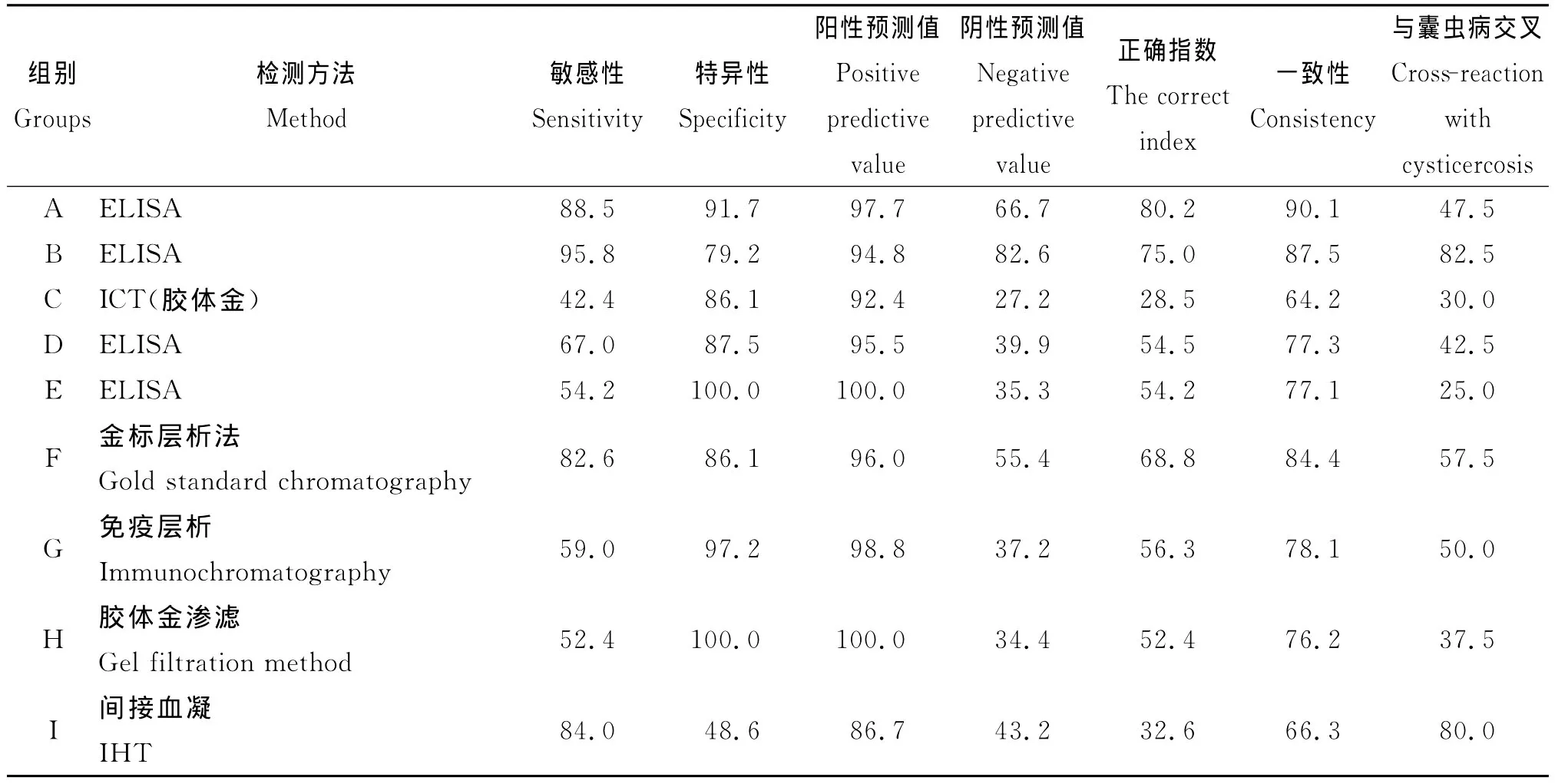
表2 人棘球蚴病9种血清学诊断试剂检测效能比较(%)Tab.2 The comparison of nine serological diagnostic reagents of human echinococcosis(%)
3 讨 论
棘球蚴病患者的血清学诊断是进行患者早期诊断的重要手段,是对患者实施有效处理和治疗的一个先决条件[1]。检测抗棘球蚴血清抗体的血清学试验中,酶联免疫吸附试验(检测IgG)(IgG-ELISA),间接红细胞凝集试验(IHAT),和胶乳凝集试验(LAT),在实验室中普遍使用[2];用得较少的是免疫荧光抗体试验(IFAT),免疫电泳法(IEP)和一些其他试验。但在棘球蚴病的抗体检测中,还没有标准化的、高度敏感、特异的血清学试验[3]。我国自2005年启动了中央转移支付棘球蚴病防治项目,包括人群筛查的血清学诊断和儿童血清学监测等内容,由于对目前应用的血清学诊断试剂缺乏了解,直接影响项目的效果考核和数据利用。
通过本次评价,了解了我国人群棘球蚴病血清学诊断试剂的现状和检测效能。主要特点如下。3.1 总体来讲各诊断试剂检测效能不够理想。表现为敏感性、特异性较低。9种试剂平均正确指数仅0.56,平均调整一致性为77.9%。试剂A相对较好,敏感性88.5%,特异性91.7%,正确指数为0.802,一致性为90.1%,加强该诊断试剂的研发,提高检测效能是我国棘球蚴病防治中亟待解决的问题。应注意的是,有多种因素影响试验结果,如抗原质量、检测系统、包囊的器官定位和包囊数量、免疫应答个体差异等。
3.2 方法多样,检测效率相对较高的为ELISA方法。本次参评的试剂从诊断方法的角度包括酶联免疫吸附试验法(ELISA)、间接血凝法(IHA)、免疫层析法和金标渗滤法。综合考虑真实性相关指标,认为目前检测效能相对较高的为ELISA法。在方法上,试验应该具有高度敏感性和特异性。这是因为大多数病例是无症状的,可能性更大的是尚处于病变早期,如小型、单房的、泡状包囊或钙化包囊等,这些情况下的血清反应性很低[4]。但考虑现场应用的可行性,免疫层析试条等快速简便的方法将成为未来的研究方向。
3.3 普遍存在较强的与囊虫病的交叉反应。交叉反应最低的为25.0%,最高达82.5%。随着现代分子生物技术的发展,交叉反应将会进一步降低。
3.4 鉴别AE和CE的能力差。9种参评试剂中只有两种试剂在设计上能够区分AE和CE,但是检测效果很不理想,最后尊重厂家意愿按不分型进行统计,所以目前我国没有较为成熟的鉴别AE和CE的诊断试剂。而据报道,在2000年有一种蛋白印迹试验已经商品化(棘球绦虫 WB IgG,LDBIO诊断,里昂,法国),可鉴别AE和CE,具有大约76%的可靠性[5]。
试剂评价同样应从试剂的真实性、可靠性两个方面入手。本次只评价了真实性的一系列指标,由于参评试剂较多,血清用量较大,未能进行平行样重复试验评价试剂的可靠性,下一步欲选择真实性相对较好的几种试剂,检测同一批次的同一酶标板内和不同的酶标板之间以及不同批次之间的稳定性、以对试剂的检测效能做出更全面的评价。
[1]Sato N,Namieno T,Furuya K,et al.Contribution of mass screening system to respectability of hepatic lesions involvingE-chinococcusmultilocularis[J].J Gastroenterol Hepatol,1997,32:351-354.
[2]Guisantes JA.Progress on the laboratory diagnosis of the human hydatid disease--from the recent past till the present[J].Arch Int Hidatid,1997,32:136-140.
[3]Craig PS.Immunodiagnosis ofEchinococcusgranulosusand a comparison of techniques for diagnosis of canine echinococcosis.InCompendiumon cystic echinococcosis in Africa and Middle Eastern countries with special reference to Morocco[M].F.L.Andersen,H.Ouhelli,M.Kachani,eds.Provo:Print Services,Brigham Young University,1997:85-118.
[4]Craig PS,Rogan MT,Allan JC,et al.Detection,screening and community epidemiology of taeniid cestode zoonoses:cystic echinococcosis,alveolar echinococcosis and neurocysticercosis[J].Adv Parasitol,1996,38:169-250.
[5]Piarroux R,Janin V,Bresson-Hadni S,et al.Diagnostic value of a western blot using crude larval antigen fromEchinococcus multilocularis[J].Acta Parasitol,2000,45:196.

