广州市白纹伊蚊细胞色素C氧化酶亚基Ι基因遗传多态性分析*
蔡燕丽,罗 雷,2,郑学礼
广州市白纹伊蚊细胞色素C氧化酶亚基Ι基因遗传多态性分析*
蔡燕丽1,罗 雷1,2,郑学礼1
目的 探索广州市白纹伊蚊线粒体细胞色素C氧化酶亚基I基因(COI)序列的特征,分析同一城市不同环境下白纹伊蚊的遗传变异。方法单蚊抽提广州市不同点采集的白纹伊蚊基因组DNA,扩增细胞色素C氧化酶亚基I基因片段,联合单链构象多态性PCR(PCR-SSCP)技术分析COI基因片段多态性并筛选部分样品进行克隆测序,用软件比对分析序列的差异。结果广州市不同采样点白纹伊蚊PCR扩增后获得709 bp的COI基因部分序列,序列分析出现12个变异位点,变异率为1.69%。聚类分析显示广州株白纹伊蚊不同采样点的群体间出现部分分化。结论广州市不同采样点的白纹伊蚊线粒体COI基因出现部分遗传多态性,可能与城市化发展下白纹伊蚊孳生环境的变化有一定关系。
白纹伊蚊;单链构象多态性;mtDNA-COI;城市化
蚊虫作为一类常见的病媒生物,能传播包括流行性乙型脑炎(Epidemic encephalitis B)、登革热(Dengue fever,DF)和疟疾(Malaria)等多种虫媒传染病,其传播病原体的有效性与蚊虫本身的媒介易感能力相关[1]。在自然界中登革病毒(Dengue virus,DENV)的传播主要依赖埃及伊蚊(Aedes aegypti)和白纹伊蚊(Aedes albopictus),其媒介易感性是登革热和登革出血热(Dengue haemorrhagic fever,DHF)流行动态的影响因素之一。白纹伊蚊和埃及伊蚊在我国均有分布,其中白纹伊蚊由于其分布广、活动时间长,对于我国大部分地区登革热的流行起着重要的作用[2]。自1978年国内首次报道由登革4型病毒引起的广东省佛山市登革热暴发后,我国南方地区广东、广西、海南、福建和浙江等地都发生过登革热流行[3]。广州市地处亚热带,气候温暖潮湿,雨量充沛,十分适宜白纹伊蚊的生存繁殖,加上城市化发展快,人口密度高、流动大,近年来成为广东省登革热报告病例数最多的城市[4]。因此控制登革热流行的措施除了登革疫苗的研制及相关临床手段外,还包括其传播媒介的有效控制,特别是白纹伊蚊的种群动态特征及不同环境下其遗传结构的差异或者改变,对于制定白纹伊蚊防控措施有重要参考价值。
国内外针对白纹伊蚊不同群体遗传多样性的研究应用了多种分子遗传标记和技术进行分析。其中线粒体细胞色素C氧化酶亚基I基因(mt DNACOI)序列组成保守,严格遵循母系遗传,进化速率比核DNA快和无重组等特点,使其成为研究分子进化遗传常用分子标记靶点,并运用于建立物种鉴定的DNA条形码系统的研究[5]。本课题主要研究广州市不同采样点白纹伊蚊线粒体细胞色素C氧化酶亚基I基因的序列的多态性,探讨不同群体的COI基因分化及遗传差异,为广州市白纹伊蚊种群监测提供依据。
1 材料与方法
1.1 材料
1.1.1 白纹伊蚊样本 现场采集广州市10个区和2个县级市12个点的白纹伊蚊成蚊和幼虫。成蚊根据形态特征鉴定后置70%乙醇中保存,幼虫带回实验室常规饲养至羽化后鉴定,置70%乙醇中保存备用。样品来源及采集地环境信息见表1。
1.1.2 试剂与主要仪器dNTP、Ex Taq 酶、p MD18-T Vector试剂盒、TaqΙ内切酶、DNA Maker均购自Ta KaRa公司;质粒小提试剂盒和凝胶回收试剂盒购于美国Omega Bio-Tek公司;大肠埃希菌DH5α为本室保存;其余试剂为国产分析纯。TGradient Thermoblock PCR 扩增仪 (Biometra),Mini-PROTEAN Tetra Cell 电泳仪 (Bio-Rad),Smart Spec 3000紫外分光光度计(Bio-Rad)。
1.2 方法
1.2.1 基因组 DNA 提取 根据 Black[6]等的方法,提取单蚊基因组DNA,操作步骤如下:单只蚊子在裂解液(0.1 mol/L NaCl,0.2 mol/L Sucrose,0.1 mol/L Tris-HCl,0.05 mol/L EDTA,0.05%SDS)中漂洗两次,置于1.5 m L离心管中,加入25 μL裂解液并用塑料研磨棒研磨至匀浆状,另加25 μL裂解液混合均匀。65℃孵育30 min。趁热加入7μL 8 mol/L的醋酸钾混匀。冰水浴中放置30 min后15 000 g冷冻离心15 min,将上清(约45 μL)吸到新离心管中,注意不要吸到沉淀。加入100 μL预冷无水乙醇混匀沉淀核酸,-20℃放置30 min。15 000 g冷冻离心15 min,弃上清,加入1 m L 75%预冷乙醇洗涤沉淀,弃上清后倒置滤纸上,37℃烘干。加入50μL灭菌超纯水溶解,-20℃保存备用。紫外分光光度计测DNA浓度及纯度,1%琼脂糖凝胶电泳分析。

表1 广州市白纹伊蚊样品采集地及环境信息Tab.1 Location and circumstance information from samples of A.albopictus collected in Guangzhou
1.2.2 白纹伊蚊COI基因的扩增 参考Folmer[5]等扩增 基因的通用引物,上下游引物分别为,LCO1490:5′-GGTCAACAAATCATAAAGATATTG G 3′, HCO2198: 5′TAAACTTCAGGGTGAC CAAAAAATCA-3′,引物由上海生工生物工程有限公司合成。以单蚊DNA为模板扩增COI基因片段,采用25μL的反应体系:dd H2O 16μL,DMSO 2.5μL,10×PCR缓冲液2.5μL,脱氧核苷三磷酸(d NTPs,各2.5 mmol/L)2μL,上、下游引物(10 pmol/μL)各0.5μL,Taq酶(5 U/μL)0.5μL,DNA(100 ng/μL)0.5μL。反应条件:94 ℃预变性3 min,94℃变性1 min,55℃退火1 min,72℃延伸1 min,35个循环,最后72℃延伸7 min。扩增产物经1.0%琼脂糖凝胶电泳鉴定并切胶纯化回收,产物置-20℃保存备用。
1.2.3 COI基因的酶切 20μL酶切反应体系:Taq I 1μL,10×Taq I Basal Buffer 2μL,0.1%BSA 2μL,纯化的PCR产物12μL(≤1μg),dd H2O 3μL。65℃水浴1.5 h,取5μL酶切产物经1.5%琼脂糖凝胶电泳验证酶切成功。
1.2.4 SSCP筛选及分析 制作6%非变性聚丙烯酰胺凝胶(交联度为29∶1)。取3μL酶切成功的产物和5μL甲酰胺变性上样缓冲液混匀,96℃变性10 min后,立即置于冰浴中骤冷5 min以上,8μL全部上样。电泳槽置冰水浴中90V恒压电泳6 h后,取下凝胶,置于固定液中固定30 min,期间不断摇晃凝胶。倒掉固定液,用超纯水漂洗凝胶5 min×3次,再将其置于硝酸银染色液中银染30 min,弃银染液用超纯水漂洗凝胶5 min×3次后,置于显色液中显色至条带清晰同时背景较低时立即停止显色,超纯水漂洗1次,观察并拍照记录结果。
1.2.5 COI基因测序及序列分析 根据SSCP分析结果,每个采样点各选择一个代表性样品,共筛选不同采样点及实验室长期饲养株共13份COI基因片段,纯化产物连接到p MD18-T载体上,16℃2 h。连接产物转化DH5α感受态,接种到含有氨苄抗生素的LB固体培养基,37℃培养12~16 h,菌落PCR法初筛阳性克隆,挑取阳性菌落提质粒,PCR鉴定后测序。不同个体白纹伊蚊COI序列用DNAMAN软件比对后去掉载体序列,结果登陆Gen-Bank数据库与白纹伊蚊线粒体全序列(登录号:NC_006817.1)中COI序列进行比对分析,在BioEdit软件中编辑后输出,用Clustal X 1.81和 Mega 4.0软件分析不同个体之间COI序列的多态性和构建系统进化树。
2 结 果
2.1 白纹伊蚊COI目的片段的PCR扩增结果白纹伊蚊 基因 产物经 琼脂糖凝胶电泳,在约700 bp处可见单一DNA条带,与预期的片段大小吻合,且无非特异性条带,说明该通用引物及反应条件具有较好的特异性,见图1。
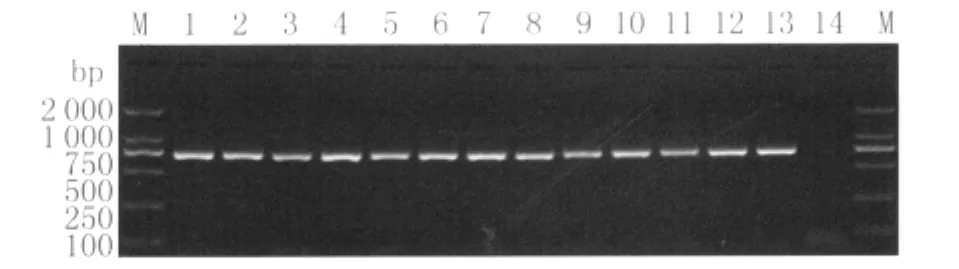
图1 白纹伊蚊COI基因扩增产物Fig.1 PCR products of COI genes of A.albopictus M:DL2000 marker;1-12:A.albopictus samples from BY,CH,HD,HP,HZ,LG,LW,NS,PY,TH,YX,ZC;13:A.albopictus sample from Lab strain;14:Negative control
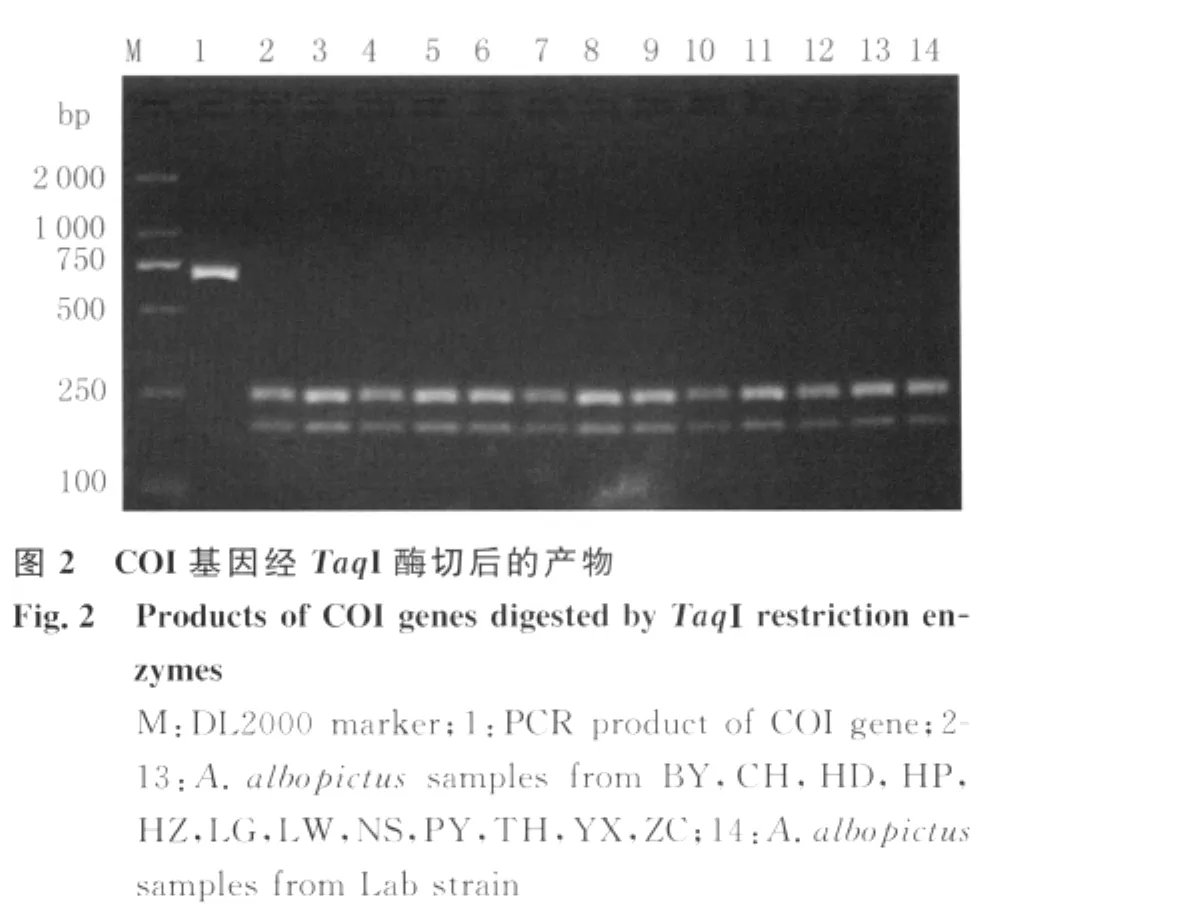
2.2 COI基因扩增产物的酶切及SSCP分析 扩增的COI基因片段为709 bp,经TaqΙ酶切后产生3个片段,大小分别为264 bp、252 bp和193 bp,见图2。由于其中两个片段大小仅相差12 bp,琼脂糖凝胶电泳后可见每个样品在250 bp附近的条带亮度及大小均为另一条的2倍,即该条带由264 bp的条带和252 bp的条带组成。不同采样点白纹伊蚊的COI酶切产物经SSCP筛选,共筛选出12份不同采样点的样品及1份实验室饲养株样品,见图3。

2.3 COI基因测序及变异分析 13个代表样品COI碱基序列长度相同,均为709 bp。样品序列与GenBank收录的白纹伊蚊线粒体全序列(NC_006817.1)进行比较,与其中编码COI基因的序列相似性均达到98%以上。所得的COI序列中A、T、G、C 碱基的平均含量为 28.63%、38.79%、15.94%和16.64%,A+T的平均含量为67.42%,明显高于G+C平均含量32.58%,符合昆虫线粒体A、T碱基偏好性的基因规律。不同样品的COI基因序列中出现12个变异位点(1.69%),其中9处出现转换,包括5次A-G转换,4次T-C转换;3处出现颠换,包括2次A-C颠换,1次T-A颠换,见表2。遗传差异分析表明不同采样点白纹伊蚊样品间的差异为0.0%~0.7%。系统发育分析表明,广州市不同采样点白纹伊蚊线粒体COI基因存在个体差异,从化、番禺、南沙和增城采样点的白纹伊蚊与天河单独聚成一类,黄埔区独立与其他采样点的蚊株聚成一类,见图4。
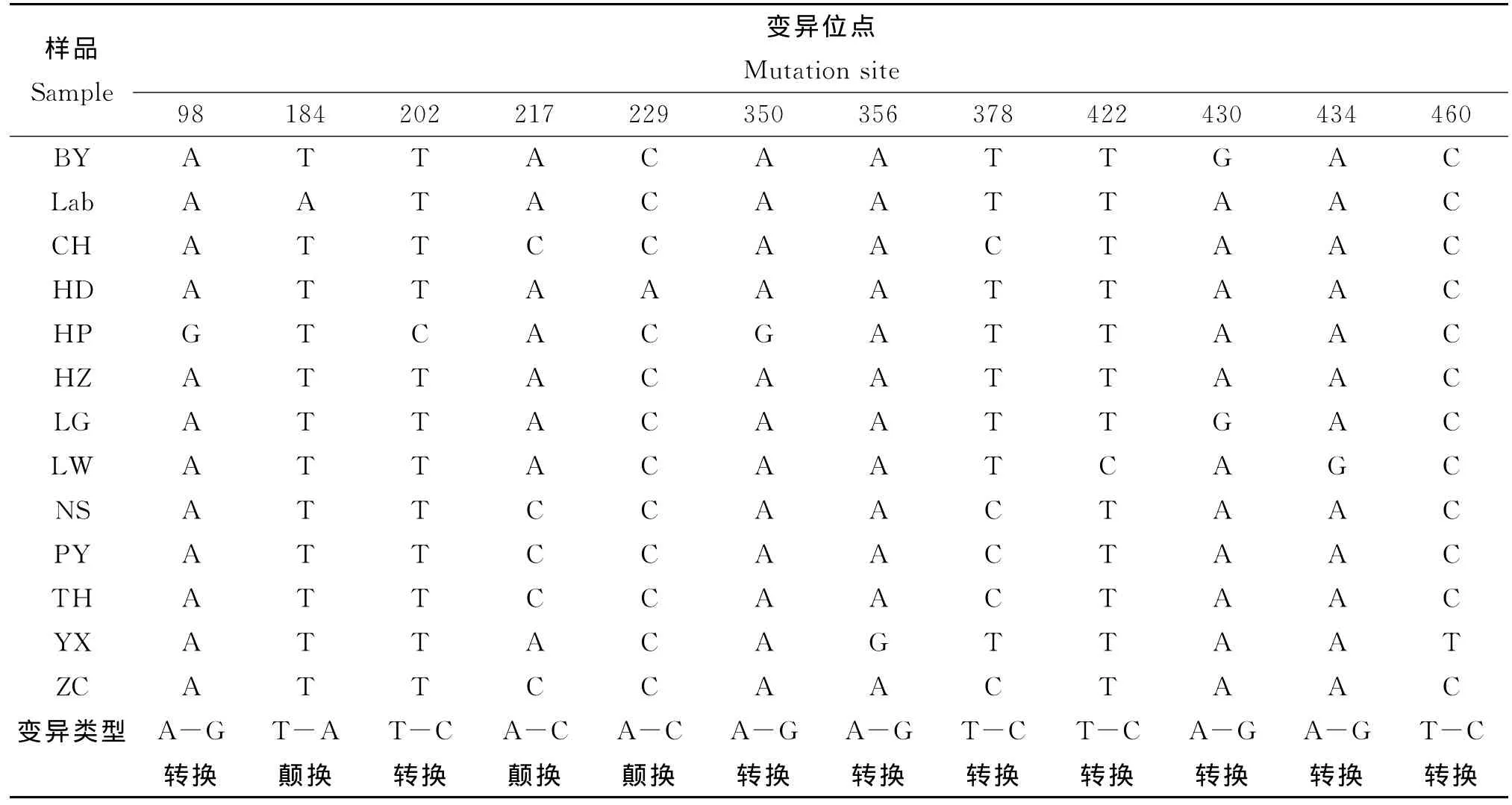
表2 白纹伊蚊COI基因序列的位点变异Tab.2 The mutation sites of COI gene sequences of A.albopictus
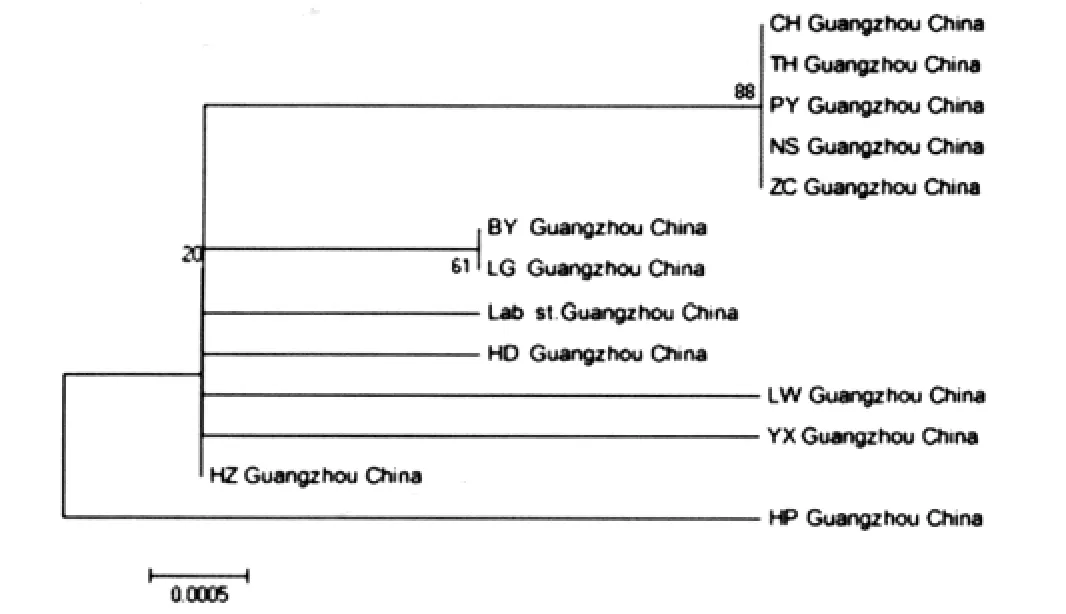
图4 广州市不同采样点白纹伊蚊的系统发育进化树Fig.4 Phylogenetic analysis of A.albopictus from different collection sites in Guangzhou
3 讨 论
白纹伊蚊(Aedes albopictus)属长角亚目蚊科(Culicidae)伊蚊属(Aedes),在我国分布广泛,是多种病毒如登革病毒、基孔肯雅病毒(Chikungunya virus,CHIKV)和西尼罗河病毒(West Nile virus,WNV)重要传播媒介[2]。白纹伊蚊群体遗传多态性的形成与种群隔离的地理距离有关以外,环境对白纹伊蚊群体的变异及基因流模式的作用也是导致群体遗传多样性的原因。李春晓[7]等用RAPD技术研究北京、上海、成都、广州和日本冲绳、长乐寺6个不同地理株12个个体的遗传差异发现,同一地理株不同个体间、不同地理株不同个体间的遗传距离有差异,特别是由于地理隔离因素出现的长乐寺和其他地理株出现的最大的遗传距离,提示了不同地理株出现的分化与地理位置有密切关系。林岩[8]等探讨了福建省内4个不同地理环境的白纹伊蚊r DNA ITS2的基因序列特征,发现不同地理区域的白纹伊蚊在r DNA ITS2区表现的遗传多态性,推测这些差异与生态环境因素如海拔高度、气温、降雨量和湿度有一定关系。本课题中广州市不同采样点白纹伊蚊COI基因序列出现多态性,一方面推测与采样点的分布有关,系统发育进化树中从化、番禺、南沙和增城采样点主要分布在广州市非城市中心地带,其人口密度和人口流动比城市中心较低,而它们与天河聚成一类,说明同一地理株不同群体间确实存在着自由基因流,而且可能与人群活动关系密切。另一方面黄埔区独立与其他采样点的蚊株聚成一类,暗示该采样点的蚊株开始出现分化可能与白纹伊蚊的种群密度、蚊媒防控措施等人类活动在短期内影响其种群遗传结构有关。
城市化发展与蚊媒的遗传变异有一定的关系。分析城市化发展程度的指标包括人群密度、建筑物覆盖率、植被覆盖率和非人类宿主数量,不同城市化程度的地区使蚊媒的孳生地出现差异,可能导致蚊媒即使在一个小范围的环境中也出现一定程度的分化[9]。Dacm[10]等分析了巴西某地区5个地点埃及伊蚊群体的差异程度和本地水平的基因流模式,发现埃及伊蚊在城市中心和郊区均具有较高的群体遗传差异。Hubert[11]等在越南胡志明市中心和郊区5个地点收集了7份埃及伊蚊种群样本分析其同工酶和微卫星多样性与登革2型病毒的易感性,发现旱季埃及伊蚊出现遗传分化并具有更高的登革病毒感染率,提出雨季等环境因素和孳生地密度、灭蚊等人类活动因素均可在短时间内控制埃及伊蚊的种群遗传结构。广州市一直是登革热暴发流行区,城市实施的灭蚊措施使白纹伊蚊的种群密度迅速下降,城市化程度高和人们生活习惯的变化使广州市白纹伊蚊孳生环境发生变化可能是导致不同采样点白纹伊蚊COI基因出现差异的原因,但这种改变是否能经过不同环境的选择作用并在较长时间的淘汰作用下保留下来并引起显著的遗传变异,还需要深入的研究。综上所述,白纹伊蚊种群的遗传变异涉及多种因素的作用,而人类活动等影响种群遗传结构的作用也应当成为蚊媒防控的重要依据,为以后的登革热防控措施提供更全面的指导。
[1]Beerntsen BT,James AA,Christensen BM.Genetics of mosquito vector competence[J].Microbiol Mol Biol Rev,2000,64(1):115-137.
[2]Gratz NG.Critical review of the vector status of Aedes albopictus[J].Med Vet Entomol,2004,18(3):215-227.DOI:10.1111/j.0269-283X.2004.00513.x
[3]Qiu FX,Gubler DJ,Liu JC,et al.Dengue in China:a clinical review[J].Bull World Health Organ,1993,71(3-4):349-359.
[4]Guo RN,He JF,Yang WJ,et al.Analysis on the epidemiologic features of dengue fever in Guangdong province,2005-2010[J].J Practical Med,2011,27(19):3477-3480.(in Chinese)郭汝宁,何剑峰,梁文佳,等.广东省2005-2010年登革热流行特征分析[J].实用医学杂志,2011,27(19):3477-3480.
[5]Folmer O,Black M,Hoeh W,et al.DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates[J].Mol Mar Biol Biotechnol,1994,3(5):294-299.
[6]Black WC,Duteau NM.RAPD-PCR and SSCP analysis for insect population genetic studies[M].Crampton J,Beard CB,Louis C,eds.The Molecular Biology of Insect Disease Vectors:A Methods Manual.New York:Chapman and Hall,1997:361-373.
[7]Li CX,Zhu LH,Dong YD,et al.Genetic differentiation of Aedes albopictus strains detected by the random amplified polymorphism DNA polymerase chain reaction(RAPD-PCR)[J].Chin J Vector Biol Contr,2003(4):248-250.(in Chinese)李春晓,朱礼华,董言德,等.用随机扩增多态性DNA(RAPD)技术区分不同地理株白纹伊蚊[J].中国媒介生物学及控制杂志,2003(4):248-250.
[8]Lin Y,Zhang SY,Lin YY,et al.Genetic polymorphism analysis on r DNA ITS2 from different geographical strains of Aedes albopictus in Fujian province[J].Chin J Zoonoses,2010(8):735-738.(in Chinese)林岩,张山鹰,林耀莹,等.福建省不同地理株白纹伊蚊r DNA ITS2基因多态性分析[J].中国人兽共患病学报,2010(8):735-738.
[9]Braks MA,Honorio NA,Lourencqo-De-Oliveira R,et al.Convergent habitat segregation of Aedes aegypti and Aedes albopictus(Diptera:Culicidae)in southeastern Brazil and Florida[J].J Med Entomol,2003,40(6):785-794.
[10]da Costa-Ribeiro CM,Lourenco-de-Oliveira R,Failloux AB.Higher genetic variation estimated by microsatellites compared to isoenzyme markers in Aedes aegypti from Rio de Janeiro[J].Mem Inst Oswaldo Cruz,2006,101(8):917-921.DOI:10.1590/S0074-02762006000800015
[11]Huber K,Loan LL,Hoang TH,et al.Temporal genetic variation in Aedes aegypti populations in Ho Chi Minh City(Vietnam)[J].Heredity(Edinb),2002,89(1):7-14.DOI:10.1038/sj.hdy.6800086
Genetic polymorphism analysis of COI gene in Aedes albopictus from Guangzhou
CAI Yan-li1,LUO Lei1,2,ZHENG Xue-li1
(1.Department of Etiobiology,School of Public Health and Tropical Medicine,Southern Medical University,Guangzhou 510515,China;2.Guangzhou Center for Disease Control and Prevention,Guangzhou 510080,China)
In order to study the sequence characteristics of mitochondrial cytochrome C oxidase subunit I gene(COI)in Aedes albopictus from Guangzhou and the genetic variation analysis of these mosquitoes from different circumstance in the city,single mosquito genomic DNA was extracted from Aedes albopictus of different populations for COI gene amplification.Representative samples were selected by analysis of single-strand of conformation polymorphism and subjected to sequencing and comparison with relevant sequences available in GenBank,with Clustal X 1.81 and Mega 4.0 analyzed the variability of target sequences.The obtained COI sequences were 709 bp in length,with 12 mutation sites and 1.69%mutation rate.Based on the phylogenetic tree,Aedes albopictus populations collected from different sites showed partial genetic differentiation.The results suggested that the partial genetic variation presented on COI gene of Aedes albopictus from different collection sites of Guangzhou is probably correlated with urbanization due to the change of breeding environment.
Aedes albopictus;SSCP;mtDNA-COI;urbanization
Zheng Xue-li,Email:zhengxueli2001@hotmail.com
R384
A
1002-2694(2012)08-0781-05
10.3969/cjz.j.issn.1002-2694.2012.08.004
*国家自然科学基金(No.30872198,No.30972566)和广州市科技局基础研究项目(No.2009J1-c161)联合资助
郑学礼,Email:zhengxueli2001@hotmail.com
1.南方医科大学公卫学院病原生物学教研室,广州510515;
2. , 510440
Supported by the National Natural Science Foundation(No.30872198),and the Basic Research Program of Science & Technology Bureau of Guangzhou City(No.2009J1-c161)
2012-01-05;
2012-02-26

