羊种布鲁菌omp25的原核表达与免疫原性检测*
吴 杰,吴树清,李东兴,刘艳琴,张明月,海 岩
羊种布鲁菌omp25的原核表达与免疫原性检测*
吴 杰1,吴树清1,李东兴1,刘艳琴1,张明月1,海 岩2
目的在大肠杆菌中表达羊种布鲁菌omp25基因并鉴定重组蛋白的免疫原性。方法从羊种布鲁菌中用聚合酶链反应技术(PCR)扩增得到布鲁菌omp25基因片段,并将目的基因插入原核表达载体PET-32a中,构建重组质粒PET-32a/omp25转入大肠杆菌E.coli Rosetta中并进行诱导表达,用SDS-PAGE和western-blot检测表达蛋白。结果成功构建了重组质粒PET-32a/omp25,并在大肠杆菌Rosetta中获得了重组蛋白,重组蛋白与布鲁菌阳性血清发生特异性反应。结论重组质粒PET-32a/omp25可以在大肠杆菌Rosetta中成功表达,并且重组蛋白可与布鲁菌阳性血清发生特异性反应,说明该重组蛋白有良好的免疫原性,该研究为疫苗的研制及布鲁菌病的检测打下良好的基础。
布鲁菌;omp25;表达;免疫原性
布鲁菌病是由布鲁菌属细菌引起的动物源性疾病,是一种人畜共患传染性疾病,该病在我国发病呈逐年上升趋势[1]。它主要引起人类波状热和慢性感染以及反刍动物流产和睾丸炎等,对于慢性布鲁菌病目前尚无根治方法。大量研究表明,布鲁菌的外膜蛋白具有很强的免疫原性[2-3]。omp25是布鲁菌omp A家族成员之一,omp25基因在布鲁菌各个种属之间有很高的保守性[4]。本研究克隆了羊种布鲁菌omp25基因,在大肠埃希菌Rosetta中表达,用纯化的表达产物进行western-blot分析,发现重组蛋白具有免疫原性。为检测布鲁菌病及研制布鲁菌亚单位疫苗提供了科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 羊种布鲁菌分离株于东北农业大学动物医学院P2实验室分离鉴定。该分离株在羊流产胎儿中分离培养,经染色镜检,生化鉴定和PCR检测,最终确定该菌株为羊种布鲁菌生物3型,命名为M306。PET-32a、Rosetta购自大连宝生物有限工程公司。
1.1.2 试 剂 T4 连 接酶、DNA Marker、蛋 白Marker、IPTG和限制性内切酶Eco RⅠ、XhoⅠ购自大连宝生物生物制品有限公司;辣根过氧化物酶(HRP)标记兔抗羊IgG购自Sigma公司,His GraviTrap Kit购自GE公司。引物由上海生工生物工程有限公司合成,浓度2OD/管,储存液浓度100μmol/L。布鲁菌标准阴性,阳性羊血清由内蒙古动物疫病预防控制中心提供,其他常规试剂均为国产试剂。
1.2 方法
1.2.1 目的片段的扩增 根据GenBank上发表的16M布鲁菌omp25的基因序列设计羊种布鲁菌上下游引物 P1:5′cgcctcgagttagaacttgtagt 3′,P2:5′ccgggatccatgaaatccgtaat 3′(分别加入Eco RⅠ和Xho lⅠ酶切位点)。PCR反应条件为:95℃预变性5 min,94℃变性40 s,55℃复性45 s,72℃延伸45 s;30个循环,最后72℃延伸10 min。同时设去离子水对照。反应结束后用1%的琼脂糖凝胶电泳检测并观察结果。
1.2.2 omp25基因表达载体的构建 PCR产物经限制性内切酶Eco RⅠ、XhoⅠ双酶切处理,1%琼脂糖凝胶电泳,回收预期的omp25基因片段与同样处理的PET-32a表达载体16℃连接过夜,转化至Rosetta中,涂LB平板(氨苄青霉素和氯霉素抗性),37℃培养过夜,挑取单克隆菌落37℃过夜摇菌,碱变性法提取质粒,进行PCR和Eco RⅠ、Xho lⅠ双酶切鉴定。挑取阳性单克隆,送上海生工生物工程有限公司测序,并与GenBank报道的omp25基因序列进行同源性比较。将重组质粒命名为PET-32a/omp25。
1.2.3 PET-32a/omp25重组蛋白的诱导表达及纯化 含重组质粒的菌液按1∶100的量接种在的LB培养基中(含氨苄青霉素,氯霉素50μg/m L),37℃振荡培养至OD600为0.6~1.0,再加入IPTG终浓度为1 mmol/L。37℃继续培养,经12%的分离胶检测表达情况。将诱导产物经离心收集菌体,超声处理,利用His GraviTrap Kit试剂盒,对融合蛋白进行重力流纯化,对纯化产物进行SDS-PAGE分析。
1.2.4 表达产物的纯化和 Western-blot检测 纯化蛋白经SDS-PAGE后电转到NC膜上(50 m A,80 min),5%的脱脂奶粉4℃封闭过夜,布鲁菌阳性血清由5%的脱脂乳1/100倍稀释作为一抗,37℃作用2 h,按1∶3 000倍稀释的辣根过氧化物酶(HRP)标记的兔抗羊IgG作为二抗,37℃作用1 h,DAB显色3~5 min后用自来水终止。
2 结 果
2.1 重组表达质粒PET-32a/omp25的鉴定 PET-32a/omp25重组质粒经PCR和Eco RⅠ、XhoⅠ双酶切鉴定,得到了预期大小的642bp片段。测序结果表明目的基因omp25正向插入PET-32a载体,并且测序结果与GenBank中公布的M16株布鲁菌omp25基因序列完全相同(图1)。
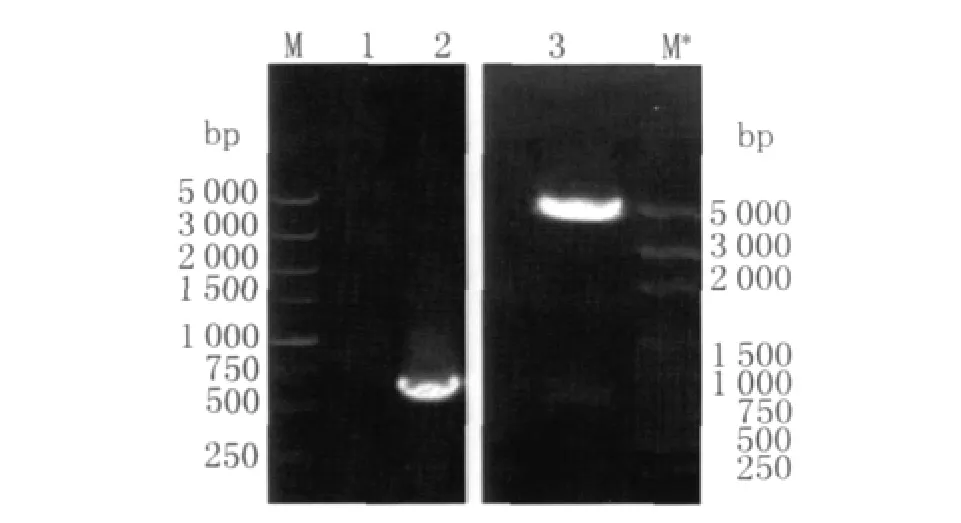
图1 重组质粒PET-32a-omp25的PCR及双酶切鉴定Fig.1 Digestion analysis and PCR amplification of the recombinant plasmid PET-32a-omp25 M,M*:DNA marker;1:negative control;2:PCR application of recombination plasmid PET-32a/omp25;3:PET-32a/omp25 cleaved by Eco RⅠ、Xho lⅠ
2.2 重组蛋白omp25的表达 阳性重组菌液在OD0.8时经1 mmol/L IPTG 诱导5 h,进行12%SDS-PAGE电泳分析,出现了大小约为43 k Da的蛋白条带与预期分子量基本一致(图2)。
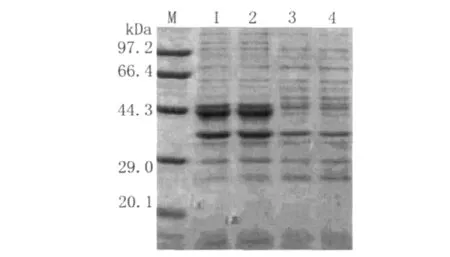
图2 表达产物的SDS-PAGEFig.2 SDS-PAGE of expression productions M:protein marker;1,2:PET-32a/omp25 induced 5h;3:PET-32a(+)induced 5h,4:E.coli Rosetta induced 5 h
2.3 重组蛋白omp25的纯化及western-blot分析
采用GE公司的His GraviTrap亲和纯化试剂盒对重组蛋白进行纯化,将收集的洗脱液进行SDSPAGE电泳检测。在约43 k Da可见纯化的蛋白条带(见图3)。Western-blot分析结果表明,纯化的重组蛋白能与羊种布鲁菌阳性血清发生特异性反应,43 k Da处出现特异免疫反应条带由此表明重组蛋白omp25有好的免疫原性(图3)。

图3 表达纯化产物的SDS-PAGE及western-blot分析Fig.3 SDS-PAGE and western-blot analysis of purified products M:Protein marker;1:the purified recombinant protein;2:identification by western-blot
3 讨 论
omp25是布鲁菌外膜结构蛋白[5],是具有代表性的第3组外膜蛋白[6]。在布鲁菌各个种属之间具有高度的保守性,同源性达98%以上。布鲁菌omp25基因的缺失可引起布鲁菌的毒力减弱,并能够对宿主起到免疫保护作用[7]。Philpper从B.abortus544基因库中,以抗omp25单克隆抗体调出了omp25基因,并分析了其脱氧核糖核昔酸序列omp25基因长约917bp,在起始密码子6个碱基前有7个核昔酸序列(TAAGGAG)与大肠杆菌16sRNA序列具有同源性,估计是核糖体结合位点[8]。布鲁菌细胞壁膜结构是大多数细菌识别宿主的独特标志物,能绑定胞外的许多基质蛋白,特别是纤维连接素和玻璃体粘连蛋白,这也是许多其他的病原微生物普遍存在的一个属性。研究证实布鲁菌表面主要的抗原成分是LPS和omps。到目前为止,己发现有7种主要omps,它以共价键的形式与细胞外膜的肤聚糖(PG)层紧密结合。
本实验证实omp25蛋白表达量高,占总菌体蛋白的含量高,具有良好的免疫反应原性,具备作为免疫学活性抗原的潜力和优势,为疫苗的开发和免疫学检测方法的建立,提供了候选抗原。
[1]文学忠,于瑞华,姜秋杰.布鲁氏菌病近况[J].吉林畜牧兽医,2007(5):20-23.
[2]Bowden R A,Cloeckaert A,Zygmunt M S,et al.Evaluation of immunogenicity and protective activity in BALB/c mice of the 25-k Da major outer-membrane protein of Brucella melitensis(OMP25)expressed in Escherichia coli[J].J Med Micobiol,1997,47:39-48.
[3]Brocker B J,Tabatabai L B,Mayfeld J E.Conserbation of antigenicityin a 31-k Da Brucella protein [J].Vet Microbiol,1988,18:313-525.
[4]Matthew D,Edmonds,Cloeckaert A,Phlip HE.Brucella species lacking the major outer membrane protein Omp25 are attenuated in mice and protect against Brucella ovis[J].Vet Micobiol,2002,88:205-221.
[5]Bowden R A,Verger J M,Grayon M,et al.Rspid identification of rough Brucella isolates bu a latex coagglutination assay with the 25-lilodalton outer membrane protein and rough-lipopolysaccharide specific monoclonal antibodies[J].Clin Diagn Lsb Innunol,1997,4(5):611-614.
[6]Oliveira S C,Splitter G A.Immunization of mice with recombinant L7/L12 ribosomal protein confers protein confers protection against Brucella abortus infection[J].Vaccine,1996,14(10):959-962.
[7]Edmonds M D,Cloeckaert A,Booth N J,et al.Attenuation of a Brucella abortus mutant lacking a major 25 k Da outer membrane protein in cattl[J].Am J Vet Res,2001,62(9):1461-1466.
[8]Cloeckaert A,Zymunt M S,Wergifosse P,et al.Demonstration of pertidoglycan-associated Brucella outer-membrane proteins by use of monoclonal antibodies[J].Gen Microbiol,1992,(138):1543-1550.
Expression and immunogenicity of the recombinant protein omp25 of Brucella melitensis strain
WU Jie1,WU Shu-qing1,LI Dong-xing1,LIU Yan-qin1,ZHANG Ming-yue1,HAI Yan2
(1.College of Veterinary Medicine,Inner Mongolia Agricultural University,Hohhot 010018;2.Inner Mongolia Center for Disease Control and Prevention,Hohhot 010010,China)
To express omp25 gene of Brucella in E.coli Rosetta and detect the immunogenicity of the recombinant protein,the target fragment of omp25 gene was amplified by PCR from the B.melitensis M306 strain and was cloned into expression vector PET-32a.After transforming into competent E.coli Rosetta and inducing by IPTG,the recombinant protein was expressed.As detected by SDS-PAGE and western-blot,this recombinant protein has immunogenicity.It was confirmed DNA sequencing and restriction enzymes cleavage that the recombinant plasmid PET-32a/omp25 was constructed successfully.Furthermore,the result of SDS-PAGE and western-blot assay showed that PET-32a/omp25 was expressed successfully in E.coli Rosetta and the recombinant protein could react with B.melitensis positive serum.This study provides a good foundation for the diagnosis of brucellosis and the preparation of new types of vaccines of Brucella.
Brucella;omp25;expression;immunogenicity
R378.5
A
1002-2694(2012)03-0241-03
*国家“十一五”重点科技支撑项目(2006BAD04A16-4)
吴树清,Email:wushuqing2009@126.com
1.内蒙古农业大学兽医学院,呼和浩特 010018;2.内蒙古疾病预防控制中心,呼和浩特 010010 Email:wujie_de@yeah.net
2011-05-06;
2011-09-22

