布鲁菌基因缺失株ΔVceA的感染特征研究
刘 航,何佳琪,王小凤,李明奇,郭 嘉,赵天艺,张 樊,吴长新,张 辉
(石河子大学动物科技学院 动物疾病防控兵团重点实验室,石河子 832003)
布鲁菌病是我国二类动物疫病,是一种人兽共患传染病。家畜感染布鲁菌的临床症状一般表现为关节肿大,体温升高,母畜表现为流产和死胎。目前,布病的发病率在全球范围内不断升高[1],各国都加强了对布鲁菌病的重视,以避免布病带来的经济损失和对公共卫生的危害[2]。
布鲁菌病引起母畜流产是由于胚胎滋养层细胞受到了损害[3],而布鲁菌的经典毒力因子有脂多糖、四型分泌系统[4]、外膜蛋白以及Bvr R/Bvr S双组分系统等[5]。在布鲁菌造成机体慢性感染的过程中,四型分泌系统起着重要的作用,其分泌的效应因子可以引起机体各方面的紊乱,这些效应因子的结构与蛋白质类以及核蛋白复合体的结构相似。在机体被其感染后可诱导产生IL-18等多种炎症因子并引发炎症反应[6]。IL-1β和TNF-α等促炎因子在机体抵抗病原过程中发挥重要作用[7]。我们在前期研究中,已筛选出了布鲁菌的一个效应分子VceA,并证实了其在弱毒株中的表达量低于强毒株。但是VceA在布鲁菌感染机体的过程中功能尚不明确。本研究培养布鲁菌S2308的VceA基因缺失株,分析其生长特点并与亲本株做比较。布鲁菌VceA基因缺失株侵染HTP-8细胞后,对细胞的炎性因子TNF-α和IL-1β的分泌水平进行检测;用ΔVceA感染小鼠,采集脾脏组织,进行CFU计数。本研究为进一步探究T4SS分泌蛋白VceA的功能提供理论基础,对于有效的防控布鲁菌病,维护社会公共卫生安全有着重大意义。
1 材料与方法
1.1 菌株布鲁菌2308株由石河子大学动物科技学院人兽共患病重点实验室保存;布鲁菌VceA基因缺失株由实验室构建。
1.2 试验动物27只SPF级BALB/c小鼠,5-7周龄,雌性,体重(20±2)g,购于新疆医科大学动物中心。
1.3 试剂布鲁菌固体培养基(BrucellaAgar)和液体培养基(BrucellaBroth)均购自BD公司;氨 青霉素以及卡那青霉素购自Pfizer公司;其他均为国产分析纯。
1.4 布鲁菌的培养将保存在-80℃冰箱的布鲁菌S2308和S2308的基因缺失株ΔVceA取出,于超净生物安全柜中在布鲁菌固体培养基上“四区法”画线,密封,37℃条件下恒温倒置培养2 d。
1.5 牛种布鲁菌ΔVceA生长特性检测 分别挑取S2308的基因缺失株ΔVceA单克隆菌落置于布鲁菌液体培养基中200 r/min、37℃培养至D600为0.1时,每隔120 min收取一次菌液,灭活检测D600的值,绘制生长曲线图。
1.6 HPT-8细胞的侵染及细胞因子的检测
1.6.1 细菌侵染细胞 使用6孔板进行细胞侵染实验,待细胞贴壁后,更换培养液,按照侵染复数MOI=100∶1将布鲁菌加至细胞上清液中,混匀后置于37℃、5% CO2的培养箱中1 h;每孔加入3.5 μL/mL硫酸庆大霉素作用50 min后,弃细胞培养液;PBS清洗3次后添加新的细胞培养液,置于37℃、5% CO2细胞培养箱培养。
1.6.2 侵染HPT-8细胞后细胞因子的检测 分别用S2308和ΔVceA侵染HPT-8细胞,并于3 h、12 h、24 h收取细胞上清液,并分别用TNF-α和IL-1β的ELISA试剂盒检测其表达量,绘制标准曲线,结果见图1。
1.7 侵染HPT-8细胞后CFU计数将生长状态良好的HPT-8细胞移至新的6孔板中,每孔细胞个数约为106。当细胞贴壁后,加入生长到对数生长期的菌量为108的布鲁菌S2308株和ΔVceA,分别在侵染3 h、12 h 和24 h时用曲拉通裂解细胞,梯度稀释后涂布至布鲁菌固体培养基,密封,37℃条件下恒温倒置培养3 d,进行CFU计数。

图1 炎性细胞因子标准曲线Fig.1 The standard curve of inflammatory cytokines
1.8 感染小鼠模型的建立将保存在-80℃冰箱的布鲁菌S2308和S2308的基因缺失株ΔVceA取出,于生物安全柜中在布鲁菌固体培养基上“四区法”画线,密封,37℃条件下恒温倒置培养2~3 d,进行CFU计数。每组9只小鼠,每只小鼠腹腔注射200 μL CFU计数为5×106moL/L的布鲁菌S2308株和S2308的基因缺失株ΔVceA,对照组的小鼠腹腔注射等量的PBS缓冲液。
1.9 小鼠脾脏的CFU计数分别于两组小鼠腹腔注射布鲁菌后第1 d、7 d、14 d、28 d、56 d时,在无菌环境中取出小鼠脾脏,将脾脏组织剪碎后放入无菌的EP管中,加入800 μL的PBS进行30 min匀浆,用PBS缓冲液进行梯度稀释,第1 d、7 d、14 d时用103和104的稀释度涂布布鲁菌固体培养基,第28 d、56 d时选用102和103稀释度涂布,密封,37℃条件下恒温倒置培养3 d后计算生长的菌落数。
2 结果
2.1 布鲁菌S2308株ΔVceA及其亲本株S2308生长曲线 通过观察布鲁菌S2308株ΔVceA及S2308的生长曲线,布鲁菌S2308株ΔVceA与S2308生长到对数期和平台期的时间分别是12 h和24 h,见图2。S2308株ΔVceA及S2308的生长曲线无明显差异,这表明布鲁菌VceA基因的缺失不影响布鲁菌的生长。
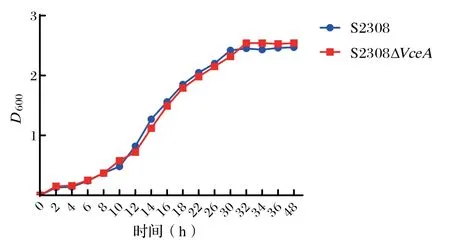
图2 布鲁菌S2308ΔVceA与其亲本株S2308的生长曲线Fig.2 The gowth curve of Brucella S2308 ΔVceA strains and S2308 strain
2.2 VceA 缺失株对HPT-8细胞的细胞因子分泌的影响在布鲁菌侵染HPT-8细胞3 h、12 h和24 h时收取上清液,根据检测TNF-α和IL-1β炎症因子的试剂盒说明书操作,用酶标仪在D450处测定吸光值,然后依据标准曲线公式来计算TNF-α和IL-1β的浓度,结果见图3。在布鲁菌侵染细胞后3 h、12 h和24 h时,侵染组TNF-α和IL-1β的分泌量均高于对照组,在布鲁菌侵染细胞后12 h时亲本株组的TNF-α和IL-1β的分泌量均高于缺失株组。
2.3 牛布鲁菌ΔVceA侵染HPT-8细胞后及感染小鼠后的CFU计数 布鲁菌ΔVceA及其亲本株S2308以100∶1侵染复数侵染HPT-8细胞,在侵染后第0 h、3 h、12 h、24 h时用曲拉通裂解细胞,收样稀释到102和103后分别涂布至布鲁菌固体培养基,密封,37℃倒置培养3~5 d后计算菌落数,绘制折线图(图4A)。结果显示,布鲁氏菌ΔVceA在侵染12 h时CFU计数显著低于亲本株,在侵染24 h时和亲本株S2308差异不显著,不具有统计学意义。
两组小鼠腹腔注射后,于感染后第1 d、7 d、14 d、28 d 和56 d时无菌取出小鼠脾脏,匀浆后加入PBS梯度稀释,涂布至布鲁菌固体培养基,密封,37℃倒置恒温培养3~5 d后计数,结果见图4B,ΔVceA在感染后第14 d时显著低于亲本株(P<0.01),之后有上升的趋势,在第28 d时和亲本株差异不显著,不具有统计学意义。

图3 细胞因子表达量Fig.3 The expressions of cytokines
3 讨论
布鲁菌的T4SS是一种多蛋白复合体,研究布鲁菌T4SS对研究布鲁菌的致病机理有很大帮助[8]。T4SS首次被发现时的效应因子就有VceA,其分泌的效应因子能够帮助布鲁菌在细胞内的生存,对机体持续造成感染[9]。研究表明,T4SS分泌的效应蛋白VceA是由105个氨基酸组成的蛋白质,在已公布的布鲁菌基因组中都是保守的,VceA编码的蛋白质是T4SS的蛋白新底物[10-12]。

图4 牛布鲁菌ΔVceA和S2308在HPT-8细胞中的存活能力和在小鼠脾脏中的载菌量Fig.4 Survival ability of Brucella bovis ΔVceA and S2308 in HPT-8 cells and their carrying capacity in mouse spleen
布鲁菌感染机体后,巨噬细胞和单核细胞均能快速识别病原菌的入侵,释放的促炎因子在感染初期对NLRP3炎症小体有暂时的抑制作用,并通过这条途径抑制相关细胞因子IL-1β和IL-18的表达,而胞外其他致炎因子的表达量也会因为IL-1β和IL-18分泌到胞外的刺激而升高。史静雪等[15]在对VceA研究中发现,VceA蛋白刺激细胞后,细胞的炎性因子IL-1β、IL-18、TGF-β1和TNF-α的表达量均有不同程度的升高。刘来珍等[14]在研究布鲁菌T4SS分泌蛋白功能时也证实了其对细胞因子IL-1β的释放具有一定的作用。本研究中布鲁菌侵染组TNF-α和IL-1β的分泌量均高于PBS对照组、亲本株组均高于布鲁菌的ΔVceA基因缺失株组,在感染的过程中这些细胞因子分泌量的变化可能与布鲁菌胞内寄生机制相关。
本研究用布鲁菌S2308基因缺失株ΔVceA侵染HTP-8细胞以及构建小鼠感染模型,通过观察绘制的布鲁菌的生长曲线可以看出,布鲁菌S2308 ΔVceA缺失株和亲本株在生长趋势上基本一致,证明VceA基因的缺失对布鲁菌的生长没有影响。脾脏作为动物体内的免疫器官,从小鼠感染布鲁菌的模型采集的脾脏组织进行CFU计数[16],缺失株感染初期显著低于亲本株,之后和亲本株并无明显差异,这些变化与布鲁菌在体内生存能力有着很大关系,为进一步探索布鲁菌四型分泌系统,揭示其致病机理提供依据。

