猪源H9N2亚型流感病毒感染A549细胞的增殖研究
李珮瑶,高晶萍,梁 亭,罗 强,李 军,徐明举,徐 彤,,张瑞华
(1.河北北方学院 预防兽医学重点实验室,张家口 075000;2.河北北方学院 生命科学研究中心,张家口 075000)
目前研究已经证实H9N2流感病毒不仅可感染家禽和猪,同时也可感染人[1-4]。自1976年人类感染猪流感病毒导致发病和死亡以来,该病毒不断在人-猪-禽中传播[5]。自1992年我国从广东省分离到H9N2禽流感病毒[6]以来,H9N2亚型禽流感病毒在我国鸡群中频繁发生。2001年,peiris等[7]证实在中国东南地区猪群中同时存在H9N2禽流感病毒和H3N2人类流感病毒,并预测这两种病毒同时感染猪为该病毒遗传重组提供机会,从而引发人类流感的大流行。2002年,我国大部分猪群中流感抗体监测显示H4、H5和H9呈不同程度阳性。2004年,从山东猪群中分离到H9N2猪流感病毒,证实此病毒为鸡源和鸭源H5N1、H9N2重组而成。同年,在河南13个猪场中分离到7株H9N2病毒,并发现这7株猪源H9N2病毒可以与人类唾液酸(sialic acid,SA)α2-6Gal受体结合。这种可直接与人类唾液酸受体结合的特性是目前禽源H5N1和H7N9病毒所不具备的,因此,猪源H9N2病毒比H5N1病毒等更易突破种间屏障而导致人类流感流行[8-10]。近年来,我国四川、湖南、云南等多个省市均陆续报道此类病例产生[7,11-12],表明H9N2病毒导致越来越多的人类感染。感染者初始一般表现为轻微呼吸道症状,但2016年四川省出现危重的临床病例[13]。鉴于以上事实,H9N2亚型流感病毒被认为是引起人类下次流感流行的潜在毒株之一,因此,研究H9N2亚型流感病毒在感染哺乳动物过程中的适应性显得更加迫切。目前关于猪源H9N2亚型流感病毒在A549细胞内增殖的相关研究报道较少,本试验拟通过对胰酶维持液浓度、吸附时间、细胞培养液pH值及病毒接种浓度等几个影响因素的筛选,确定猪源H9N2亚型流感病毒在A549细胞中增殖的最佳条件,为进一步研究H9N2亚型流感病毒致病机理奠定基础。
1 材料与方法
1.1 毒株与细胞猪源流感病毒A/Swine/Hebei/012/2008(H9N2)由河北北方学院预防兽医学重点实验室分离保存(经尿囊腔接种9~11日龄SPF鸡胚,收获病毒后测定病毒HA滴度,分装于-80℃保存);人肺腺癌上皮细胞(A549)由河北北方学院预防兽医学重点实验室保存。
1.2 主要试剂DMEM培养基、胎牛血清、谷氨酰胺、青链霉素购自Gibco公司;EDTA-胰蛋白酶、TPCK-胰蛋白酶购自SIGMA公司;细胞瓶、细胞培养板购自COSTAR公司。
1.3 1%鸡红细胞悬液经翅静脉无菌采取成年公鸡血4 mL,与适量抗凝剂混匀,1500×g离心10 min,弃上清液及白细胞膜,加入适量生理盐水充分混匀,再次离心弃上清液,如此反复3次。取红细胞沉淀,用灭菌生理盐水配制1%红细胞悬液。
1.4 A549细胞培养从液氮中取出冻存的A549细胞,立即37℃水浴融化,离心弃去冻存液,用完全培养基(DMEM+10% FBS+10 μL/mL谷氨酰胺+青霉素100 IU/mL、链霉素100 μg/mL)反复吹打均匀,转移到细胞培养瓶中,加入适量细胞培养液,置37℃、5% CO2细胞培养箱中培养至细胞长成单层。
1.5 不同胰酶浓度对A549生长的影响待A549细胞在24孔细胞培养板上长成单层后,弃去上清液,PBS洗3次(3 min/次),以去除血清蛋白。在1-5列加入500 μL/孔分别含0.5、1.0、1.5、2.0、2.5 μg/mL TPCK-胰蛋白酶的细胞培养液,第6列加入等体积的细胞培养液(不含胰酶)作为对照。分别于12 h、24 h、36 h、48 h、60 h、72 h在倒置显微镜下观察细胞形态学变化。
1.6 H9N2病毒最佳感染剂量的确定用含1 μg/mL的胰酶维持液将病毒(HA滴度为9log2,毒价为104.3TCID50/mL)倍比稀释成终浓度为10-1、10-2、10-3、10-4、10-5、10-6、10-7的病毒悬液,取长成单层细胞的96孔板,PBS洗板3次,以除去残留血清蛋白及抑制性代谢物,1-7行分别加入浓度为10-1、10-2、10-3、10-4、10-5、10-6、10-7的病毒悬液各100 μL,第8行为对照(无病毒),吸附1 h后,弃去上清液,加入含0.3 μg/mL胰蛋白酶维持液。接种病毒后每12 h在倒置显微镜下观察细胞病变并取细胞上清液50 μL按常规方法[10]测定上清液中HA滴度。
1.7 猪源H9N2亚型流感病毒感染A549最佳胰酶维持液浓度的确定取已完全贴壁、细胞含量为70%的A549 24孔培养板,弃去细胞培养液,PBS洗3次(3 min/次),1-5列加入百倍稀释的病毒(稀释前HA滴度为9log2)悬液500 μL,第6列加入细胞培养基,置37℃、5% CO2细胞培养箱中吸附1 h后,弃去病毒悬液或培养基,1-5列分别加入胰酶浓度为0.2、0.3、0.4、0.5、0.6 μg/mL的维持液各500 μL,并设对照组,第6列为只含培养基的空白对照,置37℃、5% CO2温箱中孵育。接种病毒后每12 h在倒置显微镜下观察细胞病变并取细胞上清液50 μL按常规方法[10]测定HA滴度,确定胰酶维持液的最佳浓度。
1.8 猪源H9N2亚型流感病毒感染A549最佳吸附时间的确定取已完全贴壁、A549细胞含量为70%的6孔培养板4块,弃去细胞培养液,PBS洗板3次(3 min/次),依次加入100倍稀释的病毒液2 mL,1块培养板为对照,接种病毒后不吸附;3块培养板为试验组,置37℃、5% CO2培养箱中分别吸附1 h、1.5 h、2 h,待吸附时间结束后弃去病毒液,每孔加入2 mL含0.3 μg/mL的胰酶维持液。于12 h、24 h、36 h、48 h、60 h、72 h,72 h后冻融观察细胞病变并取细胞上清液50 μL按标准方法测定HA滴度。
1.9 最佳细胞培养液pH值的确定取已完全贴壁、A549细胞含量为70%的24孔培养板,弃去细胞培养液,PBS洗3次(3 min/次),各孔加入100倍稀释的病毒液500 μL,待吸附时间结束后弃去病毒液,1-5列分别加入pH值为7.0、7.2、7.5、7.8、8.0的细胞培养液(含0.3 μg/mL的胰酶)。接毒后12 h、24 h、36 h、48 h、60 h、72 h及72 h后冻融,观察细胞病变并取上清液按标准方法测定HA滴度,确定最佳细胞培养液pH值。
2 结果
2.1 不同胰酶浓度对A549生长的影响在A549细胞培养至12 h时,TPCK-胰酶浓度为2.5 μg/mL组细胞出现细胞变圆并伴随些许细胞从孔底脱落;在培养至24 h时,2.5 μg/mL组细胞基本全部破碎裂解为细胞碎片,2.0 μg/mL组细胞变圆并有大部分细胞出现破碎脱落;在培养至48 h时,1.5 μg/mL组细胞出现相似的细胞变圆肿胀、脱落及细胞裂解现象;直至72 h,1.5、2.0、2.5 μg/mL组细胞均变圆、脱落、破碎,而0.5 μg/mL组与对照组基本无明显变化。胰酶浓度高于1.0 μg/mL组,A549细胞出现大量的死亡、破碎现象,其损伤与TPCK-胰蛋白酶浓度的增加和培养时间的延长呈正相关。最终确定采用胰酶浓度为1 μg/mL。
2.2 不同的病毒接种浓度对细胞上清液HA滴度的影响由表1可知,对照组无HA滴度;在培养时间为36 h,病毒接种浓度为10-1和10-2时,细胞上清液开始出现HA滴度,为1.4log2、1.7log2;在病毒接种浓度为10-2,培养时间为72 h时HA滴度为6.4log2,而经反复冻融后,HA滴度达到峰值7.2log2;10-3感染组比10-1和10-2感染组的HA滴度出现时间晚12 h;10-5~10-7感染组都没有产生HA滴度。因此最终确定最佳病毒接种剂量为100 μL(104.3TCID50/mL),最佳病毒接种浓度为10-2。
2.3 不同的胰酶维持液浓度对细胞上清液HA滴度的影响由表2可知,对照组无HA滴度;培养时间为36 h时,维持液胰酶浓度为0.3 μg/mL和0.4 μg/mL同时出现HA滴度;而随着培养时间的延长,0.3 μg/mL组HA滴度明显高于0.4 μg/mL组,在培养时间为72 h并冻融时,HA滴度达到最高值6.3log2;而胰酶浓度低于0.3 μg/mL和高于0.4 μg/mL时,HA滴度出现时间较晚且均偏低。
2.4 不同的病毒吸附时间对细胞上清液HA滴度的影响由表3可知,对照组在72 h后才出现较低的HA滴度,3组在培养时间36 h时均产生了HA滴度;吸附1 h组在培养时间为72 h时细胞上清液的HA值为5log2,反复冻融后HA效价达到6.7log2;吸附1.5 h与吸附1 h组HA值相接近,但1 h组总体HA水平略高于1.5 h组;吸附2 h组相较其他两组产生的HA滴度要略低。

表1 不同猪源H9N2亚型流感病毒浓度接种A549细胞后对细胞上清液HA滴度的影响Table 1 Effect of different H9N2 viral infection dose on its proliferation HA titer in A549 cell

表2 不同浓度胰酶维持液对猪源H9N2亚型流感病毒在A549细胞中增殖(HA滴度)的影响Table 2 Effect of different concentration of TPCK-Trypsin on H9N2 viral proliferation in A549 cell(HA titer)
2.5 培养液pH值对细胞上清液HA滴度的影响从表4可知,在培养时间为36 h时,5个组均产生了较低水平的HA滴度;在培养液pH7.5时,培养时间为72 h时HA滴度达到6.4log2,冻融后细胞上清液中HA滴度可达到最高值7.2log2;培养液pH7.2时,上清液的HA滴度仅略低于pH7.5组;pH值过高或过低都会对细胞上清液HA滴度有影响。

表3 不同吸附时间对猪源H9N2亚型流感病毒在A549细胞中增殖(HA滴度)的影响Table 3 Effect of different adsorption time on virus proliferation in A549 cell(HA titer)
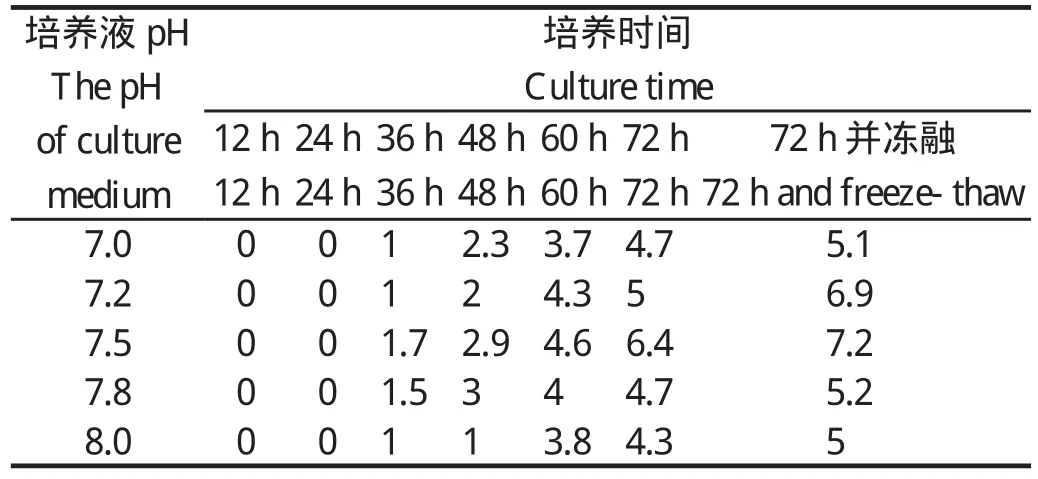
表4 不同pH值培养液对猪源H9N2亚型流感病毒在A549细胞中增殖(HA滴度)的影响Table 4 Effects of different pH culture medium on the proliferation (HA titer) of H9N2 subtype SIV in A549
3 讨论
相较于H5和H7等高致病性禽流感,H9N2属于低致病性流感病毒,因此需要胰蛋白酶帮助裂解血凝素(HA)以使病毒更好的附着于细胞表面受体,从而完成病毒复制,故在本实验中需加入胰蛋白酶帮助H9N2感染复制。若胰酶浓度偏低,则不能在病毒复制过程中起到帮助作用;而胰酶浓度过高,会影响细胞的生长状态,甚至会导致细胞变圆、破碎。本实验针对细胞对胰蛋白酶的最佳耐受浓度进行筛选,结果发现A549细胞对胰酶较为敏感,其最佳胰酶耐受浓度为1 μg/mL,而本课题组之前相同处理的PMVEC耐受性要略低于A549,为0.6 μg/mL[14];相同处理的MDCK对胰酶耐受性则高于A549,可达2.0 μg/mL。
本研究也对病毒感染时细胞维持液中胰蛋白酶的最佳浓度进行筛选,使用10-2的病毒浓度感染细胞,维持液胰酶浓度为0.3 μg/mL时A549细胞的生长状态及细胞上清液HA滴度最好。这与本课题组前期进行的研究中,猪源H9N2亚型流感病毒在PMVEC细胞中最佳胰酶维持液浓度相同。冯婷等[15]报道H1N1病毒在MDCK细胞中增殖的最佳胰酶浓度为0.25 μg/mL。陈润莉等[16]发现H1N1和H3N2病毒在MDCK细胞中增殖的最佳胰酶浓度为2.5~5.0 μg/mL病毒血凝价最高。史爱华等[17]研究H9N2亚型禽流感病在MDCK细胞中最佳增殖条件时使用10.0 μg/mL胰酶维持液。这可能是由于不同种类的细胞对胰酶的耐受度不同导致。
病毒稀释倍数对病毒复制的影响,本研究发现不同稀释倍数的病毒感染A549细胞在培养时间24 h内均无血凝价,在培养时间为36 h时10-1和10-2出现HA滴度,并在72 h时HA滴度达到高峰。李春艳等[18]发现H9N2在MDCK细胞中的培养时间为48 h时出现HA滴度,并在72 h时达高峰,与本研究结果趋势相同。在本课题组之前的H9N2对PMVEC及MDCK细胞的增殖影响试验中发现,10-7稀释的猪源H9N2亚型流感病毒在MDCK细胞也可增殖,其HA滴度仍达到7.8log2,猪源H9N2亚型流感病毒在PMVEC细胞[14]中增殖的最佳病毒稀释度与A549细胞一致,HA滴度可达6.8log2。MDCK细胞常被作为流感病毒扩增用的细胞,故A549细胞对流感病毒的易感性相较于MDCK细胞略低。
吸附时间对病毒增殖影响的试验中发现,猪源H9N2感染A549细胞时病毒吸附1 h时效果最好。史爱华等[19]利用3株H9N2感染MDCK细胞试验时发现采用1 h吸附,其病毒HA效价达到6log2。而在本课题研究猪源H9N2亚型流感病毒感染PMVEC试验中发现2 h吸附效果最好。吸附时间高于2 h时对病毒增殖并无影响。
培养液pH值对病毒在A549细胞中扩增的影响中试验,发现,细胞培养液pH值为7.5时病毒增殖效果最好。这与李春燕等[18]发现的H9N2禽流感病毒在MDCK细胞中扩增的最佳培养液pH值为7.4,细胞上清液HA最高滴度为9log2的研究结果相同。
本研究显示,尽管猪源H9N2亚型流感病毒对A549细胞感染能力较低,但其仍可以感染A549细胞,试验确定其最佳增殖条件为病毒稀释度为10-2,胰酶维持液浓度为0.3 μg/mL、病毒吸附时间1 h、培养液pH值为7.5。

