幽门螺杆菌唾液酸结合黏附素(SabA)的克隆表达*
李冬宏,宫雅楠,肖 迪,周南进,谢 勇,张建中
幽门螺杆菌唾液酸结合黏附素(SabA)的克隆表达*
李冬宏1,2,宫雅楠1,肖 迪1,周南进2,谢 勇3,张建中1
目的构建幽门螺杆菌(Helicobacter pylori,简称H.pylori或Hp)唾液酸结合黏附素(sialic acid-binding adhesion,Sab A)的重组质粒,并在大肠杆菌BL21中表达,为探讨Sab A的功能及相关疫苗的发展提供帮助。方法以Hp 26695株基因组为模板,设计sabA基因特异性引物扩增目的基因,将PCR产物插入到pGEX-4T-1载体构建重组质粒,在大肠杆菌BL21中诱导表达。表达蛋白经飞行质谱鉴定,并用免疫印迹法评价其抗原性。结果经SDS-PAGE和飞行质谱鉴定,该表达蛋白为Hp外膜蛋白Sab A,经免疫印法迹检测具有良好的抗原性。结论成功克隆了Hp的Sab A,并能在大肠杆菌BL21中表达,该蛋白具有良好的抗原性。
幽门螺杆菌;唾液酸黏附素;基因克隆;表达
幽门螺杆菌(Helicobacter pylori,H.pylori或Hp)感染与慢性胃炎、消化性溃疡、胃癌和胃黏膜相关淋巴样组织(MALT)淋巴瘤的发病密切[1-3]。Hp的定植是致病的前提,而黏附素对其定植有着至关重要的作用。唾液酸结合黏附素(sialic acidbinding adhesion,Sab A)是新近发现的一种黏附素,它又称Hp外膜蛋白17(outer membrane protein,OMP17),在Hp致病中起着重要作用,它与胃黏膜萎缩、肠上皮化生和胃癌的发生密切相关[4]。本研究拟构建sab A重组质粒,并对表达的Sab A进行初步探讨,为后续致病机理研究和以其为靶点的Hp疫苗研究奠定基础。
1 材料和方法
1.1 材料 Hp 26695菌株及表达质粒p GEX-4T-1为中国疾病预防控制中心传染病所诊断室(传染病预防控制国家重点实验室)保存;大肠杆菌BL21、琼脂糖、质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒均购自天根生化科技有限公司;限制性内切酶Bam HⅠ、XhoⅠ、Ta KaRa LA Taq酶、1 kb DNA Ladder Marker、T4DNA连接酶均购自Ta KaRa公司;QIAamp DNA Mini Kit购自QIAGEN公司。1.2 方法
1.2.1 基因组和表达质粒的提取 按照QIAamp DNA Mini Kit和质粒小提试剂盒的操作方法,提取Hp 26695菌株的基因组和表达质粒p GEX-4T-1。
1.2.2 目的基因的扩增 根据 GenBank(ID:899697)中Hp 26695菌株omp17基因序列,利用Primer Premier 5软件设计特异性引物,并在5′端加入合适的内切酶位点,引物由上海生工生物有限公司合成。引物序列如下:
上游引物ATGGATCCAGCGCCGGCTATCAAATCG,
下游引物CGCTCGAGTCAGTAAGCGAACACATAATTGAGATA
上下游引物分别加入的酶切位点为Bam HⅠ、XhoⅠ。采用聚合酶链反应(PCR)以Hp 26695菌株基因组为模板扩增sabA基因片段,其反应条件为:预变性95℃10 min、变性95℃1 min、退火55℃1 min、延伸72℃2 min、终延伸72℃5 min,35个循环。所获PCR产物经1%琼脂糖凝胶电泳后,进行琼脂糖凝胶DNA回收,其方法按试剂盒操作。1.2.3 pGEX-4T-1/sab A重组质粒的构建 取回收后的PCR产物和提取的表达质粒进行Bam HⅠ和XhoⅠ双酶切反应,琼脂糖凝胶鉴定后回收。后将回收产物进行连接反应,其中PCR产物与p GEX-4T-1比例为1∶3,金属浴16℃过夜连接,连接产物转化至E.coli BL21后,并涂布于含有氨苄青霉素(100μg/m L)的LB固体培养基上培养过夜,其详细方法参见《分子生物学实验指南》[5]。
1.2.4 重组质粒的鉴定 挑取单克隆菌落,提取质粒做质粒PCR,然后用限制性内切酶Bam HⅠ、XhoⅠ30℃酶切1 h后再37℃酶切3 h,鉴定重组质粒是否构建成功。
1.2.5 诱导表达及表达产物的SDS-PAGE经鉴定成功的阳性克隆株在LB液体培养基中37℃培养过夜,然后按照1∶100转接至含氨苄青霉素的LB培养基中,继续培养至OD600值为0.6~0.8时,加入终浓度为1.0 mmol/L的IPTG,诱导4 h。收集菌液,将菌液用PBS清洗,离心弃上清,再加入30 μLPBS和10μL蛋白上样缓冲液煮沸10 min后进行12%SDS-PAGE分析。
1.2.6 飞行质谱鉴定 诱导表达产物经聚丙烯酰胺凝胶电泳(SDS-PAGE)后,在凝胶的相应位置切下表达蛋白条带,按照飞行质谱样制备操作流程制备质谱样,然后经过4700 MALDI-TOF-MS蛋白质组分析系统分析鉴定是否为Sab A。
1.2.7 免疫印迹 将诱导表达菌样品进行SDSPAGE,再转到0.45μm的PVDF膜上,用抗 Hp 26695全菌蛋白免疫兔血清(1∶100稀释,抗体由中国疾病预防控制中心传染病所诊断室制备)室温孵育3 h,再用辣根过氧化物酶标记的羊抗兔二抗(1∶10 000稀释)室温孵育2 h,用DAB显色。
2 结 果
2.1 sabA基因的扩增 以Hp 26695基因组DNA为模板进行目的基因扩增。PCR产物经1%琼脂糖凝胶电泳鉴定,得到一条大小约1 890bp的片段,与目的基因的大小相符(图1)。
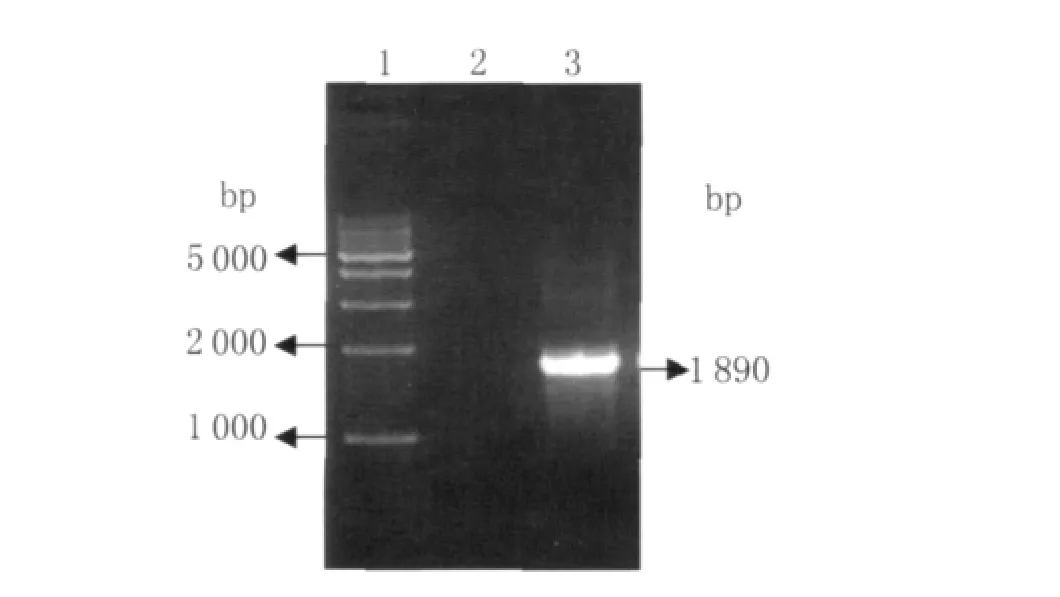
图1 PCR产物凝胶电泳分析1:1 kb DNA Ladder Marker;2:阴性对照;3:PCR 扩增sabA产物Fig.1 Agarose gel electrophoresis analysis of PCR products 1:1 kb DNA Ladder Marker;2:negative control;3:sab A of PCR products
2.2 重组质粒的酶切鉴定 将重组质粒p GEX-4T-1-sab A经Bam HⅠ和XhoⅠ双酶切后1%凝胶电泳鉴定,得到两条目的条带,大小分别约为4 969bp(p GEX-4T-1)和1 890bp(sabA),符合预期结果(图2),证明重组质粒构建成功。
2.3 诱导表达产物的SDS-PAGE和飞行质谱鉴定包含重组质粒p GEX-4T-1-sab A的菌株经诱导后进行12%SDS-PAGE,发现在90 k D附近出现大量表达蛋白条带,与预计大小95 k D(含GET标签蛋白26 k D)相比稍微偏小(图3),切下该处的蛋白条带按质谱样制作标准流程制备质谱样,经飞行质谱分析,为Hp外膜蛋白17(表1),表明该重组质粒在E.coli BL21中成功表达Sab A。
2.4 免疫印迹 将12%SDS-PAGE分离的蛋白样转移至PVDF膜上,Western blot结果显示在95k D附近出现了一条特异性条带,且条带位置与SDSPAGE图中目的条带位置一致,说明表达蛋白具有良好的抗原性(图4)。
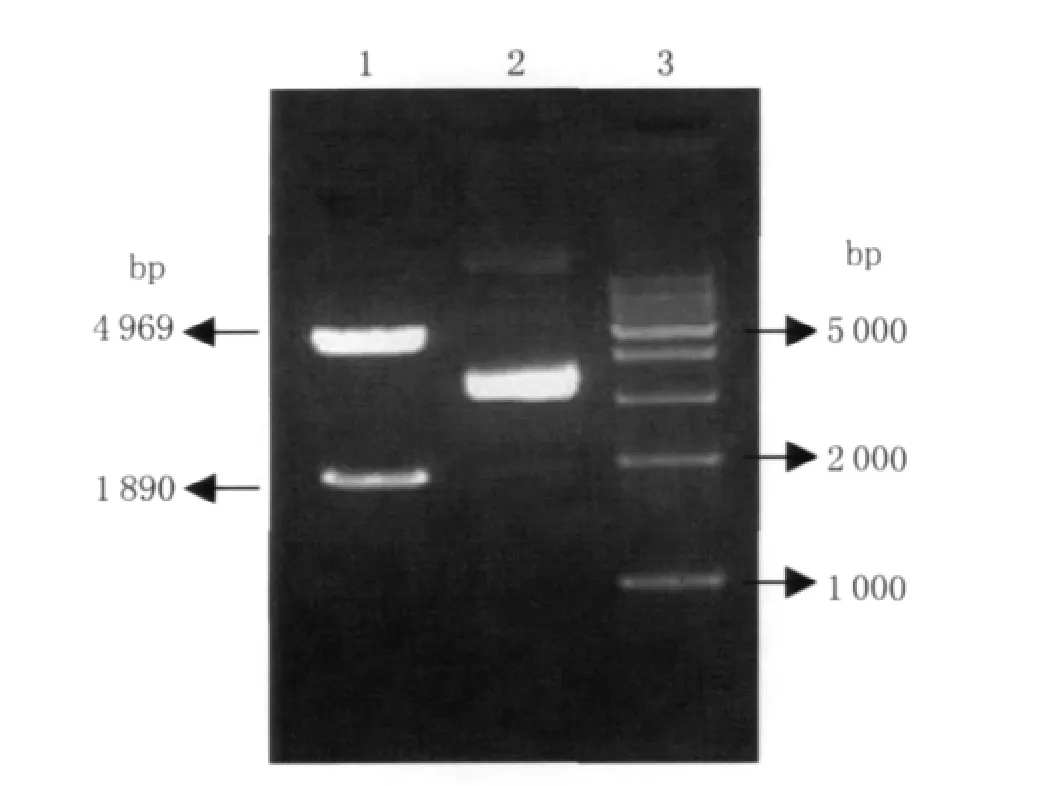
图2 重组质粒pGEX-4T-1-sabA双酶切电泳图1:重组质粒pGEX-4T-1-sab A双酶切样品;2:重组质粒pGEX-4T-1-sab A样品;3:1 kb DNA Ladder MarkerFig.2 Identification of recombinant plasmid pGEX-4T-1/sabA by restricted endonuclease enzymes 1:Digested by Bam HⅠand XhoⅠ;2:Recombinant plasmid pGEX-4T-1/sab A;3:1 kb DNA Ladder Marker
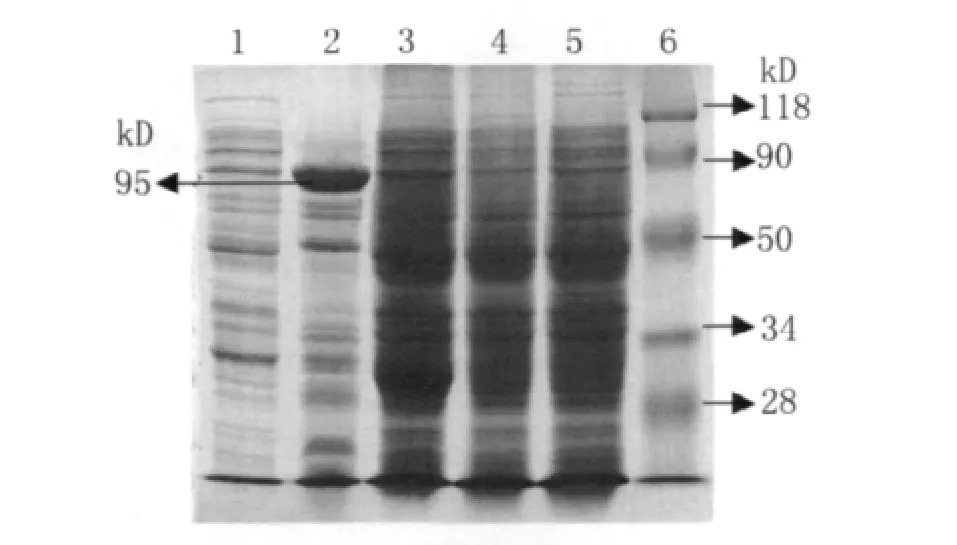
图3 诱导表达产物SDS-PAGE图1:重组质粒pGEX-4T-1-sab A未诱导样品;2:重组质粒pGEX-4T-1-sab A诱导样品;3:空pGEX-4T-1诱导样品;4:E.coli BL21未诱导样品;5:E.coli BL21诱导样品;6:蛋白 MarkerFig.3 SDS-PAGE analysis of Sab A recombinant protein expressed in BL21 1:recombinant plasmid p GEX-4T-1/sab A before induction;2:recombinant plasmid p GEX-4T-1/sab A induction with IPTG;3:plasmid p GEX-4T-1 induction with IPTG;4:E.coli BL21 before induction;5:E.coli BL21 induction with IPTG;6:molecular mass marker

表1 诱导表达蛋白飞行质谱鉴定结果Tab.1 Identification of SabA recombinant protein by time-of-flight mass spectrometry
3 讨 论
Hp粘附于人胃黏膜必须有特异的黏附素和相应受体,Hp的黏附素目前已知有二十多种,但受体明确的不多[6]。2002年Jafar等[7]在研究 CCUG 17875突变株时,意外发现CCUG 17875 bab A2突变株能与感染Hp的胃炎病人的胃黏膜结合,从而发现了一种新的黏附素Sab A,它能够特异性地与胃黏膜上皮细胞表面的唾液酸化的路易斯(sialyl-Lewis X/A,s LeX/A)抗原结合,并对sab A 阳性菌株的定植起着重要作用[8]。在Hp感染初期,Bab A与Leb血型抗原结合有利于Hp在胃黏膜的定植,然而随着炎症的加剧,胃黏膜上皮s LeX/A表达增加,Hp就要通过Sab A在胃黏膜定植。SLeX/A是唾液酸糖复合物,它在正常胃黏膜中含量很少,但是随着Hp感染和其诱导的炎症持续存在,正常状态下胃黏膜的路易斯抗原被s LeX/A取代[9]。虽然目前国外学者对 Hp的Sab A进行了研究[10-14],但至今人们对Sab A在Hp粘附过程中的作用及其功能尚不是十分清楚,其致病机理还有待进一步研究探讨。
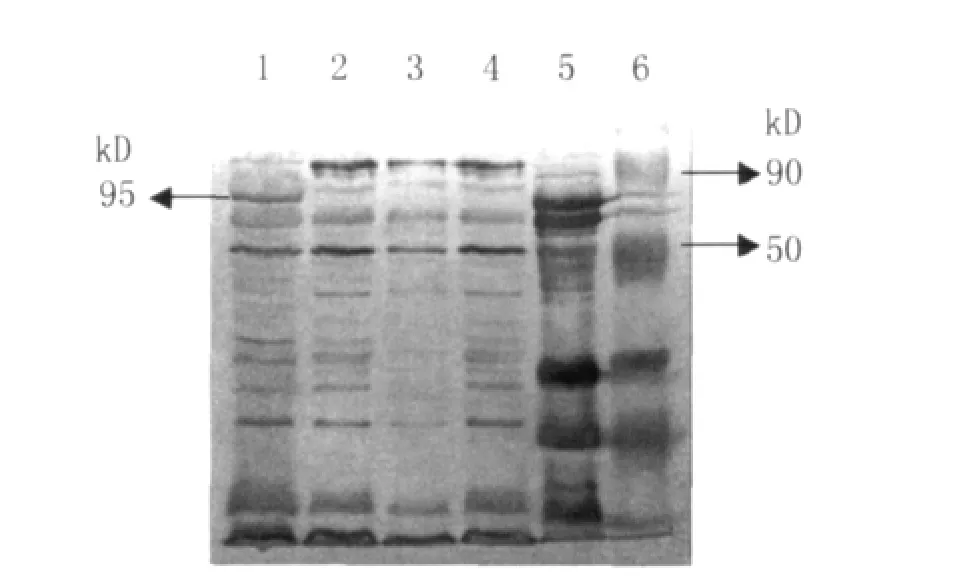
图4 表达蛋白免疫印迹1:重组质粒p GEX-4T-1-sab A诱导样品;2:重组质粒pGEX-4T-1-sab A未诱导样品;3:空 pGEX-4T-1诱导样品;4:E.coli BL21诱导样品;5:Hp全菌蛋白;6:蛋白markerFig.4 Protein expression by immunoblot analysis 1:recombinant plasmid p GEX-4T-1/sab A induction with IPTG;2:recombinant plasmid pGEX-4T-1/sab A before induction;3: plasmid p GEX -4T-1induction with IPTG;4:E.coli BL21 induction with IPTG;5:Helicobacter pylori whole cell protein;6:molecular mass marker
随着生物技术的发展,蛋白质结晶逐渐应用于分子的生物学功能研究的这一领域,并有着重要的意义。本研究构建的重组质粒p GEX-4T-1-sab A表达蛋白中含有GST标签,便于该融合蛋白的纯化,为该蛋白质的结晶创造了有利的物质条件,并对分析该蛋白的三级结构及推测相关生物学功能奠定了基础,从而探索出研究该蛋白功能的新途径,这为深入研究Sab A的功能和致病机制奠定了基础。
基因工程疫苗是防治Hp感染的一种很有前途的手段,而Hp外膜蛋白大多数位于细菌表面,具有表面暴露的特性,能引起机体的免疫反应,因此许多Hp疫苗的研究均以其外膜蛋白疫苗为抗原[15-16]。粘附是Hp感染的先决条件,也是致病的关键,编码黏附素的sabA基因为Hp所特有,并在不同菌株相对保守,通过比对Hp 26695与Hp SJM180、B8、J99、P12、HPAG1、PeCan4、B38的sab A 基因的核苷酸序列和氨基酸序列,发现其核苷酸序列同源性都在87%~95%,氨基酸序列同源性在78%~94%,其中在Hp P12株变异程度最大,剔除Hp P12株信息后基因序列同源性都在91%以上,氨基酸序列同源性都在89%以上。这结果表明虽然sab A基因存在多态性,但相对于其他蛋白该外膜蛋白更保守。本研究通过Western blot进一步分析,发现该表达蛋白具有良好抗原性,提示Sab A有望成为Hp疫苗研究的候选抗原成分。
[1]Basso D,Plebani M,Kusters JG.Pathogenesis of Helicobacter pylori infection[J].Helicobacter,2010,15(Suppl.1):14-20.
[2]Olfat FO,Zheng Q,Oleastro M,et al.Correlation of the Helicobacter pylori adherence factor Bab A with duodenal ulcer disease in four European countries[J].FEMS Immunol Med Microbiol,2005,44:151-156.
[3]Timothy LC.Role of Helicobacter pylori Outer Membrane Proteins in Gastroduodenal Disease[J].Journal of Infectious Disease,2006,194:1343-1345.
[4]Yamaoka Y,Ojo O,Fujimoto S,et al.Helicobacter pylori outer membrane proteins and gastroduodenal disease[J].Gut,2006,55:775-781.
[5]Ausubel FM,Brent R,Kingston RE,et al.颜子颖,王海林译.精编分子生物学实验指南[M].北京:科学出版社,1998.
[6]Mobley HLT,Mendz GL,Hazell SL.Helicobacter pylori:Physiology and Genetics[M].ASM Press,2001.
[7]Mahdavi J,Sonden B,Boren T,et al.Helicobacter pylori Sab A adhesin in persistent infection and chronic inflammation[J].Science,2002,297(5581):573-578.
[8]Nakasato F,Shimoyama T,Yoshimura T,et al.Infection of sab A-positive H.pylori does not induce anti-Lewis X antibody in host[J].Hepato-Gastroenterology,2008,55:1122-1125.
[9]Mahdavi J,Sonden B,Hurtig M,et al.Helicobacter pylori Sab A adhesin in persistent infection and chronic inflammation[J].Science,2002,297(5581):573-578.
[10]Yamaoka Y.Increasing evidence of the role of Helicobacter pylori Sab A in the pathogenesis of gastroduodenal disease[J].Infect Dev Ctries,2008,2(3):174-181.
[11]Yanai A,Maeda S,Hikiba Y,et al.Clinical relevance of Helicobacter pylori sab A genotype in Japanese clinical isolates[J].Gastroenterol Hepatol,2007,22(12):2228-32.
[12]Nishioka M,Takeuchi H,Con SA,et al.The mechanical binding strengths of Helicobacter pylori Bab A and Sab A adhesins using an adhesion binding assay-ELISA,and its clinical relevance in Japan[J].Microbiol Immunol,2010,54(8):442-51.
[13]Sheu BS,Odenbreit S,Hung KH,et al.H.pylori Sab A enhances H.pylori density in patients lacking gastric Lewis B antigen[J].Am J Gastroenterol,2006,101:36-44.
[14]Yamaoka Y.Increasing evidence of the role of Helicobacter pylori Sab A in the pathogenesis of gastroduodenal disease[J].Infect Dev Ctries,2008,2(3):174-181.
[15]刘东升,周南进,谢勇,等.幽门螺杆菌Bab A2/UreI融合基因减毒伤寒沙门菌重组活载体疫苗的构建与鉴定[J].中华消化杂志,2009,29(9):564.
[16]Voland P,Hafsi N,Zeitner M,et al.Antigenic Properties of HpaA and Omp18,two outer membrane proteins of Helicobacter pylori [J].Infection and Immunity,2003,71 (7):3837-3843.
Cloning and expressing of Helicobacter pylori sialic acid-binding adhesion(SabA)
LI Dong-hong1,2,GONG Ya-nan2,XIAO Di2,ZHOU Nan-jin1,XIE Yong3,ZHANG jian-zhong2
(1.The Medical Institute of Nanchang University,Nanchang 330006,China;2.Department of Diagnosis National Institute for Communicable Disease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing 102206,China;3.Institute of Gastroenterology,The First Affiliated Hospital of Nanchang University,Nanchang 330006,China)
The aim was to construct a recombinant plasmid that expresses the Helicobacter pylori(H.pylori)sialic acid-binding adhesion(Sab A)for the further study of vaccine and function of Sab A.The primers were designed according to the sequence of the H.pylori 26695 sab A gene.PCR products were inserted into expression vector pGEX-4T-1,and transformed into E.coli BL21 strain for the expression.The recombinant protein was identified by MALDI-TOF-MS and the antigenicity was tested by Western blot.Results indicated that the recombinant protein was identified as H.pylori outer membrane protein Sab A by SDS-PAGE and MALDI-TOF-MS,which showed good antigenicity in Western blot.It's concluded that the gene sab A of H.pylori 26695 was successfully cloned and expressed in E.coli BL21,and the protein expressed has good antigenicity.
Helicobacter pylori;Sab A;gene cloning;expression
R378.2
A
1002-2694(2012)03-0197-04
*国家科技支撑计划(No.2007BAI04B02)资助
张建中,Email:zhangjianzhong@icdc.cn
1.中国疾病预防控制中心传染病预防控制所诊断室,传染病预防控制国家重点实验室,北京 102206;2.南昌大学医学科学研究所,南昌 330006;3.南昌大学第一附属医院消化研究所,南昌 330006
2011-10-27;
2012-01-05

