丹聂耳电池中正负离子的行为分析
——澄清长期存在的某些谬误
苏永乔
(北京师大附中 北京 100052)
1 常见错题及其流行解法
【例题】图1为丹聂耳原电池的工作电路.在原电池中,5 s内从左往右穿过截面S的负电荷为2 C,从右往左穿过截面S的正电荷为2 C.则电解液中的电流为______A.
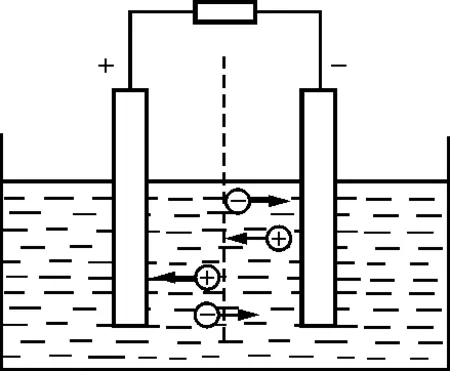
图1 丹聂耳电池的工作电路
解析:由题意可知,电流由正、负离子定向运动形成.负离子的反向运动与正离子的正向运动等价,则在 5 s内通过某截面的总电荷量应为
q=4 C
由
得
I=0.8 A
从上面的题设和解答中,可以看出命题者对原电池的供电过程是如下理解的.
电路中的总电流为0.8 A,说明1 s内有 0.8 C的自由电子通过外电路中任一截面.而在内电路中,电流从电源的负极流向正极.也就是说,在电源负极,每秒除吸收0.4 C的负离子(负离子把电子传给极板)外,同时还生成0.4 C的正离子.在电场力的作用下,这些正离子向正极定向运动.在电源正极,每秒钟有0.4 C的正离子得到电子被还原,同时还生成0.4 C的负离子.在电场力作用下,这些负离子向负极定向运动.这样,才能确保内外电路的电流强度都是0.8 A.
然而经过笔者查阅资料,认真分析,发现以上解释看似合理,但并不符合物理事实.在本文中,笔者尝试从电源的正、负极间为什么会有电势差,铜板和锌板之间的电势差有多大,原电池的供电过程及原电池中负离子浓度的分布等四个方面谈这个问题,希望能够引起各位同仁对此的关注,并试图纠正长期以来的错误认识.
2 电源的正负极间为什么会有电势差
丹聂耳电池结构如图2所示[5],铜板和锌板分别浸在硫酸铜和硫酸锌溶液中.

图2 丹聂耳电池
金属正离子形成空间点阵,在其平衡位置做热振动;或者说金属正离子处于周围离子所形成的“势阱”之中.但任何温度下,总有少数正离子有足够的能量脱离势阱,在空间点阵中造成缺陷,称为“热缺陷”.即金属表面的离子脱离原来的平衡位置,运动到点阵的空隙中去,而在原来的平衡位置处留下一个空穴.这时晶体表面处显负电性,金属正离子所到之处显正电性.
电极和溶液的接触层间电势差的存在,正是由于金属热缺陷的结果.
当锌板插入硫酸锌溶液时,由于热运动,锌表面的正离子就可能有少数进入水中,并与周围的水分子发生相互作用.如图3所示,锌离子进入水中后,它的库仑力使其周围的水分子极化,使水分子围着它整齐的排列.这样的锌离子和水分子构成的小集团叫做水化离子.
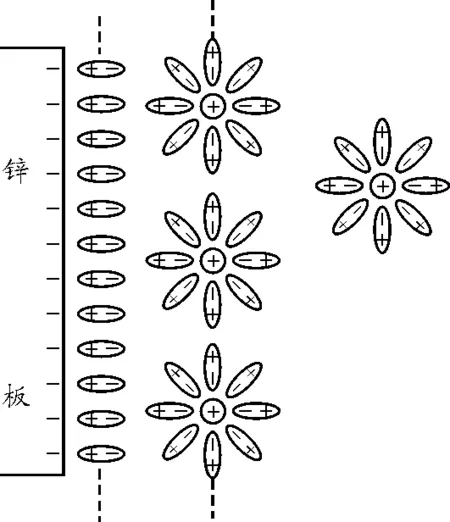
图3 锌离子溶入水中形成水化离子
当有部分锌离子进入硫酸锌溶液,并与溶液中的水分子形成水化离子后,即在金属表面处形成一负电荷层.金属表面的负电荷对金属内的其他金属正离子有一个向外的库仑力作用.正是因为受到金属表面的负电荷库仑力,才使其余的金属离子逸出金属表面变得更容易.也就是说,金属中的其余正离子进入溶液的逸出功变小了,因而加速了金属离子的自动溶解.
随着水化锌离子的增多,锌板上聚集的电子数目也逐渐增多,对将要进入水中的正离子引力也逐渐增大.同时,锌板表面的负电荷对溶液中的锌离子也有一个使其回到锌板上的作用力.因此,锌离子在不断溶解进入溶液中的同时,受到锌板上负电荷的吸引力的作用和锌离子自身的热运动影响,也向锌板沉积,还原为锌原子.当锌离子的溶解速度与沉积速度相等时,就达到动态平衡.这时,若无外力作用,水化锌离子和极板上的负电荷形成相对稳定的电偶层,电偶层的厚度大约为水化锌离子的直径.
由于锌板带负电,水化锌离子带正电,在电偶层中就存在从水化锌离子指向锌板的电场,水化锌离子和锌板间就产生了一定的势差;锌板的电势低于水化锌离子层的电势,记为UCB(如图4).
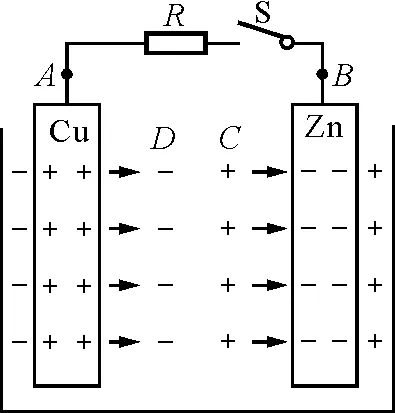
图4 铜板与锌板附近电偶层中的电场方向
但是,当铜板插入硫酸铜溶液时,情况则恰好与锌插入硫酸锌溶液相反.铜离子脱离晶格进入硫酸铜溶液的逸出功大于铜离子脱离晶格进入真空的逸出功.也就是说,处于溶液中的铜板上的铜离子溶入硫酸铜溶液甚至比处于空气中的铜板上的铜离子进入空气中还困难.大家知道,处在空气中的铜比较稳定;从铜板上进入空气中的铜离子极少.因此,处于硫酸铜溶液中的铜离子进入溶液的数目就更少了.
然而,铜板上除了有铜离子之外,还有大量的自由电子.虽然铜离子不能脱离铜板进入溶液,但由于热运动,铜板上的自由子却从铜板上逸出,进入溶液,使Cu带正电,成为电源的正极.逸入硫酸铜溶液中的自由电子和带正电的铜板也形成相对稳定的电偶层,其厚度约为一水化离子的直径.
在电偶层内有从铜板指向自由电子层的电场,因此,铜板的电势高于自由电子层的电势差.由于电偶层相对稳定,所以铜板和自由电子层(硫酸铜溶液)之间的电势差也是稳定的,记作UAD.
铜板和锌板附近电荷分布情况,锌板和水化锌离子电偶层间的电场强度的方向,铜板和自由电子电偶层间的电场强度的方向如图4所示.
从上面的分析可以看出,分别插入硫酸铜溶液和硫酸锌溶液的铜板和锌板之间存在一定的电势差,铜板电势高,锌板电势低.铜板和电子层、锌离子和锌板之间的电势差示意图如图5所示[5].
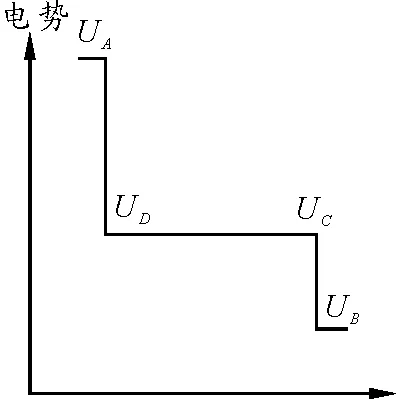
图5 铜板锌板之间电势的变化情况
3 铜板和锌板之间的电势差有多大
玻尔兹曼分布律是一个普遍的规律,它对任何物质的微粒(气体、液体、固体的原子和分子、布朗粒子等)在任何保守力场(重力场、电场)中运动的情形都成立[6].
铜板和锌板间之所以有电势差,是因为金属离子和电子的无规则热运动的结果.因此,离子和自由电子在其中应服从玻尔兹曼分布.
下面,利用玻尔兹曼分布,对锌离子与锌板之间的电势差进行计算.
设n01表示锌板表面单位体积的锌离子数,n1为单位体积内有能力从锌板进入溶液的锌离子数,UCB表示锌离子和锌板电偶层的电势差,Z为原子价,W1为锌离子从锌板进入溶液的逸出功.
因此,由能量转化与守恒定律,能从锌板进入溶液中的锌离子应具有的最小能量为
E1=W1+ZeUCB
(1)
由玻尔兹曼分布,单位体积的锌板上能量超过E1的锌离子的数目为
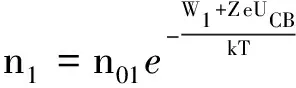
(2)
设单位时间内离子从锌板进入溶液的分子数为u1,它应与n1成正比.设比例系数为K1,则
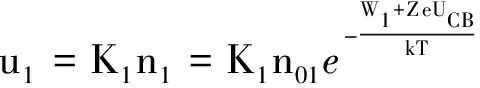
(3)
另一方面,在锌离子不断溶解的同时,也有锌离子回到锌板.设分散在溶液中的锌离子返回锌板表面时,越过包围它的极化水分子所需要的功为W2;锌离子越过电偶层到达锌板表面时,电偶层电场对它做正功,功的大小为ZeU.
因此,由能量转化与守恒定律,能从锌离子层沉积到锌板上的锌离子的最小能量为
E2=W2-ZeUCB
(4)
设ρ为溶液中锌离子层内锌离子的浓度,n2为锌离子层中单位体积内能量超过E2的锌离子的数目,u2为单位时间内沉积到锌板表面的锌离子数目,同样由玻尔兹曼分布可得
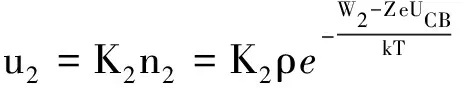
(5)
K2为比例系数,达到动态平衡时,u1=u2,即
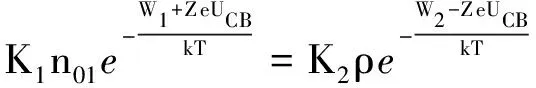
(6)
所以,锌板和锌离子层之间的电势差为
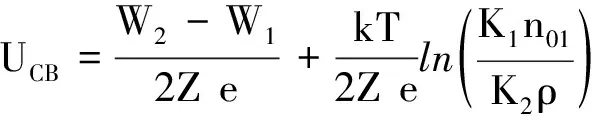
(7)
上式表明,在温度恒定的情况下,锌板离子层与锌板之间的电势差由W1,W2,Z,e,n01和ρ决定.
对于新电池和旧电池来说,虽然溶液中的锌离子浓度不同,但锌离子层中的锌离子浓度ρ的变化却不大.这是因为,随着电池工作时间的加长,溶液中的锌离子浓度的确在逐渐增大,但锌离子层中的锌离子浓度却只与锌板上锌离子的热运动密切相关,所以变化很小.也就是说,在原电池中,锌离子层中锌离子浓度几乎是恒定的.因此,式(7)中的第二项可以认为是一个不变量.
由上面的论述,我们可以认识到,在一定温度下工作的电源,锌板与锌离子层之间的电势差基本恒定.这也是新旧电池电动势几乎一样的原因.
4 原电池的供电过程
把电池的两极用导体连接起来,如图6(a)所示.锌板上的电子在电场力的作用下通过外电路的导体流到铜板上去与正电荷中和.在这个过程中,电场力做正功,电势能转化为其他形式的能.外电路中的电流就是单位时间内从锌板流到铜板的电子所携带的电荷的数值.
锌板上的电子在电场力的作用下沿外电路运动至铜板上,使两极上的电荷减少,电偶层内的电场减弱,破坏了原有的动态平衡.锌离子不断地溶解,铜离子不断地沉积,使得溶液中的正离子在锌板附近增多.同理,在铜板附近,自由电子也增多.带正电的锌离子和自由电子在溶液内部产生电场,电场方向从C指向D,从而使C,D间形成一定的电势差,C点的电势高于D点的电势.这个电场推动电荷流动形成电流.若电流强度为I,溶液中的内阻为r,则在r两端,也就是在溶液两边C,D之间的电势差为
UCD=Ir
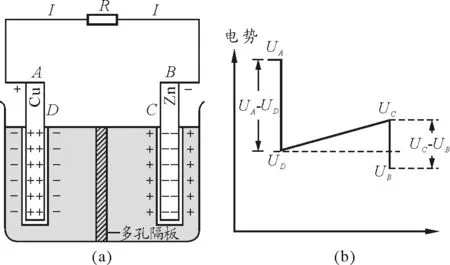
图6 丹聂耳电池(放电情形)
在电池内部,各处的电势的变化情况如图6(b)所示[5].
原电池在工作过程中,溶液和外电路形成闭合回路.在闭合回路中,有下面的等式成立:
电路中的电流=
单位时间内通过外电路的自由电子所携带的电荷=
单位时间内从溶液中沉积到铜板上的铜离子所得到的电子的电荷=
单位时间内从溶液中沉积到铜板上的铜离子所带的电荷=
单位时间内通过溶液某一截面的正电荷所带的电荷=
单位时间内从锌板溶解的锌离子所带的电荷
由此,可以得到如下两个结论:
(1)在电源的负极(锌板),只有锌离子不断溶解进入溶液.即锌板只存正离子不断生成的过程,由于锌板与锌离子电偶层的存在,负离子不可能从电解质溶液中沉积到锌板上;
(2)在丹聂耳电池中,参与导电的只有正离子.
由此可以看出,本文引用例题中所述的物理过程是不可能出现的.
5 原电池中负离子浓度的分布
如上所述,在丹聂耳电池中,溶液中的正离子在电场力的作用下定向移动,形成电流.溶液中的负离子会受到逆着电场方向的电场力的作用,从D向C运动.但由于锌板周边的电偶层和水合分子壁垒的作用,负离子无法到达锌板,导致C附近负离子浓度高,D附近负离子浓度低.但负离子会不会持续定向运动下去,而电源中的总电流为正负离子定向移动形成的电流之和呢?
电路闭合时,设溶液中的电场强度为E内,电场方向由负极附近的锌离子层指向正极,如图7.

图7 电池内的电场方向
建立坐标轴x,锌离子层处为坐标原点,电场方向为x轴正方向.设锌离子层处的电势为零,则在溶液中,各点的电势为
U=-E内x
(8)
设负离子的化合价为Z′,则负离子在此静电场中具有的电势能为
Ep=-Z′eU=Z′eE内x
(9)
设在x=0处,单位体积内的负离子个数为n03,则由玻尔兹曼分布可知,溶液中单位体积内负离子的个数与负离子的位置坐标x变化的函数关系为
(10)
注意到函数表达式中没有时间项,所以电路闭合时,溶液中的负电荷处在一个稳定的势场中,各个位置的粒子浓度分布只与位置坐标有关.负电荷在电解液中的这种分布特征,非常类似于空气分子在重力场中的分布.在重力场中,空气分子的浓度也是按高度分布,低的地方浓度大,高的地方浓度小.在重力作用下,气体分子向下的定向运动与由于浓度分布不均的分子热运动的效果相抵消,使气体分子在宏观上也处于一种稳定的分布状态.
因此,电源正常工作时,溶液中的负离子有一个
稳定的分布,电场力作用下负离子的定向运动的效果和无规则热运动的效果完全抵消.从宏观上看,负离子在空间形成一稳定的分布.
由此,对于丹聂耳电池,我们有如下结论:从宏观上看,负电荷没有定向运动.丹聂耳电池内部的电流是由正电荷在静态的负电荷(从宏观角度说)的背景下定向运动形成的.闭合电路中的电流的大小等于单位时内从电源负极经外电路定向移动到电源正极的自由电子所携带的电荷,也等于单位时间内从电源负极经内电路定向运动到电源正极的正离子所携带的电荷.
通过以上的讨论,我们对原电池内电荷运动的情况有了比较深入的理解.发现前述例题描述的物理过程与实际情况不相符,是想当然的产物.这也就提示我们,在编物理试题的过程中,不但要注意尽量不犯或少犯科学性的错误,同时也要避免通过这种问题的演练造成对真实物理情境的误解.
参考文献
1 马本堃,高尚惠,孙煜.热力学与统计物理学(第一版).北京:高等教育出版社,1980
2 陈鹏万.电磁学(第一版).北京:人民教育出版社,1978
3 (日)川胜博著.吴崇汉,彭双潮译.川胜教授的中学物理教案.南京:东南大学出版社,2002
4 中学物理教师手册编写组.中学物理教师手册.上海:上海教育出版社,1982
5 赵凯华,陈熙谋.电磁学(第一版).北京:人民教育出版社,1978.197,198
6 李椿,章立源,钱尚武.热学(第一版).北京:人民教育出版社,1978.92
——碳正离子的产生及稳定性比较

