沙丁胺醇气雾剂微生物限度检查的方法建立和验证
霍天凤
(河南省焦作市食品药品检验所 河南焦作 454000)
微生物限度检查是检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法,检查项目包括细菌数、霉菌数、酵母菌数以及控制菌检查[1]。是对生产单位是否按GMP规范生产的验证。在实际检验工作中,由于某些药品成分具有抗菌活性,抑制了药品中微生物的生长,按常规法检验不能真实地反映药品中污染微生物的情况,必须先消除供试品中的抑菌活性,再根据中国药典规定的方法进行检查[2~4],同时,必须对所采用的检测方法进行验证,以确认其抑菌活性的消除和检查方法的有效性和可靠性。
沙丁胺醇为选择性较强的β2受体激动剂,吸入时对心脏的兴奋作用比异丙肾上腺素小,沙丁胺醇扩张支气管作用,第一秒钟最大呼吸量和心率增加作用随剂量平行上升,其扩张支气管作用约为心率作用的8倍。沙丁胺醇气雾剂中含有乙醇,具有抑菌作用,显然不能用常规的微生物限度检查方法,本文采用薄膜过滤法,并进行方法验证,结果薄膜过滤法用于沙丁胺醇气雾剂的微生物限度检查科学、准确。
1 仪器与材料
1.1 仪器
GHP-9162型电热恒温培养箱(慧科电子);SPX-150型生化培养恒温箱(慧科电子);LMQ.C-3260J型立式灭菌器(山东新华);净化工作台(蚌埠);Htysteritest601集菌仪(杭州高得);精密移液器。
1.2 材料
菌种:大肠埃希菌[CMCC(B)44 102];金黄色葡萄球菌[CMCC(B)26 003];枯草芽孢杆菌[CMCC(B)63 501];白色念珠菌[CMCC(F)98 001];铜绿假单胞菌[CMCC(B)10 104](以上菌种均从河南省食品药品检验所购买)。
营养琼脂培养基;营养肉汤培养基;改良马丁培养基;玫瑰红钠琼脂培养基;胆盐乳糖增菌培养基;溴化十六烷基三甲铵琼脂培养基;甘露醇高盐琼脂培养基;MUG试剂;pH7.0无菌氯化钠-蛋白胨缓冲液(以上培养基均由中国药品生物制品检定所监制);靛基质试液;氯化钠。
样品:沙丁胺醇气雾剂(批号分别为1104004,1107024,1106005)。
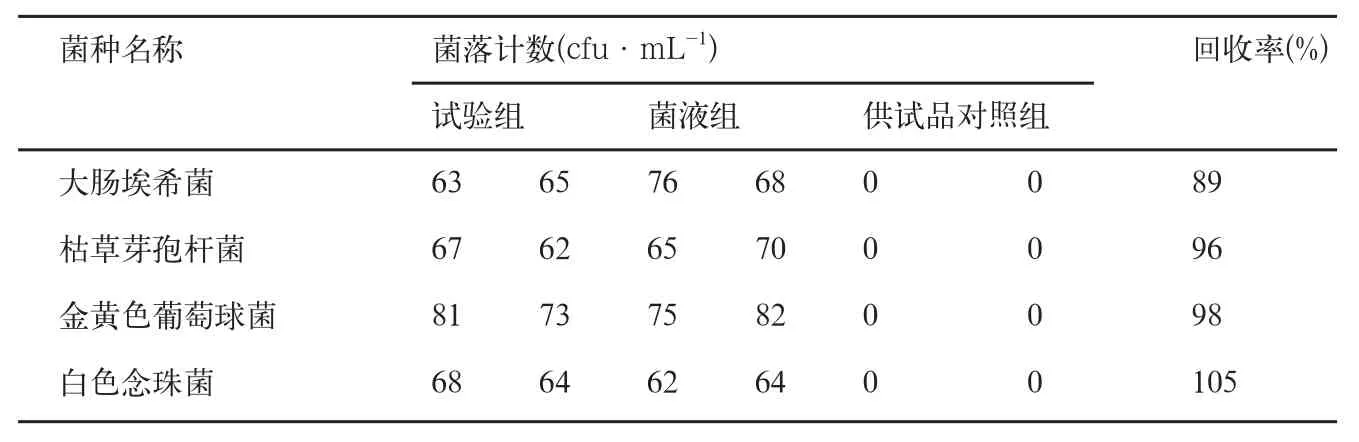
表1 回收率测定结果
2 细菌、霉菌及酵母菌计数
2.1 供试液对照组试验
取样品冷冻1h,消毒开启部位,无菌钢锥钻孔,放至室温,待抛射剂全部释出,用无菌注射器吸出药液,用pH7.0无菌氯化钠-蛋白胨缓冲液稀释成1:10供试液。
取供试液1mL注入100mLpH7.0无菌氯化钠-蛋白胨缓冲液,摇匀,以无菌操作用装有直径50mm、孔径为0.45um微孔滤膜的过滤器过滤,用0.9%无菌氯化钠溶液冲洗滤膜,每张滤膜冲洗量100mL,制4张滤膜,取出滤膜,菌面朝上,其中2张贴于凝固的营养琼脂培养基平板上,35℃倒置培养48h;另2张贴于凝固的玫瑰红钠琼脂培养基平板上,25℃倒置培养72h。培养后计数,为供试液对照组数据。
2.2 菌液组试验
接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中,35℃培养18~24h,取上述培养物用0.9%无菌氯化钠溶液制成每1mL含菌数为50~100cfu的菌悬液(大肠埃希菌、金黄色葡萄球菌液的稀释倍数一般为106~107,枯草芽孢杆菌的稀释倍数一般为104~105)。接种白色念珠菌的新鲜培养物至改良马丁培养基中,25℃培养24~48h。取上述培养物用0.9%无菌氯化钠溶液制成每1mL含菌数为50~100cfu的菌悬液(稀释倍数一般为104~105)。
分别取以上各菌悬液1 m L注入100mLpH7.0无菌氯化钠-蛋白胨缓冲液中,摇匀,以无菌操作,用装有直径50mm、孔径为0.45um微孔滤膜的过滤器过滤,过滤后,取出滤膜,菌面朝上,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的滤膜贴于凝固的营养琼脂培养基平板上,30~35℃倒置培养48h;白色念珠菌的滤膜贴于凝固的玫瑰红钠琼脂培养基平板上,23~28℃倒置培养72h。培养后计数为菌液组数据。
2.3 试验组试验
取1∶10供试液1mL注入100mLpH7.0无菌氯化钠-蛋白胨缓冲液,摇匀,以无菌操作用装有直径50mm、孔径为0.45um微孔滤膜的过滤器过滤,用0.9%无菌氯化钠溶液冲洗滤膜,每张滤膜冲洗量100mL,在最后一次冲洗液中加入1mL含菌数为50~100cfu的菌悬液,过滤后,取出滤膜,菌面朝上,加大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的滤膜贴于凝固的营养琼脂培养基平板上,30~35℃倒置培养48h;加白色念珠菌的滤膜贴于凝固的玫瑰红钠琼脂培养基平板上,23~28℃倒置培养72h。培养后计数为试验组数据。
2.4 回收率计算
用实验组数据减供试品对照组数据,然后除以菌液组数据,即为试验菌回收率。结果见表1。
以上结果表明:各菌液回收率均>70%,符合药典要求,说明薄膜过滤法可用于沙丁胺醇气雾剂的细菌、霉菌及酵母菌计数。
3 控制菌检查
3.1 方法
取2.1项1:10供试液10mL按2.3方法制备滤膜,在最后一次冲洗液中分别加大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌。加大肠埃希菌和铜绿假单胞菌的滤膜分别置100mL胆盐乳糖培养基中培养18~24h,加金黄色葡萄球菌的滤膜置100ml营养肉汤培养基中培养18~24h。
取大肠埃希菌培养液0.2mL置5mLMUG培养基管内培养,分别于5、24h时,366nm紫外光下观察。观察之后,加数滴靛基质试液于MUG管内,观察。
取铜绿假单胞菌的培养液划线接种于溴化十六烷基三甲铵琼脂培养基平板上,培养18~24h,观察。
取金黄色葡萄球菌的培养液划线接种于甘露醇高盐琼脂培养基平板,培养24~72h,观察。
3.2 结果
大肠埃希菌的MUG管内培养物呈现荧光,加靛基质试液后,液面呈玫瑰红色,为大肠埃希菌阳性。金黄色葡萄球菌和铜绿假单胞菌的平板也呈典型阳性菌落。说明此方法可以消除沙丁胺醇气雾剂中抑菌成分的干扰,检出试验菌,符合药典规定,可以用于沙丁胺醇气雾剂的控制菌检查。
以上试验证明,薄膜过滤法可用于沙丁胺醇气雾剂的微生物限度检查,其结果准确、可靠。
4 讨论
(1)微生物限度检查是检查生产企业是否按GMP规范生产的一种手段,是药品标准的一个重要项目,可由于药品成分复杂,尤其是抗生素、抗菌药和某些中成药,它们有特殊的抑菌作用,因此,以前的常规法检查微生物限度就不能反映药品的真实情况,出现假阴性,漏检现象,导致这些药品到人体内,温度营养均适宜的环境下重新复苏、繁殖生长,危害人的健康。因此,研究制定出科学、准确、可靠、规范的微生物限度检查方法势在必行[5~7]。
(2)沙丁胺醇气雾剂是呼吸道用药,必须检查金黄色葡萄球、铜绿假单胞菌、大肠埃希菌等控制菌,因此需要做这3个控制菌的方法学验证。
(3)本文的所有试验均需作空白试验或空白对照试验。
(4)滤膜应菌面朝上放在培养基平板上,这样膜上的细菌才可以更好的在氧和养的环境下生长。
[1] 中华人民共和国国家药典委员会.中国药典(二部)[S].北京:中国医药科技出版社,2010:附录107~116.
[2] 钟长鸣,陈曦,吴燕红.微生物限度和无菌检查方法验证中存在的问题[J].中国药品标准,2011(1):12~13.
[3] 陈万里,李勇军,王永林,等.紫金透骨喷雾剂微生物限度检查方法学验证研究[J].中国药房,2010,19(43):4090~4092.
[4] 赵瑛,史琛,黄璞.碘酊微生物限度检查方法的验证[J].中国药师,2011(9):1382~1383.
[5] 李佳宁,骆勇,吴娟.执行微生物限度检查工作中存在的问题及建议[J].中国药业,2008(8):8.
[6] 马鸣晓.地级市药检所开展无菌和微生物限度检查方法学验证工作之我见[J].中国药师,2008(9):1105~1106.
[7] 陶红.中药制剂微生物限度检查方法研究进展[J].中国药房,2010,19(19):1813~1815.