胸腺基质淋巴细胞生成素对小鼠巨噬细胞抗原提呈功能及炎性分泌功能的影响①
林 静 王 磊 苏又苏 方红成 李大主
(华中科技大学同济医学院协和医院心内科,武汉430022)
动脉粥样硬化(Atherosclerosis,AS)是一种慢性炎症性疾病,血管内皮细胞、巨噬细胞、T细胞和树突状细胞等免疫炎性细胞均参与了AS的发生和发展[1]。研究表明,巨噬细胞激活,高表达 HLADR、CD86等抗原提呈分子,分泌单核细胞趋化因子-1(Monocyte chemotactic protein,MCP-1)、肿瘤坏死因子-α (Tumor necrosis factor-α,TNF-α)等多种炎症因子,诱导、趋化和活化其他血管炎性细胞,在放大AS炎症反应中起重要作用[2]。胸腺基质淋巴细胞生成素(Thymic stromal lymphopoietin,TSLP)是近年来发现的一种主要表达于上皮细胞的细胞因子,其主要生物学作用是激活树突状细胞,从而促进T细胞分化,在哮喘、支气管炎和皮肤过敏等疾病的炎症反应中发挥重要作用[3,4]。近年来研究证实氧化型低密度脂蛋白(Oxidized low density lipoprotein,ox-LDL)、血管紧张素Ⅱ(AngⅡ)等参与AS炎症反应的重要刺激因子均可诱导血管炎性细胞产生TSLP[5,6],但是 TSLP 对于血管炎性细胞的作用和机制目前尚不清楚。本研究通过观察TSLP对小鼠巨噬抗原提呈能力、炎症因子分泌功能的影响,进一步探讨其在动脉粥样硬化炎症反应中的作用和机制。
1 材料与方法
1.1实验动物 C57B背景TSLPR基因敲除(TSLPR-/-)小鼠由美国圣朱迪儿童医院生物化学实验室(St.Jude Children's Research Hospital)James N.Ihle博士同意并授权,由瑞士国家疫苗研究所(Swiss Vaccine Research Institute)动物中心Nicola L.Harris博士馈赠;野生型C57B小鼠作为正常对照组,购自中国科学院上海实验动物中心。所有实验动物的操作及饲养均符合湖北省及同济医学院实验动物管理饲养条例,遵循人道原则。实验小鼠均饲养在清洁级环境中,统一喂养。
1.2主要试剂 小鼠重组TSLP购自RD公司;Trizol RNA提取试剂购自Invitrogen公司;Taq DNA聚合酶;dNTP等PCR试剂购自TaKaRa公司;PCR引物由大连宝生物公司合成;RPMI1640购自美国Hyclone公司;胎牛血清购自Gibco BRL公司;酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自eBioscience公司;PE标记的抗小鼠CD86单克隆抗体和FITC标记的抗小鼠MHCⅡ单克隆抗体购于eBioscience公司;流式细胞仪为BD公司产品。
1.3方法
1.3.1小鼠巨噬细胞的分离 各组小鼠均取5只,分离小鼠腹腔巨噬细胞。具体操作方法如下:断颈处死小鼠,75%乙醇浸泡10分钟,剖腹收集腹腔内液,800 r/min离心5分钟后收集细胞,用含10%胎牛血清的RPMI1640培养液调整细胞浓度至1×106细胞/ml,加入培养板中,置37℃、5%CO2孵育箱培养4小时后去上清液,PBS洗去未贴壁细胞。

表1 RCR引物Tab.1 PCR primers
1.3.2分组及细胞共培养 实验分为4组:(1)野生型对照组:C57B野生型小鼠巨噬细胞+PBS;(2)野生型实验组:C57B野生型小鼠巨噬细胞+TSLP(50 ng/ml);(3)TSLPR-/-对照组:TSLPR-基因敲除小鼠巨噬细胞+PBS;(4)TSLPR-/-实验组:TSLPR基因敲除小鼠巨噬细胞+TSLP(50 ng/ml)。上述各组细胞与TSLP或PBS共培养24小时后收获,行后续检测。
1.3.3流式细胞术检测小鼠巨噬细胞抗原提呈分子MHCⅡ和CD86的表达 收集上述处理过的各组巨噬细胞,离心弃上清,用PBS洗液(包括0.1%叠氮钠和2%BSA)洗2遍,调细胞密度至0.5×106个。取100 μl细胞悬液加入20 μl FITC-conjugated anti-CD86单克隆抗体和PE-conjugated anti-MHCⅡ单克隆抗体,PE-和FITC-conjugated的同型IgG1作对照,4℃,暗室孵育30分钟。然后,细胞用PBS洗液洗一遍,再重悬于PBS洗液,并立即用流式细胞仪检测。其结果以阳性百分率表示。
1.3.4实时定量PCR检测小鼠腹腔巨噬细胞MCP-1、IL-10、TNF-αmRNA表达 按 RT-PCR 试剂盒提供方法进行,反转录后PCR,所用引物见表1。PCR反应条件为:94℃预变性5分钟后,94℃变性1分钟,56℃退火1分钟,72℃延伸1分钟,循环35次再72℃延伸7分钟。反应结束后分析荧光值变化曲线和溶解曲线。每个反应重复 3次,采用2-△△Ct算法分析结果。
1.3.5ELISA检测上清液 MCP-1、IL-10和 TNF-α浓度 将分离的各组小鼠巨噬细胞与PBS或TSLP共培养24小时后,收集培养上清,按照小鼠MCP-1、IL-10或TNF-α试剂盒的操作步骤检测培养上清中MCP-1、IL-10和TNF-α浓度。实验设双复孔,重复3次。
1.4统计学分析 以上各组实验至少独立重复3次,实验数据以±s表示,采用SPSS12.0作统计学处理。组间数据处理根据方差齐性分析的结果,进一步使用S-N-K检验,进行组间差异的比较,P<0.05为差异有显著性。
2 结果
2.1TSLP对小鼠巨噬细胞抗原提呈分子MHCⅡ和CD86影响 流式细胞术表明:与野生型对照组小鼠巨噬细胞表面MHCⅡ(4.62±1.46)%及CD86(11.60±3.67)%相比较,野生型实验组小鼠巨噬细胞表面MHCⅡ(15.75±3.52)%(P<0.01)及CD86(37.75±8.17)%(P<0.001)的表达均明显增加;与TSLPR-/-对照组小鼠巨噬细胞表面MHCⅡ(3.55±2.05)%及CD86(16.03±3.09)%相比较,TSLPR-/-实验组小鼠巨噬细胞表面MHCⅡ(5.70±2.70)%及CD86(13.20±3.70)%的表达无明显变化(P>0.05);与野生型实验组小鼠巨噬细胞表面 MHCⅡ(15.75±3.52)%及 CD86(37.75±8.17)%相比较,TSLPR-/-基因敲除能够明显抑制TSLP诱导的小鼠巨噬细胞抗原提呈分子MHCⅡ(5.70±2.70)%(P<0.01)及CD86(13.20±3.70)%(P<0.001)的表达(见图1及表2)。
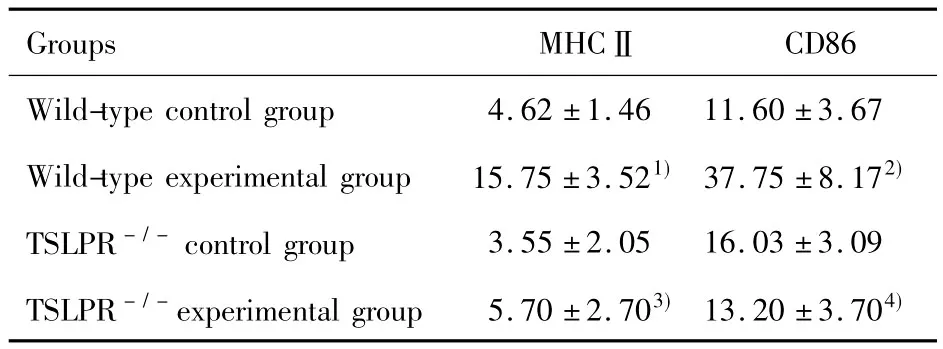
表2 TSLP对小鼠巨噬细胞抗原提呈分子MHCⅡ及CD86影响(x ± s,%)Tab.2 Effect of TSLP on MHCⅡ and CD86 expression in mice macrophages(x ± s,%)
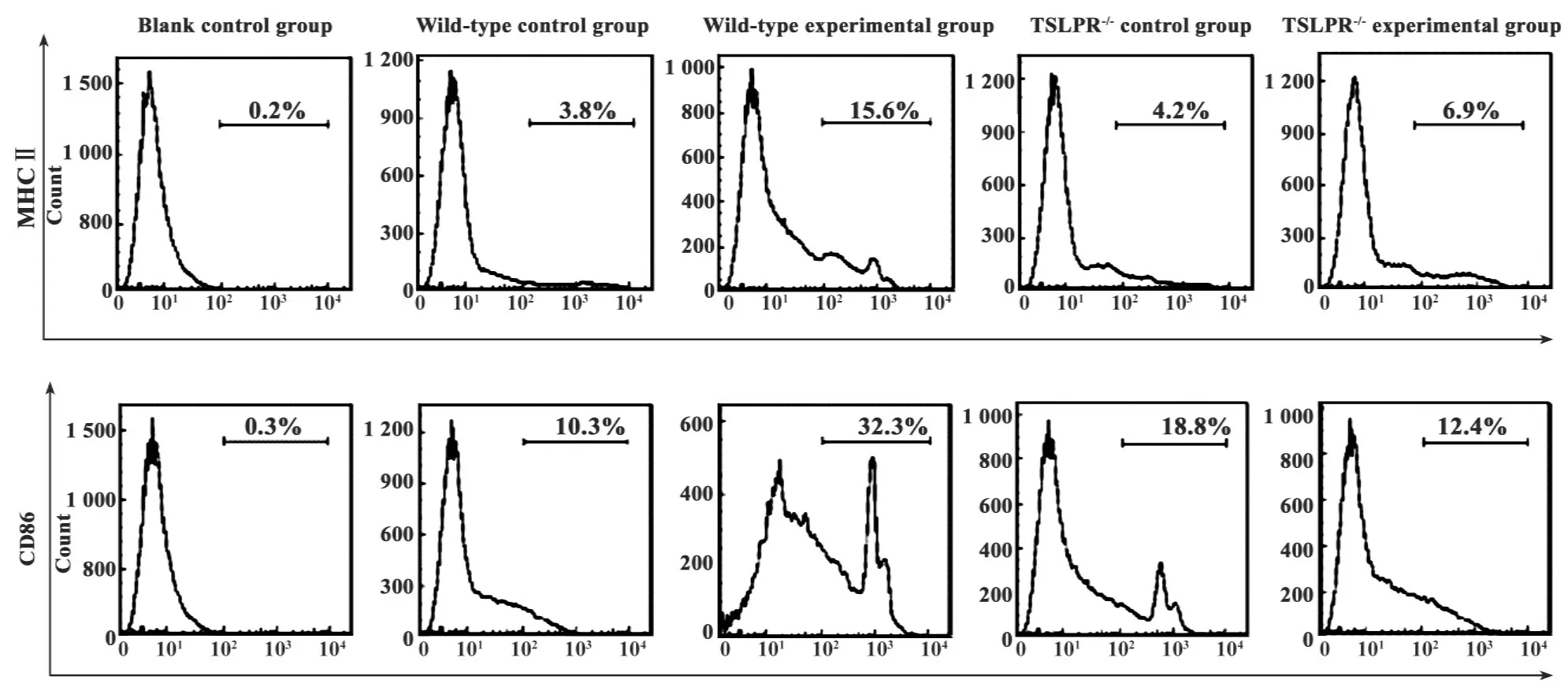
图1 TSLP对小鼠巨噬细胞抗原提呈分子MHCⅡ及CD86影响Fig.1 Effect of TSLP on MHCⅡ and CD86 expression in mice macrophages
2.2TSLP对小鼠巨噬细胞 MCP-1、TNF-α和 IL-10mRNA水平的影响 与野生型对照组小鼠腹腔巨噬细胞 MCP-1mRNA(1.00±0.00)和 TNF-αmRNA(1.00±0.00)相比较,野生型实验组小鼠腹腔巨噬细胞MCP-1mRNA(2.17±0.62)(P<0.001)和TNF-αmRNA(3.22±0.30)(P<0.001)水平明显上调;与TSLPR-/-对照组MCP-1mRNA(1.68±0.54)和TNF-αmRNA(0.91±0.16)相比较,TSLPR-/-实验组小鼠巨噬细胞 MCP-1mRNA(1.27±0.28)和 TNF-αmRNA(1.31±0.18)水平无明显变化(P>0.05);与野生型实验组小鼠巨噬细胞MCP-1mRNA(2.17±0.62)和 TNF-αmRNA(3.22±0.30)相比较,TSLPR-/-基因敲除能够明显抑制TSLP诱导的小鼠巨噬细胞MCP-1mRNA(1.27±0.28)(P<0.001)和TNF-α mRNA(1.31±0.18)(P<0.001)表达。野生型对照组小鼠腹腔巨噬细胞IL-10mRNA(1.00±0.00);野生型实验组小鼠腹腔巨噬细胞IL-10mRNA(1.35±0.18);TSLPR-/-对照组小鼠腹腔巨噬细胞 IL-10mRNA(1.18±0.26);TSLPR-/-实验组小鼠腹腔巨噬细胞 IL-10mRNA(0.95±0.16)。四组间 IL-10mRNA水平无明显变化(P>0.05,见图2)。
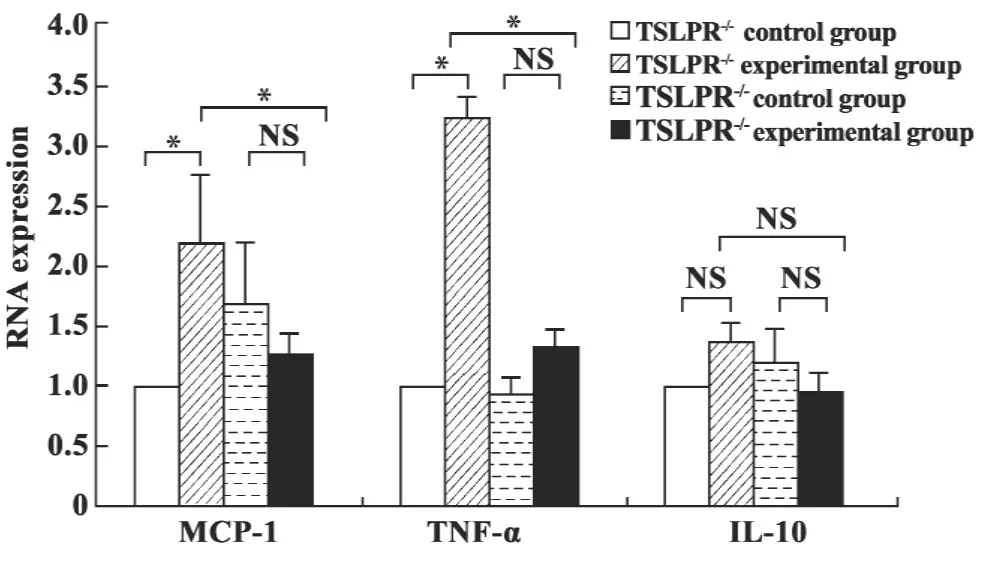
图2 TSLP对小鼠巨噬细胞 MCP-1、TNF-α和 IL-10mRNA水平的影响(±s)Fig.2 Effect of TSLP on MCP-1,TNF-α and IL-10mRNA expression in mice macrophages(±s)
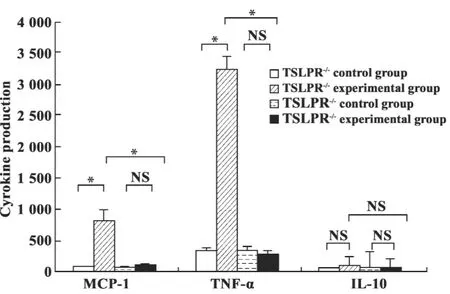
图3 TSLP对小鼠巨噬细胞分泌MCP-1、TNF-α和IL-10的影响 (±s)Fig.3 Effect of TSLP on MCP-1,TNF-α and IL-10 production in mice macrophages(±s)
2.3TSLP对小鼠巨噬细胞分泌MCP-1、TNF-α和IL-10的影响 与野生型对照组MCP-1(67.89±9.67)pg/ml和 TNF-α(340.99 ±30.39)pg/ml相比较,野生型小鼠巨噬细胞培养上清MCP-1(825.50±42.44)pg/ml(P<0.001)和 TNF-α(3240.39±202.13)pg/ml(P<0.001)水平明显增加;与TSLPR-/-对照组MCP-1(99.22±15.42)pg/ml和TNF-α(318±29.32)pg/ml相比较,TSLPR-/-实验组小鼠巨噬细胞上清 MCP-1(105.89±7.66)pg/ml和TNF-α(285.39±34.45)pg/ml水平无明显变化(P>0.05);与野生型实验组小鼠巨噬细胞培养上清MCP-1(825.50±42.44)pg/ml和TNF-α(3 240.39±202.13)pg/ml相比较,TSLPR-/-基因敲除能够明显抑制TSLP诱导的小鼠巨噬细胞MCP-1(105.89±7.66)pg/ml(P<0.001)和 TNF-α(285.39±34.45)pg/ml(P<0.001)分泌。野生型对照组上清IL-10水平(42.88±8.02)pg/ml;野生对照组巨噬细胞培养上清IL-10(107.72±10.150)pg/ml;TSLPR-/-对照组小鼠巨噬细胞上清IL-10(88.61±6.81)pg/ml;TSLPR-/-实验组小鼠巨噬细胞上清IL-10(80.28±5.67)pg/ml。四组间上清IL-10分泌水平无明显变化(P>0.05,见图3)。
3 讨论
TSLP是近年来发现的一个类IL-7细胞因子,其是树突状细胞(Dendritic cell,DC)的最特异和最强效的活化因子。TSLP主要表达于上皮细胞、皮肤角质细胞和支气管平滑肌细胞,正常血管细胞并不表达TSLP。吸烟、机械损伤、致敏原以及微生物可诱导上皮细胞,皮肤角质细胞和支气管平滑肌细胞等高度表达TSLP,在受损组织局部活化DC,促进初始T细胞向效应T细胞转变,从而启动哮喘、支气管炎和皮肤过敏等疾病的炎症反应[3,4,7,8],被誉为炎症反应的“总开关”。
近期研究表明,TSLP可能参与了动脉粥样硬化炎症反应的发生发展。急性动脉综合征患者循环血中TSLP水平升高[9];体外研究我们发现:正常未经刺激的血管内皮细胞几乎不表达TSLP,但经ox-LDL刺激后,血管内皮细胞可大量表达 TSLP[5]。参与AS炎症反应的重要促炎因子AngⅡ可通过激活NF-κB途径刺激血管平滑肌细胞表达TSLP[6]。以上研究提示TSLP可能参与了AS炎症反应,但是其在AS炎症反应中的具体作用和机制目前尚不清楚。
参与AS炎症反应的巨噬细胞可分化成经典活化型(Classically activated,M1型)和替代活化型(Alternatively activated,M2型)两类。既往研究表明,IL-4及IL-13等可诱导产生M2型巨噬细胞,表现为较低的抗原提呈能力(MHCⅡ表达降低),并通过分泌抑制性细胞因子IL-10和TGF-β等下调AS炎症反应[10];细菌或其产物脂多糖(LPS)的诱导产生M1型巨噬细胞,表现为具有较强的抗原提呈能力(MHCⅡ表达增高)产生一氧化氮(NO)及活性氧中间产物(Reactive oxygen intermediates,ROS)并通过分泌IL-12和IL-23诱导其它炎症因子如TNF-α,MCP-1产生促进和放大 AS炎症反应[11,12]。本研究发现,给予TSLP刺激可以促进巨噬细胞活化,增强其表面抗原提呈分子表达,促使小鼠巨噬细胞分泌炎症因子TNF-α和MCP-1,而对抑炎因子IL-10无明显影响。以上研究表明TSLP刺激可使巨噬细胞向促炎表型的M1巨噬细胞分化,此作用可能是TSLP参与AS炎症反应的机制之一。本研究还发现胸腺基质淋巴细胞生成素受体(Thymic stromal lymphopoietin receptor,TSLPR)基因敲除可抑制TSLP对小鼠巨噬细胞抗原提呈分子及炎性因子分泌功能的影响,提示TSLP是通过与巨噬细胞表面受体TSLPR结合介导了小鼠巨噬细胞向促炎表型M1型分化功能。
综上所述,TSLP可通过与TSLPR结合促进小鼠巨噬细胞活化,增强小鼠巨噬细胞表面抗原提呈分子表达,分泌促炎因子,促使小鼠巨噬细胞向促炎表型M1型转化,此作用可能为TSLP参与AS炎症反应作用机制之一,上述发现不仅有助于阐明TSLP在炎症反应中的作用机制,还有助于为进一步研究TSLP在AS炎症反应中的作用和机制提供基础实验依据。
1 Hansson G K.Inflammation,atherosclerosis,and coronary artery disease[J].N Engl J Med,2005;352:1685-1695.
2 Moore K J,Tabas I.Macrophages in the pathogenesis of atherosclerosis[J].Cell,2011;145:341-355.
3 Wang J,Xing F.Human TSLP-educated DCs[J].Cell Mol Immunol,2008;5(2):99-106.
4 He R,Geha R S.Thymic stromal lymphopoietin[J].Ann N Y Acad Sci,2010;1183:13-24.
5 何少林,昌 薇,赵 卉et al.氧化低密度脂蛋白诱导血管内皮细胞表达胸腺基质淋巴细胞生成素[J].临床心血管病杂志,2010;26(1):62-64.
6 赵 卉,何少林,林 静et al.血管紧张素Ⅱ刺激血管平滑肌细胞表达TSLP及信号通路研究[J].中国免疫学杂志,2012;28(1):75-84.
7 Lei L,Zhang Y,Yao W et al.Thymic stromal lymphopoietin interferes with airway tolerance by suppressing the generation of antigenspecific regulatory T cells [J].J Immunol,2011;186(4):2254-2261.
8 Headley M B,Zhou B,Shih W X et al.TSLP conditions the lung immune environment for the generation of pathogenic innate and antigenspecific adaptive immune responses[J].J Immunol,2009;182(3):1641-1647.
9 刘秀红,杜亚军,高小平et al.急性冠状动脉综合征患者血浆胸腺基质淋巴细胞生成素的变化[J].临床心血管病杂志,2010;26(12):912-914.
10 Libby P,Nahrendorf M,Pittet M J.Diversity of denizens of the atherosclerotic plaque:not all monacytes are created equal[J].Circulation,2008;117(25):3168-3170.
11 Gordon S.Macrophage heterogeneity and tissue lipids[J].J Clin Invest,2007;117(1):89-93.
12 Taylor P R,Gordon S.Monocyte heterogeneity and innate immunity[J].Immunity,2003;19(1):24-28.

