阳和汤体外对大鼠成骨细胞及破骨细胞增殖的影响*
黄立中 王云丹 田 莎 伍参荣 彭吉勇 毛 丹 吕 宇
(1.湖南中医药大学,湖南 长沙 410007;2.湖南省长沙市中医院,湖南 长沙 410100)
骨转移癌最常见的表现为进行性骨痛、病理性骨折。为探讨阳和汤抗骨转移癌的作用机制,笔者通过体外分离培养的成骨细胞及体外诱导的破骨细胞体系,研究含药血清对大鼠成骨细胞及破骨细胞的影响。现将结果报告如下。
1 材料与方法
1.1 动物 2 d龄SD大鼠 (分离成骨细胞用),3月龄的SD大鼠 20只(制备载药血清用),体质量(200±50)g,由湖南中医药大学动物实验中心提供。
1.2 药物 阳和汤由鹿角胶、肉桂、白芥子、熟地黄、麻黄、姜炭、生甘草组成,经水煎醇沉后浓缩而得实验用药,生药含量为1.5 g/mL。药材购置于湖南中医药大学第一附属医院。
1.3 试药与仪器 胎牛血清,DMEM培养液,磷酸盐缓冲液(PBS),5 mg/mL 四甲基偶氮唑盐 MTT (Sigma), 二甲基亚砜(DMSO 分析纯),DMEM 培养液(GBICO),区拉同 X-100(上海瑞金生物公司),对硝基苯酚(上海瑞金生物公司),M-CSF(Sigma公司),RANK-L(Sigma公司)。低速离心机(长沙平凡仪器仪表公司),水浴箱(上海精宏实验设备公司),超净工作台(苏州安泰空气技术公司),CO2培养箱(2300 型,USA),倒置显微镜(南京江南光电公司),酶联免疫检测仪(Austria)。
1.4 阳和汤含药血清制备 20只SD大鼠随机分为4组,即空白对照组(给予蒸馏水灌胃),阳和汤高剂量组 12 g/(kg·d)、中剂量组 4 g/(kg·d)低剂量组 1.3 g/(kg·d),每组 5 只。 各组连续7 d灌胃给药,末次给药2 h后,予巴比妥钠麻醉大鼠,行腹主动脉采血,分离血清,56℃灭活30 min,用0.22 μm过滤除菌,分装标记后置4℃冰箱备用。
1.5 大鼠成骨细胞分离和培养[1]取2 d龄SD乳大鼠,在无菌条件下,分离颅顶盖骨,剔除骨膜及其他组织,用D-Hank’s液冲洗3次,用眼科剪将骨片剪成1 mm×1 mm的碎块,加入0.25%的胰蛋白酶,于37℃消化30 min,弃上清液,D-Hank’s冲洗3次,加入含0.05%胰蛋白酶及2 mg/mL的Ⅰ型胶原酶的消化液,37℃消化2 h,吸取消化液,经140目尼龙网过滤,再用DMEM培养液冲洗消化的骨残集,收集冲洗液,过滤后与消化液混合,以1500 r/min离心15 min,收集细胞,即为新鲜的成骨细胞,加入含10%小牛血清的DMEM培养基,调整密度为1×105细胞/mL,接种于100 mL的培养瓶中,置37℃,5%CO2的孵箱中培养。24 h后换液。以后视细胞生长情况2~3 d换液1次。
1.6 大鼠破骨细胞分离和培养[2]取2 d龄SD乳大鼠5只,无菌取四肢长骨,放入含青、链霉素的冷D-Hank’S平衡盐溶液中,小心剥离肌肉组织,将软组织去除干净,洗2~3次,并将干骺段剪去,然后将骨置于5 mL含10%小牛血清的DMEM培养基,先横向剪成4~5 mm长的骨段,再纵向剪开暴露骨干内侧,用吸管反复吹打5~10 min,使贴附在骨基质上的破骨细胞脱落下来,收集含骨髓细胞的培养液,于35 mm培养皿中静置10 min,收集未贴壁的细胞悬液过200目细胞筛,以1000r/min离心10min,弃去上清液,所得白色沉淀物即为制得的破骨细胞样细胞团。用含10%小牛血清的DMEM培养液重悬细胞,吹打均匀,将细胞悬液通过200目细胞筛,去除可能存在的非破骨细胞和杂质成分。然后将滤过后的细悬液调成1×106/mL浓度,吹打均匀后,接种到培养瓶中,置于37℃,含5%CO2饱和湿度的培养箱内进行培养。12 h后换液,以去除红细胞和未贴壁细胞,每2日换液1次,生物倒置显微镜观察细胞形态并照相。
1.7 MTT测定[3]药物对细胞增殖的影响:原代成骨细胞(细胞传至第3代用于实验)、成骨细胞株UMR106和破骨前体细胞RAW264.7分别接种于96孔培养板,每孔加入100 μL细胞悬液(1×105个/mL),每个培养板分为 5 组,每组设 6 复孔,置 37℃、5%CO2孵箱培养24 h,使细胞贴壁后,用D-Hank’s洗涤3次,进行随机分为空白血清组:加不含药大鼠血清50 μL+20%DMEM 100 μL;阳和汤含药血清高剂量组:加阳和汤高剂量血清50 μL+20%DMEM 100 μL;阳和汤含药血清中剂量组:加阳和汤中剂量血清50 μL+20%DMEM100 μL;阳和汤含药血清低剂量组:加阳和汤低剂量血清50 μL+20%DMEM100 μL;阴性细胞对照组:为不加药,不加大鼠血清的常规培养阴性对照组。继续培养24、48、72 h后,凋零孔加PBS液,并于结束培养前4 h每孔加入5 mg/mL的MTT 20 μL,继续培养4 h后小心吸弃培养液,再在每孔加入150 μL DMSO,充分震荡5 min,使结晶物充分溶解,于酶联免疫检测仪上490 nm波长处测各孔吸光度值,计算细胞增殖率。细胞增殖率(%)=实验组 A490/正常对照组 A490×100%。
1.8 破骨前体细胞形态观察及抗酒石酸酸性磷酸酶(TRAP)活性测定[4]RAW264.7接种于96孔板,每孔加入100 μL细胞悬液(1×105个/mL)。 各孔 RAW264.7细胞加诱导体系(M-CSF 和RANK-L)的同时分别加入不同浓度的阳和汤含药血清和空白血清各10 μL,37℃ 5%CO2培养,细胞每3日换液1次,同时设不加血清药只加诱导体系的空白对照。第4日开始对只加诱导体系的空白对照细胞进行TRAP染色,生物光镜观察破骨细胞形态。另一部分培养细胞在培养第4日,第5日,第6日,分别测定TRAP酶活测定。其操作过程为:首先PBS冲洗细胞2次,加入20 μL,0.1%的区拉通5 min以裂解细胞,取上清,随后加入反应液50 μL(称取对硝基苯酚磷酸二钠0.4 g,加入酒石酸甲钠2.0 g,用 1 mol/L 的 HCl调 pH3.5,至终体积为 200 mL),37℃反应30 min,迅速加入1 mol/L的NaOH 100 μL终止反应。于530 nm处测其吸光度。标准曲线为不同浓度的对硝基苯酚溶液在530nm处的吸收值与浓度所作的标准曲线,以每孔生成的对硝基苯酚的摩尔数表示TRAP活性。
1.9 统计学处理 应用SPSS16.0统计软件。各组数据以(±s)表示,组间比较采用方差分析,两两比较采用SNK法。P<0.05为差异有统计学意义。
2 结 果
2.1 阳和汤含药血清对原代成骨细胞及UMR106细胞增殖的影响 见表1~表2。除了低剂量、24 h时间点外,各浓度各时间点吸光度均有显著上升;对UMR106细胞株增殖影响情况与原代细胞类似。各含药血清组与空白对照组同时间内比较、或同组不同时间内比较差异均有统计学意义(P<0.05),含药血清对原代成骨细胞和成骨样细胞株UMR106的增殖具有显著促进作用。
表1 各组原代成骨细胞增殖率比较(n=6,±s)
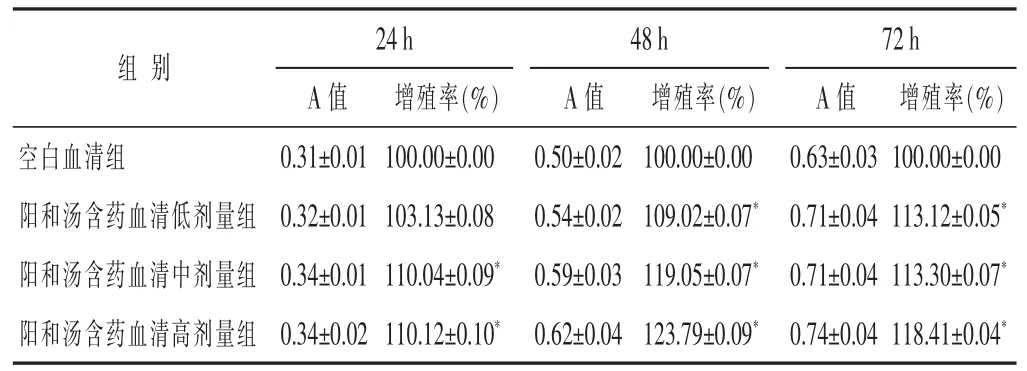
表1 各组原代成骨细胞增殖率比较(n=6,±s)
与空白血清组比较,*P<0.05。下同。
24h 48h 72h A值 增殖率(%) A值 增殖率(%) A值 增殖率(%)空白血清组 0.31±0.01 100.00±0.00 0.50±0.02 100.00±0.00 0.63±0.03 100.00±0.00阳和汤含药血清低剂量组 0.32±0.01 103.13±0.08 0.54±0.02 109.02±0.07* 0.71±0.04 113.12±0.05*阳和汤含药血清中剂量组 0.34±0.01 110.04±0.09* 0.59±0.03 119.05±0.07* 0.71±0.04 113.30±0.07*阳和汤含药血清高剂量组 0.34±0.02 110.12±0.10* 0.62±0.04 123.79±0.09* 0.74±0.04 118.41±0.04*组别
2.2 阳和汤含药血清对原代破骨细胞分化能力的影响 破骨前体细胞形态破骨细胞增殖和分化能力是影响其骨吸收的重要方面,在生物倒置显微镜显微镜镜下:原代破骨细胞培养第4日出现伪足,核大圆;第5日细胞多角形,核1个;培养第6日破骨细胞形态呈花瓣状,可见2~3核(见图1)。
表2 各组UMR106成骨细胞增殖率比较(n=6,±s)

表2 各组UMR106成骨细胞增殖率比较(n=6,±s)
24h 48h 72h A值 增殖率(%) A值 增殖率(%) A值 增殖率(%)空白血清组 0.32±0.01 100.00±0.00 0.49±0.03 100.00±0.00 0.66±0.02 100.00±0.00阳和汤含药血清低剂量组 0.33±0.01 103.11±0.05 0.55±0.01 112.42±0.05* 0.72±0.02 109.21±0.06*阳和汤含药血清中剂量组 0.35±0.01 109.47±0.05* 0.57±0.02 117.16±0.07* 0.76±0.01 115.37±0.05*阳和汤含药血清高剂量组 0.37±0.02 116.62±0.08* 0.62±0.02 126.49±0.08* 0.81±0.04 122.70±0.08*组别

图1 原代破骨细胞生长形态观察(40×10)
利用TRAP染色观察药物对破骨前体细胞增殖和分化能力的影响,结果可见空白血清组细胞增殖、分裂活跃;阳和汤含药血清高剂量组破骨核分化能力降低,细胞出现凋亡;阳和汤含药血清中剂量组破骨核分化能力降低,出现细胞肿胀;阳和汤含药血清低剂量组破骨胞形成弱低于空白血清组,如图2。
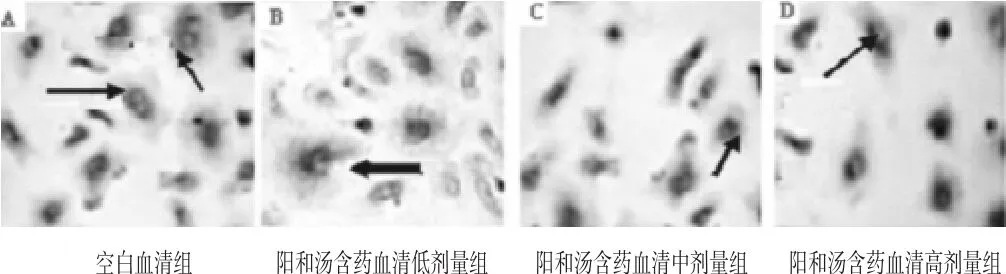
图2 (40×10)
2.3 阳和汤含药血清对破骨前体细胞RAW264.7细胞增殖的影响 见表3。阳和汤含药血清低剂量组破骨前体细胞RAW264.7增殖率与空白组比较24、48、72 h差异均无统计学意义 (P>0.05);阳和汤含药血清中、高剂量组破骨前体细胞RAW264.7增殖率均低于空白血清组,24、48、72 h比较差异有统计学意义 (P<0.05),提示阳和汤抑制破骨细胞的增殖有剂量-效应。
表3 各组RAW264.7细胞增殖率比较(n=6,±s)

表3 各组RAW264.7细胞增殖率比较(n=6,±s)
24h 48h 72h A值 增殖率(%) A值 增殖率(%) A值 增殖率(%)空白血清组 0.31±0.01 100.00±0.00 0.49±0.03 100.00±0.00 0.66±0.02 100.00±0.00阳和汤含药血清低剂量组 0.31±0.01 100.11±0.05 0.48±0.04 97.59±0.12 0.65±0.01 97.24±0.03阳和汤含药血清中剂量组 0.30±0.01 96.77±0.05* 0.47±0.03 95.91±0.09* 0.64±0.03 95.97±0.08*阳和汤含药血清高剂量组 0.30±0.01 95.72±0.05* 0.46±0.02 92.39±0.07* 0.64±0.01 95.90±0.05*组别
2.4 阳和汤含药血清对破骨前体细胞TRAP活性的影响 见表4。由表4知,与空白血清组相比,阳和汤含药血清各剂量组24 h TRAP活性差异无统计学意义(P>0.05);阳和汤含药血清低剂量组对破骨细胞的TRAP活性24、48 h影响不大,与空白组比较无显著差异(P>0.05),但72 h TRAP活性低于空白血清组(P<0.05);阳和汤含药血清中剂量组、高剂量组48、72 h破骨细胞TRAP活性均明显低于空白血清组,差异具有统计学意义(P<0.05)。
表4 各组破骨细胞 TRAP活性比较(n=6,μ/L,±s)

表4 各组破骨细胞 TRAP活性比较(n=6,μ/L,±s)
组 别 24 h 48 h 72 h空白血清组 27.21±1.26 38.01±2.24 40.47±2.80阳和汤含药血清低剂量组 27.20±1.41 37.90±1.58 38.80±2.85*阳和汤含药血清中剂量组 26.71±1.92 35.81±1.87* 36.61±1.64*阳和汤含药血清高剂量组 26.83±1.73 34.99±1.75* 35.46±2.42*
3 讨 论
正常骨代谢过程是一种骨吸收和骨形成的动态平衡过程,这一过程受到体内外许多因素的调控,任何不良因素均会导致骨代谢受阻。正常的骨代谢是通过成骨细胞的成骨作用与破骨细胞的骨吸收作用进行调节,在这个过程中,大量的相关因子参与其中,成为骨微环境主要部分。研究表明,大部分乳腺癌患者的骨转移为溶骨性转移,约15%~20%的患者同时有成骨性特征[5]。溶骨性转移中,骨的破坏主要是由破骨细胞引起的,肿瘤细胞的主要作用是分泌一系列因子来启动和生成破骨细胞而溶骨。在体内骨微环境系统中,如果成骨细胞数目的增长到达一定比例,使机体产生相应细胞因子,从而对破骨细胞的形成分化产生抑制作用。因此,促进机体内骨形成和骨吸收之间出现正平衡,成为抗骨质破坏的重要治疗机制[6]。
阳和汤源于王洪绪《外科证治全生集》,原方用于治疗阴疽。中医学认为,骨转移癌局部肿块坚硬不移、疼痛、入夜尤甚、皮色不变等临床特征,与“寒主收引、主凝滞、主痛”等中医理论相符,属阴寒证。黄立中教授在临床用阳和汤加味治疗骨转移癌取得了明显的疗效[7],王氏[8]用阳和汤加味合云克治疗骨转移癌 30例。施氏[9]用阳和汤合帕米磷酸二钠(博林针)治疗恶性肿瘤31例也取得一定疗效。本实验采用中药血清药理学方法,探讨了阳和汤对成骨细胞增殖的影响作用;对破骨前体细胞增殖、分化以及TRAP活性的影响。研究结果表明:阳和汤含药血清不仅可以明显促进成骨细胞的增殖,同时,可抑制破骨前体细胞增殖,降低破骨前体细胞TRAP活性,提示阳和汤含药血清抑制破骨前体细胞增殖,降低破骨前体细胞TRAP活性,对成骨细胞的增殖具有显著促进作用。这可能是阳和汤抗骨转移癌的重要作用机制,为阳和汤抗骨转移癌的临床应用提供了理论依据。
[1]刘祖德,臧鸿声,欧阳跃平.新生大颅盖骨体外生长过程的研究[J].解剖学报,1995,26(2):157-159.
[2]陈长华,方泰惠,周玲玲.清络通痹颗粒含药血清对体外培养的成骨细胞和破骨细胞的影响[J].中成药,2008,30(1):35-38.
[3]边兴艳.MTT比色法及其应用[J].国外医学:临床生物化学与检验学分册,1998,19(2):83-85.
[4]Yan GM,Lin SZ,Irwin RP,et al.Activation of muscarinic cholinergic receptors blocks apoptosis of cultured cerebellar granule neurons[J].Molecular Pharmacology,1995,47:248-257.
[5]Coleman RE,Seaman JJ.The role of zoledronic acid in cancer:clinical studies in the treatment and prevention of bone metastases[J].Semin Oncol,2001,28(Supll):11-16.
[6]匡梨,谢正强.唑来磷酸治疗骨转移癌的机制研究[J].中国肿瘤临床,2009,36(6):678-679.
[7]黄立中,蒋益兰,曾松林,等.阳和汤加味治疗骨转移癌疼痛63例[J].湖南中医学院学报,1997,11(1):20-21.
[8]王云启.阳和汤加味合云克治疗骨转移癌30例临床观察[J].浙江中医药杂志,2005,1(17):17.
[9]施航.阳和汤和帕米磷酸二钠治疗恶性肿瘤骨痛观察[J].实用中医药杂志,2005,21(6):359.

