Notch1和Jagged1表达与肾透明细胞癌发病及预后
吴科荣,许 乐,张 立,侯 君,林宗明,蒋照辉
1.浙江省宁波市第一医院泌尿肾病中心(宁波315000)
2.复旦大学附属中山医院(上海200032)
我们曾经报道了Notch 通路中重要配体蛋白Jagged1的表达与肾癌的分级、分期、肿瘤大小有关,Jagged1 的表达水平可以作为早期肾癌的独立预后因子[1]。本研究综合利用免疫组化和Western blot的方法,选择2003年3月—2008年11月在复旦大学附属中山医院行肾癌手术,术后病理证实为肾透明细胞癌的病例共计129 例,以更大样本量进一步检测Notch1 与Jagged1 在肾癌组织及正常肾组织中的表达,并探讨蛋白表达与临床病理特征的关系,以及Notch1与Jagged1作为肾癌预后判断指标的价值。
1 对象与方法
1.1 一般资料 本组129例中,男84例,女45例;年龄27~83 岁,平均55.5 岁。采用肾根治术122 例(94.6%),肾部分切除术7 例(5.4%)。肿瘤按TNM(2002 AJCC)分期:Ⅰ期81 例, Ⅱ期17 例,Ⅲ期24例, Ⅳ期7例。肿瘤按Fuhrman分级:1级53例,2级54 例,3 级18 例,4 级4 例。肿瘤大小1.5~15 cm,平均5.3 cm。平均随访时间47.2个月。37例术后出现复发(28.7%),92例未发现肿瘤术后复发(71.3%)。86例无瘤生存,6 例带瘤生存。死亡37 例,其中31 例死于肿瘤,6例死于其他疾病。
1.2 研究对象 本项研究经由复旦大学伦理委员会批准(NO.2008-98)。129例均取术后肾癌组织切片标本,用于免疫组化染色,其中33例同时在距离癌组织边缘5.0 cm 以外的正常组织处取材作为对照。组织标本均采用10%甲醛固定,石蜡包埋,5 μm连续切片。其中8例在术中即刻采集新鲜肾癌标本及远离肿瘤的正常肾组织,用作Western blot检测。组织在经病理检查,迅速导入液氮肿瘤库保存。
1.3 Western blot 肾癌肿瘤组织及相应正常组织共8 例,每20 mg 组织加入0.25 mL RIPARIPA 缓冲液,加入蛋白酶抑制剂混合物,组织匀浆使细胞充分裂解,离心获取总蛋白。以Bradford法作蛋白定量,每个样本取100 μg蛋白,加入上样缓冲液,沸水浴中5 min,行7%SS-PAGE凝胶电泳130 V 2 h后转硝酸纤维素膜,90 V 90 min。转磨结束后取下硝酸纤维素膜,5%牛奶封闭1 h,TBST 清洗,加入一抗(分别为兔抗人Notch1 多克隆抗体ab27526 ,Abcam,UK;羊 抗 人Jagged1 多 克 隆 抗 体sc-6011,Santa Cruz,USA)4 ℃过夜,加入辣根过氧化物酶标记的对应二抗检测。
1.4 免疫组化染色 采用EV二步法染色。常规脱蜡、脱水后,3%新鲜双氧水避光孵育30 min灭活内源性过氧化物酶;热抗原修复(抗原修复液为pH 6.0枸橼酸盐缓冲液)。滴加一抗(分别为兔抗人Notch1多克隆抗体ab27526,Abcam,UK;羊抗人Jagged1 多克隆抗体sc-6011,Santa Cruz,USA),室温下孵育1 h,洗涤后再分别滴加辣根过氧化物酶标记的二抗。DAB 显色、苏木素复染、封片。用已知乳腺导管癌阳性切片做阳性对照,以PBS 代替一抗作为阴性对照。
1.5 染色结果判定 染色片均由3位独立的观察者进行染色评价,观察者对病例信息均无任何了解。染色强度和染色程度的评价依据为既往的文献[2]报道:先在低倍镜下随机选择3个视野(×40),计数100 个肿瘤细胞阳性百分比,定义细胞无染色为阴性,1%~20%细胞染色为1分,21%~60%细胞染色为2分,61%~100%细胞染色为3分。通过观察高倍镜(×200)下肿瘤细胞染色强度,定义不着色为0 分,浅棕黄色为1 分,棕黄色为2 分,深褐色为3 分。定义免疫染色评分为上述2 项指标之和,并定义0~3分为蛋白低表达,4~6分为蛋白高表达。
1.6 统计学分析 所有数据均选用SPSS 15.0软件行统计学分析。蛋白表达与临床病理参数的关系采用卡方检验,生存分析采用Kaplan-Meier 曲线和Cox Regression 模型。P <0.05 认为差异有统计学意义。
2 结果
2.1 Western blot Jagged1蛋白在6例标本的肾癌组织中的表达水平(6/8,75.0%)高于在配对的正常组织中的表达,Notch1 蛋白在7 例标本的肾癌组织中的表达水平(7/8,87.5%)高于在配对的正常组织中的表达(图1)。总体上,Jagged1 蛋白及Notch1 蛋白在肾癌组织中的表达高于其周围正常肾组织中的表达。
2.2 免疫组化染色 Notch1、Jagged1在肾癌组织中免疫组化染色主要表现为肿瘤细胞胞膜染色和(或)胞浆染色,小部分肿瘤细胞胞核亦染色(图2、图3)。Notch1、Jagged1在正常肾组织中的阳性表达率分别为36.4%(12/ 33)、42.4%(14/ 33),在肾癌组织中的阳性表达率分别为95.3%(123/129) 、93.0%(120/129)。Notch1 及Jagged1 在肾癌组织中的表达均高于其在正常肾组织中的表达(P<0.05)。

图1 Western blot显示Notch1蛋白及Jagged1蛋白在肾癌组织及正常肾组织中的表达1T~8T分别代表8例肿瘤组织,1N~8N分别代表8例正常肾脏组织
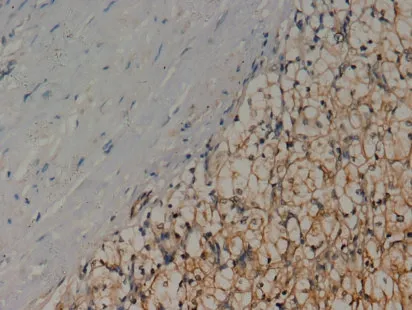
图2 肾透明细胞癌组织Notch1免疫组化染色(×200)

图3 肾透明细胞癌组织Jagged1免疫组化染色(×200)
2.3 Notch1、Jagged1 表达与肾癌临床病理的相关性 随着肾癌病理分级和临床分期的增高,Notch1和Jagged1的表达水平都增高。Notch1和Jagged1的表达水平还与肿瘤大小有关:在直径≥5 cm的肿瘤中的表达要高于在直径<5 cm 的肿瘤中的表达。两者的表达水平在不同年龄和不同性别的病例中无显著差异(表1)。
2.4 Notch1、Jagged1表达与预后的关系 肿瘤复发与Notch1、Jagged1表达水平有关。复发组Notch1 和Jagged1蛋白的表达水平均高于未复发组,差异均有统计学意义(P<0.05)(表1)。
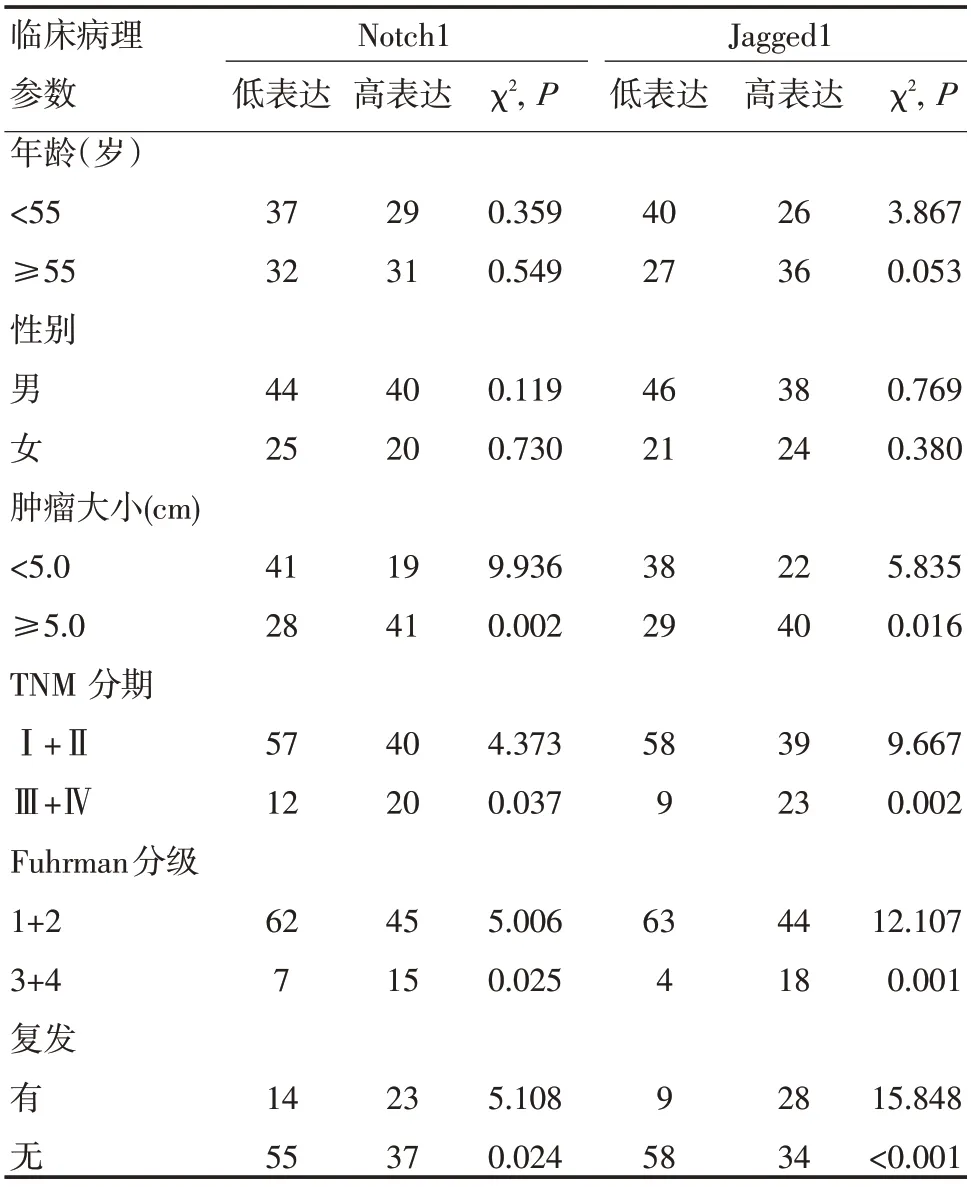
表1 Notch1、Jagged1 的表达与临床病理参数间的相关分析
通过Kaplan-Meier 曲线进行分析,总生存率(overall survival, OS)和无病生存率(disease free survival, DFS)均与Notch1、Jagged1 表达水平有关。低表达Notch1的病例组,其OS和DFS明显优于高表达Notch1 的病例组(P=0.028, 0.032);低表达Jagged1的病例组OS和DFS明显优于高达Jagged1的病例组(P <0.001,<0.001)(图4)。单因素分析显示,Notch1 与Jagged1 表达水平对肾透明细胞癌患者生存率影响有统计学意义。
通过Cox Regression模型,纳入包括年龄、性别、肿瘤大小、分期、分级及Notch1、Jagged1表达水平等因素进行分析,发现Jagged1表达水平可以作为影响肾透明细胞癌预后的独立预后因子(P=0.035,0.028) (表2、表3)。而Notch1 作为独立预后因子证据尚不充分(P=0.917,0.859)(表2、表3)。
3 讨论

图4 A、B:低表达Notch1的病例组,其总生存率(OS)和无病生存率(DFS)明显优于高表达Notch1的病例组(P=0.028, 0.032);C、D:低表达Jagged1的病例组其总生存率(OS)和无病生存率(DFS)明显优于高达Jagged1的病例组(P<0.001, <0.001)

表2 多因素Cox风险模型分析总生存率结果

表3 多因素Cox风险模型分析无病生存率结果
肾透明细胞癌是泌尿系统最重要的恶性肿瘤之一,其发生发展与Von Hippel—Lindau(VHL)抑癌基因失活有关。针对血管内皮生长因子(vascular endothelial growth factor, VEGF)受体的分子靶向治疗,目前已经成为转移性肾癌的一线治疗方法,但仍存在有效率低、不良反应明显等缺点[3]。随着对肾癌分子基因基础的进一步了解,更多的信号通路揭示与肾透明细胞癌发病有关,对这些通路的研究,不仅可以进一步完善肾癌发病机制,而且可能提供其他的治疗靶向[3]。
Notch通路是进化上十分保守的通路,其受体有Notch1、Notch2、Notch3、Notch4,配体包括Jagged1、Jagged2、Dll1、Dll3、Dll4。当受体与配体结合后,受体的胞内段NOTCHIC释放,进入细胞核并启动下游靶基因如Hes基因等的表达。
Notch 通路广泛表达于从无脊椎动物到哺乳动物等多个物种,在细胞的分化、增殖、凋亡、迁徙、粘附等生命活动中都起到重要作用。异常的Notch信号已经证明与许多肿瘤的发生有关。目前Notch与肾透明细胞癌的关系尚不十分明确,研究少且意见不一。Sun 等[4]的研究结果认为,Notch 在肾透明细胞癌中低表达,而Rae[5]、Zhao 等[6]则发现,肾透明细胞癌中Notch3、Jagged1 高表达。Sjölund 等[7]在肾透明细胞癌细胞株中测得Notch通路各组成蛋白高表达,这种表达与经典通路中VHL、HIF-1a、HIF-2a的表达是相对独立的。
在本项研究中,我们通过Western blot和较大样本的免疫组化结果发现,Notch1与Jagged1在肾透明细胞癌组织中存在表达,其阳性表达率高于在正常肾组织中的表达,并且发现Notch1和Jagged1的表达水平与肿瘤的病理分级、临床分期和肿瘤大小均有关。这些结果有力提示,Notch通路在肾透明细胞癌的发生发展中起到致癌的作用。
Notch通路的致癌作用可能与其在维持干细胞功能、抑制细胞分化、抑制细胞凋亡中的功能有关[8]。另外,可能还与其在肿瘤血管生成中的作用有关。Patel 等[9]测定Notch 通路的配体之一DLL-4 在透明细胞癌中的表达,是在正常肾组织表达程度的9倍,并且这种表达与VEGF的表达正相关。Zeng等[10]报道了高表达Jagged1 头颈鳞状细胞癌(head and neck squamous cell carcinoma, HNSCC)细胞更容易形成丰富的肿瘤血管和更大的瘤体。而Sjölund等[7]采用γ分泌酶抑制剂抑制肾癌Notch 通路后发现,细胞周期蛋白依赖性激酶抑制剂(cyclin-dependent kinase inhibitors, CDKi)p21 和p27 水平的上调,揭示Notch致癌的机制还可能与抑制p21和p27有关。
在肾癌预后判断方面,国内外学者在解剖水平、临床水平、组织学水平和分子水平上发现了众多影响因素。其中既有独立的预后因素,也有协同作用的多个因素。在分子水平,研究较多的预后因子有HIF-1α、CAIX、VEGF 等。在本项研究中,我们探讨了Notch1 和Jagged1 对肾癌预后的影响。单变量分析揭示Notch1 与Jagged1 表达水平对肾透明细胞癌患者生存率影响均有统计学意义,高表达Notch1或Jagged1预示肾癌不良预后。而在多变量分析中,Jagged1 的表达水平可以作为判断肾透明细胞癌预后的独立预后因子,显示出其在临床上肾癌预后判断中的意义和价值。国外有人报道,Notch通路在乳腺癌的发生发展中起着促癌的作用,并且Jagged1高表达提示乳腺癌患者的不良预后[11]。而在转移性前列腺癌中,Jagged1高表达的前列腺癌病例的肿瘤复发概率比Jagged1 低表达的前列腺癌病例高[12]。结合我们的结果,我们推测,Notch 通路的活化经由Jagged1介导并与恶性肿瘤形成及疾病进展有关。
与Jagged1不同,Notch1作为独立预后因子依据尚不足。这其中的原因有:⑴Notch通路有多个受体和配体,而Notch1与Jagged1并非严格的一一配对关系。⑵Notch 与其他通路之间存在的交集对该通路的调控和影响。⑶病例数量不足,因此需要更加大样本的研究进一步证实Notch1 在肾癌预后判断方面的作用和价值。
本研究通过使用Western blot 及免疫组化的方法,证实了Notch 通路重要组成蛋白Notch1 和Jagged1在肾透明细胞癌中高表达,并与肾透明细胞癌发生发展有关。单因素和多因素生存分析显示两者(尤其是Jagged1)对肾癌预后的影响,为指导临床上肾癌预后判断提供了新的指标。Notch 通路作为肿瘤治疗靶点待进一步探索,具有广阔的研究前景和价值。
[1]Wu K, Xu L, Zhang L, et al. High jagged1 expression predicts poor outcome in clear cell renal cell carcinoma [J]. Jpn J Clin On⁃col, 2011, 41(3):495-500.
[2]Massi D, Tarantini F, Franchi A, et al. Evidence for differential ex⁃pression of notch receptors and their ligands in melanocytic nevi and cutaneous malignant melanoma [J]. Mod Pathol,2006, 19(2):246-254.
[3]Kim WY, Kaelin WG. Role of vhl gene mutation in human cancer[J]. J Clin Oncol, 2004,22(24):4991-5004.
[4]Sun S, Du R, Gao J, et al. Expression and clinical significance of notch receptors in human renal cell carcinoma [J]. Pathology, 2009,41(4):335-341.
[5]Rae FK, Stephenson SA, Nicol DL, et al. Novel association of a di⁃verse range of genes with renal cell carcinoma as identified by dif⁃ferential display [J]. Int J Cancer, 2000,88(5):726-732.
[6]Zhao H, Ljungberg B, Grankvist K, et al. Gene expression profiling predicts survival in conventional renal cell carcinoma [J]. PLoS Med, 2006,3(1):115-124.
[7]Sjolund J, Johansson M, Manna S, et al. Suppression of renal cell carcinoma growth by inhibition of notch signaling in vitro and in vivo [J]. J Clin Invest, 2008,118(1):217-228.
[8]Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer, and can⁃cer stem cells [J]. Nature, 2001,414(6):105-111.
[9]Patel NS, Li JL, Generali D, et al. Up-regulation of delta-like 4 li⁃gand in human tumor vasculature and the role of basal expression in endothelial cell function [J]. Cancer Res, 2005,65(19):8690-8697.
[10]Zeng Q, Li S, Chepeha DB, et al. Crosstalk between tumor and endothelial cells promotes tumor angiogenesis by MAPK activation of notch signaling [J]. Cancer Cell, 2005,8(1):13-23.
[11]Reedijk M, Odorcic S, Chang L, et al. High-level coexpression of jag1 and notch1 is observed in human breast cancer and is associ⁃ated with poor overall survival [J]. Cancer Res, 2005,65(18):8530-8537.
[12]Santagata S, Demichelis F, Riva A, et al. Jagged1 expression is associated with prostate cancer metastasis and recurrence [J]. Can⁃cer Res, 2004,64(19):6854-6857.

